科学家能否在下一场大流行形成以前就能预测致病微生物现身何处?
萨尔瓦多·阿尔马格罗-莫雷诺于2017年加入美国中佛罗里达大学并建立实验室
新冠疫情这样的灾难对人类来说并非新鲜事,而令我们头疼的是,它们的发生通常是快速且不可预测的:无害的生物可以因突变成为致命威胁,然后如野火般蔓延,诸如夺走无数人生命的鼠疫和霍乱。这两种疾病都由细菌引起,而细菌祖先本无毒,后代却演化成了严重的祸害。
我们无法预测未来,但能通过研究病原性疾病的过往吸取许多重要教训。黑死病开启大流行模式,是在鼠疫耶尔森菌(俗称鼠疫杆菌)经历两次重大变化之后。鼠疫杆菌的前身假结核耶尔森菌(Yersinia pseudotuberculosis)是一种相对温和的肠道病原体,大约在5 000年前,它于欧亚大陆某地转变为一种致命的、能够引发大流行的全身性病原体。演变后的黑死病病原体获得了通过呼吸道传播的能力。鼠疫杆菌的另一次变身则带来了一种叫作ymt的基因,使其能通过跳蚤传播。
看起来细微的遗传变化让这种细菌成功扎根人体,并开始在人群中传播,从而改变人类历史:1347年至1351年间,黑死病肆虐欧亚大陆,导致欧洲损失1/3以上人口。
霍乱弧菌是一种水生细菌,能引起严重腹泻,与鼠疫杆菌类似,也经历了从无害祖先向“恐怖诅咒”的转变;参与其演化史的要素比鼠疫的更多——其中大多数基因是从环境获得的。
可能导致上述微生物突变的事件就像病原体本身一样数量大且种类多。过去几十年间,科学家发现了众多可调节此类转变的机制和因素。这些发现正帮助我们开发更复杂的框架用以应对新出现的病原体,防止它们成为严重的公共卫生问题。
原本不会威胁人类健康的微生物获得了侵占和伤害人体的能力,此过程即为“病原体涌现”。通常来说,当某种微生物——无须人类存在于它生活的环境里,或在人类身上或体内无害生长——状态转变成能够伤害人类,病原体涌现的过程就算发生了。
毫无疑问,新型人类病原体的涌现是我们面临的最紧迫的问题之一。从业近二十年,我一直致力于揭示那套推动微生物突变的生物学规则和演化力量。当我还在爱尔兰国立大学读研究生时,我尝试确定一些被称为“毒力岛”(也作“致病岛”)的大片段DNA,正是它们将致病性霍乱弧菌与其更无害的表亲们区分开来。
随着研究深入,我对病原体涌现问题的兴趣与日俱增。此后,我开启了追逐这种复杂现象的职业生涯。
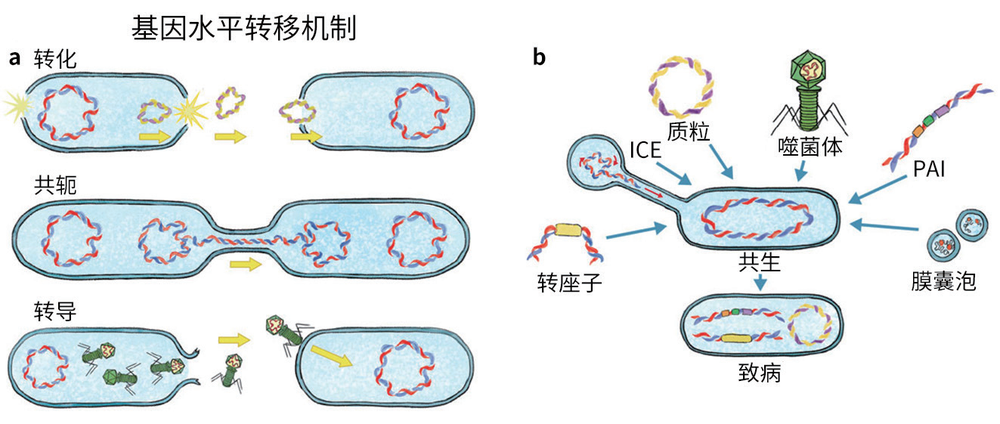
a. 细菌使通过多种机制来获取致病DNA。“转化”意味着直接从环境中获取DNA。当有机体通过称为共轭菌毛的特殊管状附属物交换遗传信息时,就会发生“共轭”。“转导”由噬菌体介导。b. 许多可移动的遗传元件也可以赋予受体细胞毒力特征。转座子是“跳跃”基因,会导致基因组重排,有时还会携带抗生素耐药性。毒力岛(PAI)是可以编码定植因子的大块DNA,常现身于临床病原菌株中。噬菌体还可携带那些编码毒素或影响发病机制所必需因子的毒力基因。共轭转座子(ICE)是在共轭过程中转移并整合到宿主基因组中的元件。膜囊泡是细胞膜的挤压物,形似小球,它们被分泌到环境中,有的会携带毒力基因
在我初出茅庐之时,这个领域也还处于起步阶段。当时的主流观点是,无害微生物获得某些离散的DNA片段,进而赋予生物以某种特性,例如毒素产生,或能够定殖于人类宿主。多年来的新发现提供了更广阔的科学基础,助我们揭示了“温良成祸害”与“微生物基因组”之间的关联。此外,我的小组和其他研究团队都在尝试确定是哪些生态因素驱动了对致病性状和毒株的选择。各种新发现所揭示的联系开始给我们提供关键工具,有望预测导致新型传染源涌现的事件和驱动因素,这对于疾病的成功管理和控制至关重要。
病原体涌现的遗传途径
病原体涌现是一种动态、复杂且多因素参与的现象,涉及各种遗传适应和生态驱动因素的相互作用。微生物为演化而生,诸如霍乱弧菌和鼠疫杆菌拥有极其复杂的演化机制,能够从环境中获取DNA片段,积累突变,从而以人类等多细胞生物绝无可能实现的方式来适应新环境,它们甚至像是进化机器。
通过基因水平/侧向转移获得新基因的过程将极大影响病原体涌现。人类只能将基因垂直地代代相传,微生物却能够以水平传递方式彼此交换大量遗传信息,加速演化。微生物从身边“同行”或周围环境获得遗传物质后,会涌现一些毒力特征。这些特征通常被编码于可移动的遗传元件里,例如质粒、毒力岛或噬菌体——它们作为水平获得的因子,在环境中四处游走,之于病原体的涌现可谓意义重大。了解这些机制的复杂性和丰富性,将有助于我们找到恰当方法探测新涌现的病原体,以及开发监测平台。
微生物可从环境中摄取质粒。长期以来,这种环状DNA分子的水平摄取被认为与毒素及抗生素抗性等致病性状的获得有关,甚至是导致新型病原体涌现的根源,例如原本无害的环境耶尔森菌得到毒性质粒,成为有毒菌株,它的质粒则被称呼为耶尔森菌毒力质粒(pYV),新版本毒菌能克服宿主的防御机制并定殖于淋巴组织。前文提到的大片段DNA毒力岛通常编码对定殖能力至关重要的基因。例如,引发大流行的霍乱弧菌菌株包含几个主要的毒力岛,其中一个编码一种称为“毒素共调节菌毛”的重要肠道定殖因子。噬菌体是有能力感染细菌的病毒,同时也必须寄生于活菌内,在某些情况下可整合至宿主基因组并赋予宿主细胞新的特征。有几种病原体正是以噬菌体为主要工具实现致病力的。噬菌体导致大肠杆菌0157:H7产生毒性,并拥有了引发流行病(出血性肠炎)的能力。此外,噬菌体还将霍乱毒素(腹泻的缘由)赋予了霍乱弧菌。
并非上述所有元件都直接从周围环境获取,例如共轭转座子(ICE)的转移通过细菌共轭实现。此过程需要产生连接两个细菌细胞并允许它们交换遗传物质的细胞外附属物,即共轭菌毛。ICE通常编码提供针对抗生素抗性的基因,帮助细菌在定殖过程中战胜竞争者,提高其在宿主内的存活率。插入序列和转座子是小的“跳跃”元件,可在基因组内“跳跃”并插入不同位置。转座子主要围绕抗生素抗性相关基因移动。有趣的是,插入序列不同于携带和转移毒力相关基因的毒力岛或质粒,它主要通过插入基因来破坏基因。这种字面意义上的DNA移动会导致基因组重排,从而改变基因表达。整合子是一种运动性的DNA分子,可有效捕获和表达来自环境的外源性基因。整合子所捕获的主要是与抗生素耐药性相关的基因,也有一部分可增强毒力和定殖能力。
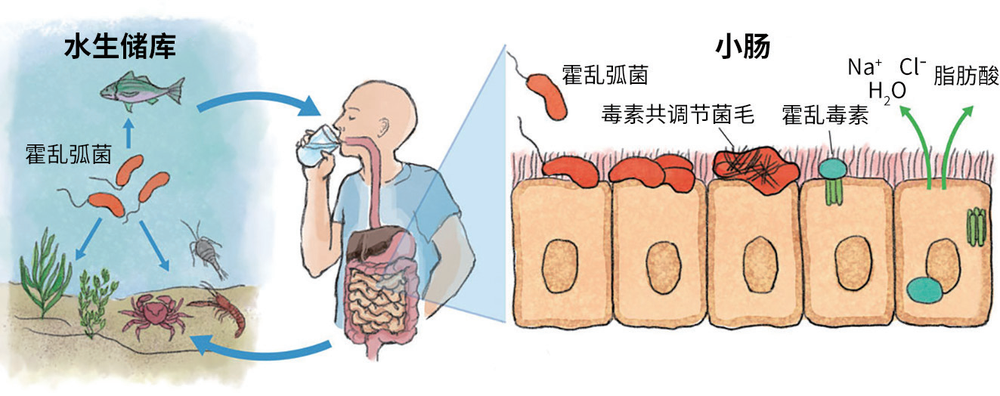
霍乱弧菌是霍乱的病原体,通常生活在水生生态系统中。人类通过食用被其污染的食物或水而感染。一旦进入小肠,霍乱弧菌就会生长毒素共调节菌毛,分泌霍乱毒素。为取食足够的脂肪酸,霍乱孤菌分泌更多的霍乱毒素,这会导致电解质失衡,进而引起腹泻
除了这些典型的水平基因转移模式,科学家还发现了其他转移机制,它们可能在细菌病原体涌现的过程中发挥了重要作用。膜囊泡是细胞膜的挤出物,外形似小球,被分泌至环境中的它们携带细胞内容物,以及关键的DNA。近期有研究显示,来自致病性大肠杆菌的膜囊泡可能含有编码毒力因子的基因,这些基因可致非致病性大肠杆菌菌株的细胞毒性增加。此外,最近发现的基因转移因子(GTA)还包含另一种潜在的水平基因转移模式:GTA为细菌提供“独家”服务,将其随机的DNA片段包装并注入受体细胞。
避免自我破坏
有众多机制和载体可助细菌从环境获得新特征,进而实现可能的重大飞跃,即成为病原体。但生命体的演化并非有的放矢,突变也可能将细菌引向歧途——获得外来基因片段会破坏微生物的生理机能。鉴于此,大量研究者都致力于确定有利于微生物演化的环境和条件。
事实证明,细菌对它们获得和表达的基因非常挑剔。这种基因改组受到各类复杂细胞过程的控制。病原体必须小心平衡基因的获取和表达,新获得的基因可能有助于其定居人类宿主,但不加选择地摄取和同化有害基因会危及它们的生存。为此,细菌设计了复杂的方法用以调节DNA获取和基因表达。相比有利于维持和表达获得性基因的整合子,DNA同化是会受到抑制的——要么通过CRISPR-Cas系统降解传入的DNA,要么通过外源基因沉默子阻止其基因表达。CRISPR-Cas系统作为一种划时代的基因编辑工具受到媒体广泛关注,不过它们最初的功能是细菌用于降解外来DNA片段的防御机制。
有趣的是,研究人员最近发现CRISPR-Cas系统可以防止与病原体涌现相关的特定基因簇的建立。例如,在小鼠感染肺炎链球菌(Streptococcus pneumoniae)期间,靶向荚膜多糖基因的 CRISPR-Cas 序列会阻止这一呼吸道病原体被包装,最终使得感染无法建立。这些发现有助于解释为什么许多主要人类病原体的基因组内缺少CRISPR-Cas系统。
基因沉默是另一种被细菌广泛使用以控制可能与毒力相关的新基因表达的方法——细菌使用外源沉默蛋白结合新基因,从而实现对表达的抑制。这种机制最大程度减小了与外源DNA失控表达相关的潜在负面影响。大肠杆菌内的HN-S等蛋白质是获得毒力基因的关键调节因子,具有相似功能和演化起源的蛋白质也出现于多种主要的人类病原体中,如结核分枝杆菌(Mycobacterium tuberculosis)和铜绿假单胞菌(Pseudomonas aeruginosa)。
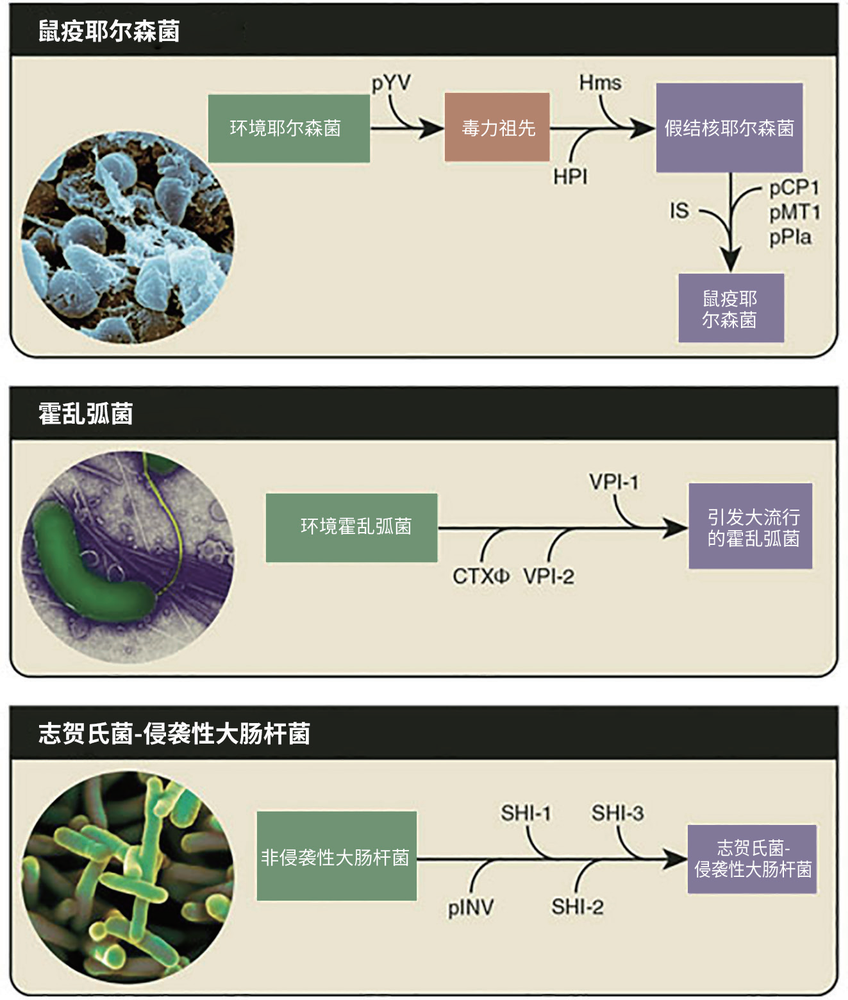
一些细菌病原体是从无害的祖先进化而来的,例如:鼠疫耶尔森菌是腺鼠疫的病原体,它通过获得三个质粒pCP1、pMT1和pPla以及许多插入序列而进化;霍乱弧菌获得了编码霍乱毒素的CTXphi噬菌体和两个毒力岛VPI-1和VPI-2;志贺氏菌在获得pINV毒力质粒以及三个毒力岛(SHI-1、SHI-2和SHI-3)后,便获得了入侵宿主、生存和扩散所必需的分子
毒力适应性
如果成为病原体所需要的只是获得一些可移动的遗传元件,为什么只有少数菌株会引发人类疾病?
赋予霍乱弧菌致病性状的可移动遗传元件能很容易地做交换,而且在霍乱流行地区广泛存在。然而,许多非致病性霍乱弧菌菌株也编码了这些遗传元件和发展出霍乱所必需的噬菌体,可它们依然无毒无害——真正能制造大流行的霍乱弧菌就那一种,它们有何特别之处?
这个问题困扰了我的整个研究生生涯。那会儿我正研究水平获得的DNA在霍乱弧菌中的作用,但直到我成为达特茅斯学院的博士后研究员,我才开始全面、细致地探索它。我基于数据做出了这样一种推测:那些以致病菌形态出现的菌株具备独特基因构成,为可移动遗传元件提供了“肥沃土壤”。几年后,我有了自己的实验室,并与同事发现,致病性霍乱弧菌拥有“毒力适应性多态性”,此类变异为它们提供了对毒力的“预适应”。预适应发生在细菌获得定殖人类宿主的能力之前,且不依赖遗传物质的水平获取。
除了病原体基因组出现的特定预适应,宿主体内的某些突变也在帮助微生物获得毒力适应性特征——此类突变被称为“致病适应性突变”,通常与微生物所定殖的宿主的组织类型、对新陈代谢所需条件的适应或对免疫系统的逃避有关。致病适应性突变之于病原体涌现的重要作用,可引用一典型案例作说明,那就是致病性志贺氏菌出现的故事。
志贺氏菌是水源性和食源性的病原体,可导致严重腹泻,来自与其密切相关的非致病性共生大肠杆菌,后者需要一种CadA介导的赖氨酸脱羧酶的催化方可于肠道内生长。然而,CadA会抑制志贺氏菌毒素的活性。CadA基因的致病适应性突变在各种志贺氏菌身上独立发生,使得其毒素活性不再受抑制,由此,共生大肠杆菌中的致病性志贺氏菌便涌现了。
这些突变还令致病性大肠杆菌得以在新组织中定殖并适应新的生态位。例如,超过90%的共生大肠杆菌会表达一种称为“甘露糖敏感性1型菌毛”的基因,并借助此菌毛定殖肠道。该基因的致病适应性突变有助于细菌更紧密粘附于泌尿道内壁,从而改变大肠杆菌可定殖组织的类型。这种变化最终导致从肠道共生菌向尿路感染致病菌的演化。其他主要毒力表型(包括对宿主防御机制的抗性等)的出现,也与致病适应性突变有关。例如,囊性纤维化患者的肺部易感染共生脓肿分枝杆菌(Mycobacterium abscessus),后者能很好地适应此类肺组织,其发生了大量基因突变,进而提高自己在巨噬细胞内的存活率。
上述例子都强调了独特基因组适应于病原体涌现的意义——它们与水平获得的DNA似乎构成了驱动这种复杂现象的主要分子因素。我的大部分研究都围绕着一个关键问题:哪些进化力量选择了这些致病特征?
意外得到的致病性
致病菌进化的一个主要驱动力来自被掠食。自然环境下的细菌必须面对噬菌体、变形虫等原生动物和蛭弧菌等掠食性细菌的攻击,竭力求得生存。针对此类威胁的各种防御机制的演变,也往往会机缘巧合地创造一些遗传“红利”,使细菌发展出有利于向人类定殖的毒力特征。例如,嗜肺军团菌(Legionella pneumophila)、大肠杆菌和绿脓杆菌拥有的一部分防御机制不仅帮助它们避开掠食者,更为其定殖人类宿主奠定基础。
由嗜肺军团菌引起的军团病是一种严重的肺部疾病,也是一个反映毒力“随机演化”的典型案例。嗜肺军团菌在淡水水库和潮湿土壤里的发展传播,取决于它们在原生动物(如卡氏棘阿米巴原虫)中的生存繁衍。它们的毒力特征因其与水生原生动物的相互作用而演化,“随机演化”后的病原体更善于在人类肺泡的巨噬细胞内生存。可以这么说,细菌大队已经从它们的真核宿主处获得了大量基因。例如,嗜肺军团菌的鞘氨醇-1-磷酸裂解酶(LpSpi)在鞘脂生物合成中发挥着作用,而鞘脂生物合成几乎不会出现于细菌身上,原生动物倒是能进行这项生化过程;LpSpi调节原生动物宿主的新陈代谢,通过阻止感染后自然发生的细胞死亡过程,以帮助嗜肺军团菌生长。有趣的是,该基因与它们的真核宿主相关——这表明了从卡氏棘阿米巴原虫到嗜肺军团菌的水平基因转移。
不光是嗜肺军团菌,整个军团菌大家族都从真核生物那里获得了基因。变形虫可能是未来致病菌们的训练场,因为它们体内正蓬勃生长着多样化(生态学和系统发生学意义上的)的细菌,后者得到的特征将帮助其定殖人类,引发疾病。
鉴于上述种种,我们能够做出可靠推断,那就是自然环境及其居民可以成为最终导致病原体涌现的选择性媒介。随着人类不断改变自然环境,细菌向人类“殖民”道路或许将越发宽广。
生态干扰与病原体
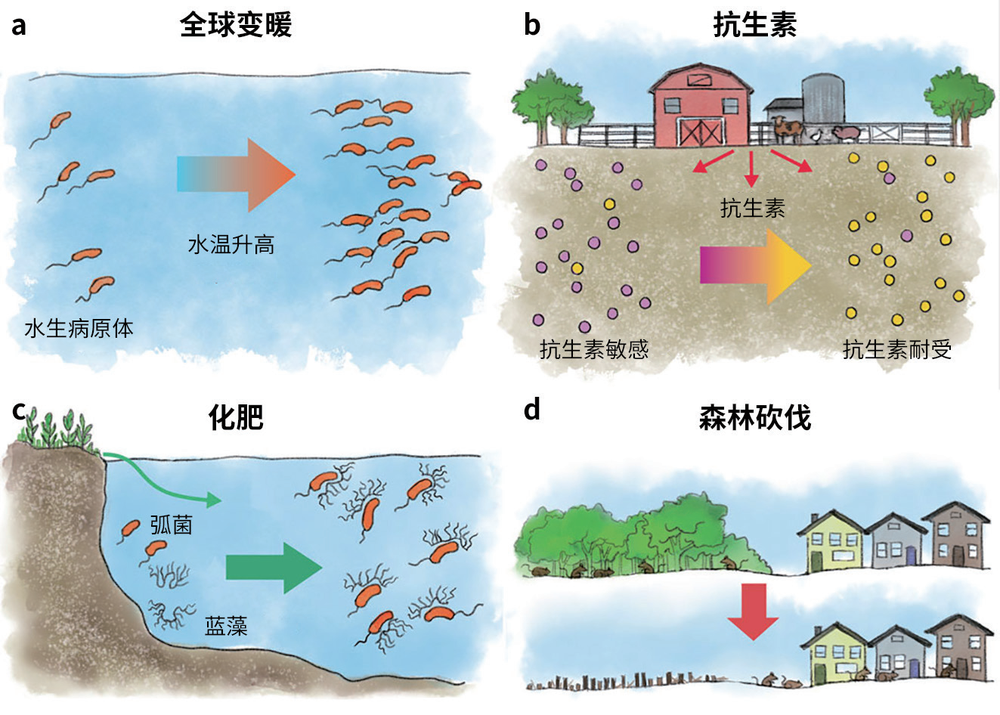
人为的生态干扰,例如气候变化或生态系统污染,正极大影响致病菌的传播和扩散,加速其获得抗生素耐药性,增加新病原体涌现的可能性。过去几十年间,海洋变暖导致弧菌细菌总数及其相关感染的数量显著增加。环境细菌中的抗生素耐药性正急剧增加,这在很大程度上是因为人类向农场饲料添加抗生素,在果园里施用抗生素以防作物病害。大雨造成的化肥径流导致河口与湖泊出现蓝藻水华。我们最近发现,这些水华会导致弧菌快速增殖生长。有趣的是,此前一些研究显示,霍乱病例与孟加拉湾的蓝藻水华存在直接关联。
森林砍伐、城市化和农业扩张等用地变化破坏了生物多样性和食物网结构,也导致栖地碎裂化。人类引起的生物栖息地丧失也将包括病原体在内的很多非本地物种引入人类居所,增加了宿主与病原体的相互作用,最终导致人类、家畜和野生动物遭逢新疾病。例如,秘鲁亚马孙河流域南部的森林砍伐和土地扰动与钩端螺旋体病和巴尔通体病这两种人鼠共患病的发展流行有关;美国东北部的森林碎裂化导致人类感染莱姆病风险增加,原因在于大量白足鼠活动于被人类入侵的林区,而白足鼠又是蜱传病原体伯氏疏螺旋体,即莱姆病病原体的超级传播者;巴西的森林砍伐活动已被证明会影响巴西斑疹热——由媒介传播的立氏立克次体引起——感染风险。
过去80年间的新发传染病事件中,大多数为动物传染病病原体向人类宿主的外溢,其中一半以上是由细菌导致的。然而,除了研究环境扰动如何影响病原体传播或抗生素耐药性,很少有学者会去调查这些变化如何“影响细菌成为致病菌的可能性”或“驱动细菌获得新的致病特征”。这是我们当前认知中还欠缺的内容,若能理解其中科学机制,我们预测和识别潜在病原体来源的能力将得到前所未有的提升。
对环境的各种人为干扰活动正在促进病原体的传播和扩散,例如气候变化、抗生素和化肥的过度使用以及森林砍伐
预测病原体涌现
病原体的涌现是一种动态而复杂的现象,与之相关的研究极具挑战。例如,我们通过研究哪些变量来寻找关联?我们如果找到了一个变量,又怎样才能把相关性转化为因果关系?我们需要多长时间和多少样本来生成准确的预测模型?最重要的是,有无可能建立一个切合实际且高性价比的监测框架?
我和我的团队最近旨在通过践行一种整体性的方法来回答其中一些问题。我们结合生态学、计算生物学和分子遗传学,剖析促进毒力性状和致病性选择的驱动因素;我们聚焦创伤弧菌(Vibrio vulnificus)——一种会在伤口繁殖、侵蚀人肉的致命水生细菌,以其作为模型系统,表明了生态系统如何产生选择压力,促进自然种群里出现具有致病潜力的特定菌株,最终研究结果发表于《美国国家科学院院刊》(PNAS)。这些见解可应用于预测框架,以评估病原体涌现的风险。我们现在是可能做到有效预测突发事件的,公共卫生与疾病管控事业将因此获益。
测序技术的成本越来越低廉,它们的广泛使用有助于解决病原体涌现的根源。例如,当我们能通过技术检查给定环境下的微生物群落及其演化,我们也就可以确定自然因素和人类活动对生态系统的影响。这些方法还可用于识别风险因素,例如某细菌种群中具有致病潜力的菌株的流行,或环境储库中已知毒力因子的可获得性。使用这些技术获得的数据可就新病原体涌现事件的可能性提供有价值的见解。此外,将基因组信息与目前使用的基于细胞培养或PCR的自然栖息地监测相结合,有望提供一种全面、深入且经济实惠的监测潜在病原体来源的方法。这种监测网络和风险因素分析将帮助我们识别和分类高风险栖息地,例如优先选择特定地点和季节来对河流和湖泊进行采样,识别市场上存在相当风险的某些动物和肉类,以及监测特定的啮齿动物或昆虫种群。
除了有望帮助预测病原体涌现,上述方法也能于灾祸发生后发挥作用。例如,围绕导致疫情的环境和遗传因素的回顾性分析,可为预防突发事件提供信息。我们最近用这种方法分析了20世纪90年代在拉丁美洲造成数千人死亡的霍乱,并收获重要的经验教训,这些经验有助于指导未来的防疫抗疫工作。
资料来源 American Scientist
————————
本文作者萨尔瓦多·阿尔马格罗-莫雷诺(Salvador Almagro-Moreno)博士目前就职于中佛罗里达大学伯内特生物医学学院。他正致力于研究细菌病原体的涌现和演化