十年前,伊曼纽尔 · 卡彭蒂耶(Emmanuelle Charpentier)和詹妮弗 · 杜德娜(Jennifer Doudna)于《科学》杂志撰文介绍了一种全新的基因组编辑技术。这是CRISPR领域的开山之作:她们将RNA介导的细菌免疫防御系统改造为一种靶向的DNA系统,论证了利用该系统开展可编程RNA引导的基因编辑的潜力。CRISPR那惊世骇俗的潜力在随后几年间改变了生命科学。
詹妮弗 ·杜德娜(左)和伊曼纽尔·卡彭蒂耶(右)获得诺贝尔奖
从基因驱动到基因筛查,从基因诊断到基因治疗,CRISPR核酸以及常与其配对的Cas酶变革了科学家修改DNA和RNA的方式。正如瑞典皇家科学院秘书长在公告里介绍的,杜德娜和卡彭蒂耶因开发了一种能“改写生命密码”的技术而获得2020年诺贝尔化学奖。然而,通过基因编辑篡改遗传信息也引出了伦理难题。
只要基因编辑技术存在,关于其所有权的法律争夺就会一直持续。杜德娜与卡彭蒂耶的CRISPR团队坐镇加州大学伯克利分校和奥地利维也纳大学,华人学者张锋的团队则属博德研究所(Broad Institute)麾下。两派均声称自己的队伍才是首个将CRISPR-Cas9用于复杂细胞(真核生物)基因编辑的团体。不同国家的专利局就此争论做出了不同裁决,而美国方面的最新决议是,隶属麻省理工学院和哈佛大学的博德研究所保留在真核生物中使用 CRISPR-Cas9 的知识产权,而卡彭蒂耶、加州大学和维也纳大学保留使用CRISPR-Cas9进行体外及原核生物编辑的原始专利。
尽管存在争议,CRISPR技术的学术和商业探索——从基因治疗到作物改良——仍将继续。以下是科学家妙用CRISPR的七大招式。
基因驱动
基因驱动是指通过特定手段令某种等位基因有偏向性地遗传,使得后代继承该基因的比例更高,从而使得特定突变及其控制的性状在种群内迅速扩散。但人为推动基因驱动绝非易事。CRISPR出现以前,科学家们已多次尝试,但都不得不承认制造转基因品种是桩艰巨任务。CRISPR技术加速了基因驱动的发展,研究人员借助它成功创建基因驱动。在2015年,科学家培育了大量抗疟疾寄生虫的蚊子。2019年,研究人员对小鼠做基因改造,令其后代更有可能通过白色皮毛散发红光,实现了对哺乳动物的首次基因驱动。
基因筛查
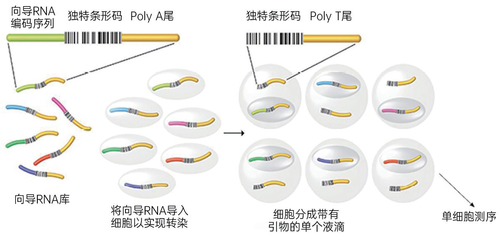
单细胞筛查(SINGLE-CELLSCREEN):一座向导RNA库(每条RNA都针对一个基于CRISPR干扰的独特基因,并携带一独特条形码序列)被引入一个细胞群;细胞群的浓度导致平均每个细胞有一向导RNA进入。接着将单个细胞分类成小滴,小滴上带有独特的条形码polyT引物,用于提取细胞的mRNA。之后对RNA的测序揭示了引入的基因突变(由向导RNA决定)以及由此带来的转录效应(由携带细胞特异性条形码的mRNA决定)
CRISPR出现以前,RNA干扰(RNA interference,简称RNAi)是用于识别疾病相关突变或评估细胞内潜在药物靶点的主要技术。RNA干扰是指双链RNA特异性地结合与之互补的mRNA,导致后者降解,从而特异性地抑制基因表达。RNA干扰需要设计与mRNA结合的RNA链,以阻止特定基因产生蛋白质。而CRISPR可带来更高效、更具特异性的靶向和抑制,因此CRISPR/Cas9迅速被用于大规模基因筛查。
例如,将CRISPR筛查与类器官和遗传条形码技术相结合,帮助研究者在2021年发现了新的小脑症的调控基因。小脑症是一种罕见的神经系统疾病,此症患儿的大脑在怀孕期间未能正常发育,或于出生后停止生长,其头部较正常婴儿小得多。2016年,其他学者使用CRISPR筛查来寻找之于癌症免疫疗法研发不可或缺的基因,或识别非编码DNA中的增强子。
由于CRISPR可针对特定基因序列进行设计,学界正开发基于CRISPR的病原体平台,旨在快速经济地检测包括寨卡病毒、HPV和埃博拉病毒等在内的病原体。杜德娜实验室于2018年首次推出的DETECTR诊断系统通过检测核酸序列确认病毒身份。DETECTR使用一种别样的Cas酶——Cas12a。该酶能在结合目标序列后切断单链DNA。最初,他们将 CRISPR/Cas12a靶向人类乳头瘤病毒序列,其中包括一种报告DNA分子(reporter DNA molecule),会在被切割时发光,这使得任何阳性样本都很容易被发现。麻省理工学院的张锋发明了一种名为SHERLOCK的类似工具,并证明了它通过单点突变区分不同序列的能力——这意味着SHERLOCK可用于基因分型以及病毒变种和癌性突变的识别。
SHERLOCK和DETECTR目前都已被用于诊断新冠。miSHERLOCK自有一套完整的COVID-19检测体系,可在 3D打印设备中从头至尾地运行检测过程。至于DETECTR,研究人员将它与LAMP法相结合,后者全称为“环介导等温扩增法”(Loop-mediated Isothermal Amplification),是一种无需PCR即可扩增核酸序列的方法。在阳性测试中,Cas12酶能锁定其目标序列,并对核酸疯狂切割,还会切断一种报告分子(阳性测试可检测出此分子)。另一项基于CRISPR的方法最初被用于检测镰状细胞性贫血,现在也是识别新冠病毒的有利工具。
CRISPR的靶向特异性并不拘泥于核酸。另一个基于CRISPR的“CAMERA”系统可记录下来自人类和细菌细胞的化学信号。(CAMERA全名为CRISPR-mediated analog multi-event recording apparatus,可译作“CRISPR介导的模拟多事件记录装置”。)在CAMERA系统中,向导分子只产生于某些特定条件下,例如存在抗生素。一旦有了向导,CRISPR系统就会剪断某些DNA质粒,而又不切割其他质粒——靶向特异性决定哪些质粒被切割。通过测量这两类质粒的比例,研究人员可确定细胞是否暴露于某种条件下。诸如CAMERA之类的CRISPR工具也被用于生物传感器,以检测抗生素、营养素或毒素等化合物。
如果唾液样本中含有SARS-CoV-2的RNA,miSHERLOCK设备会发出明亮的光
基因治疗
基因编辑还为基因治疗打开大门。基因治疗旨在通过精确改变基因组以治疗或预防疾病。2017年,科学家借助锌指核酸酶,首次在人类身上实现了基因治疗。锌指核酸酶是一种基因编辑技术,在CRISPR-Cas出现以前曾风光无限,能够更精确地插入基因,因此称得上基因治疗的一柄良器。CRISPR 在2020年首次用于编辑活人体内基因:当时美国波特兰的医生将一种基于CRISPR的医疗包注射至患者视网膜以治疗遗传性失明。其他CRISPR基因疗法的试验,包括针对转甲状腺素蛋白淀粉样变性和β-地中海贫血等疾病的试验,都正在进行中。
医学应用
CRISPR编辑的治疗应用不必直接针对患者基因组。眼下开展的多项工作尝试以其他方式兑现CRISPR的医用潜力。例如,生物技术公司Eligo Bioscience正在开发基于CRISPR的战痘方法——靶向携带寻常性痤疮相关基因的痤疮丙酸杆菌。其他研究者正使用CRISPR来修饰CAR-T细胞。CAR-T细胞全名为“嵌合抗原受体T细胞”,是经过基因工程改造的T细胞,可产生用于免疫治疗的人造T细胞受体。CAR-T疗法是一种癌症免疫疗法,通过对患者的T细胞重新编程,以标记癌细胞进行破坏。不过这些于2020年被证明了安全性的CRISPR工程化CAR-T细胞尚未进入临床。
作物和牲畜改良
自从有了农耕,人类就一直努力提升食材品质,尤其是在自己养殖的食用动植物方面。起初,这些努力以人工选择和诱导突变的方式践行,追逐可遗传的理想性状。但现在,基因编辑帮助科学家们更精确地培育出有着更高产量、更强抗病性、更优营养成分以及其他有益特性的生物体。虽然锌指核酸酶和TALENs(一种可靶向修饰特异DNA序列的酶,全名“转录激活因子样效应物核酸酶”)等技术可以并且已经用于对作物和牲畜进行遗传改良,但这些技术比CRISPR更昂贵,精度更低。农业科技领域正在开展的CRISPR相关创新包括不变色蘑菇、抗病香蕉和小猪,以及高生产率的玉米。
用CRISPR改造的猪对PPRS病毒有抗性
基础研究
相比其他基因编辑技术,CRISPR成本低,精度高,用起来方便,这使它成为各个研究领域的首选技术。例如,CRISPR编辑为科学家们提供了关于长颈鹿奇怪体型来源的线索:在2021年的一项研究中,科学家将长颈鹿相比于其他反刍动物差异最大的基因——FGFRL1基因——插入小鼠体内,结果发现了一些细微变化,这些变化似乎表明长颈鹿的FGFRL1增强了机体骨骼和血管,以应对其独特的生活方式。研究人员还利用经CRISPR编辑的埃及伊蚊发现了人类皮脂中的特定化合物,标志着人类对昆虫的吸引力。2022年,科学家使用CRISPR-d/Cas9系统(CRISPR/Cas9的姊妹系统)成功逆转表观遗传标记,并减轻了大鼠的焦虑和嗜酒倾向。此成果表明,对表观基因组的深入解读有助于治疗“酒精使用障碍”。
资料来源 The Scientist
————————
本文作者苏菲·费斯尔(Sophie Fessl)是神经生物学博士,自由科学作家