25年之后,关于早老性痴呆症的淀粉样蛋白假说再次联系起它在朊病毒研究中起到的根本作用……

1984年9月,一组来自世界各地的优秀研究人员在苏格兰聚会,共同探讨一种折磨绵羊和山羊的疾病――瘙痒症。动物尸检时发现,在患有瘙痒症的动物大脑中发现了斑状物,这使人不由想起了早老性痴呆症患者的大脑充斥的淀粉样蛋白斑块。
新假说的提出
瘙痒症(一种羊患的疾病),如同它的称谓一样,不仅只对农牧业方面有重要联系。在医学上,对于这类破坏大脑的新兴疾病来说,它也是最容易研究的一种。该疾病由一种动物传染到另一种动物,当时并没有查出任何的病毒或其他微生物。然而留下的一个大线索是,这些疾病遗留下来的由数以百万计的微小纤维组成的不溶性团块或斑状物,而且每条纤维都由数以百计或千计的蛋白质组成。由此一个吸引人的新假说提出:这些纤维和它们的斑状物标记了具有毒性的感染性蛋白颗粒或朊病毒的通道。
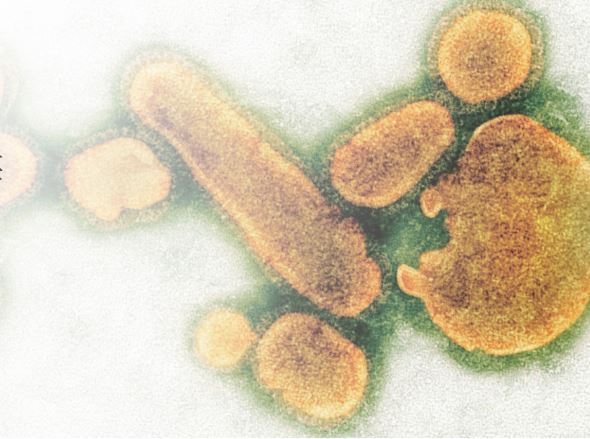
早老性痴呆症患者大脑中的淀粉样蛋白

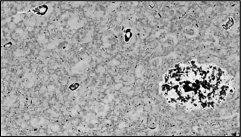
在瘙痒症动物大脑中发现的斑状物
在那次会议的第一个夜晚,几名研究人员聚在一起用餐。其中有澳大利亚西澳大学的神经病理学家科林•马斯特斯(Colin Masters)和德国科隆大学的蛋白质-测序专家康拉德•贝伊鲁瑟(Konrad Beyreuther)。当马斯特斯告诉贝伊鲁瑟在瘙痒症中发现的斑状物与一种人体疾病,即早老性痴呆症中的淀粉样蛋白非常相似。
“直到那时我才听说早老性痴呆症。”贝伊鲁瑟回忆道。似乎很难记起早老性痴呆症是如何进入公众意识中的。这一疾病首次出现在医学文献之后的几十年中,它是指一种关于痴呆的模糊的早期发病形式。现在我们所了解的普遍的晚发性阿尔茨海默氏症在那时称之为“老年性痴呆”,这在老年人中如此普遍,以致似乎不值得作为一种疾病分类。
神秘的蛋白质
也很容易忘记在早老性痴呆症研究的开端,它曾被怀疑是一种朊病毒疾病。我们往往认为朊病毒和早老性痴呆症之间的关系非常接近。例如,2010年德国图宾根大学的马赛厄斯•扎克尔(Mathias Jucker)领导的一支团队报道,他们可以用一种类似于朊病毒的方式,将早老性痴呆症患者的大脑物质注射到小鼠体内来了解早老性痴呆症类型的大脑病理学。这些发现有助于对早老性痴呆症的起因进行反思。但这种反思在一定程度上是一种复兴,如同马斯特斯和贝伊鲁瑟早先对早老性痴呆症产生兴趣一样。这个故事提醒我们,与朊病毒相联系并不是新想法,马斯特斯说:“那只是个开始。”
在1984年,对早老性痴呆症患者进行验尸揭示了那些类似于在瘙痒症中发现的淀粉样蛋白斑块,通常由垂死的神经元和弯曲的轴突与树突所环绕。当用刚果红浸润进行病理染色并利用偏振光照射时,类似于瘙痒症斑状物的早老性痴呆症斑状表现为苹果绿,这是能使纤维紧密结合的氢键的柱状标志,具有此种特性的蛋白质积聚物称为淀粉样蛋白。
同年早些时候,加州大学圣地亚哥分校淀粉样蛋白研究人员乔治•格伦(George Glenner),报道了从早老性痴呆症患者脑血管组织中分离出一种小蛋白,这一蛋白存在于淀粉样蛋白沉积物中。早老性痴呆症大脑中的蛋白与格伦的血管沉积物中的蛋白一样吗?或者它更类似于瘙痒症蛋白?
马斯特斯和贝伊鲁瑟在晚餐上决定合作以查明这些问题,他们可能比其他人对推动现代早老性痴呆症研究――淀粉样蛋白假说――的贡献要大。
马斯特斯在研究过程中纯化了一些早老性痴呆症淀粉样蛋白。当样品抵达德国后,贝伊鲁瑟和同事利用甲酸将其溶解,并对溶解后的碎片进行筛选以寻找最小且稳定的蛋白――后被证明这是一个约含40个氨基酸的小型多肽,他们将其称为A4。序列显示,A4不是瘙痒症蛋白或与其相似,本质上是由格伦从血液组织中分离出的蛋白。
经研究,贝伊鲁瑟团队确定了A4属较大的神经元蛋白――淀粉样前体蛋白(APP)的一个片段。他们在21号染色体上发现了编码APP的基因,这又是一个大线索,如同唐氏综合征患者,他们具有一个额外的21号染色体的拷贝。现已查明,唐氏综合征患者40岁左右会发展为类似于早老性痴呆症大脑斑状物。现在,APP和A4的过量产生揭示了在唐氏综合征中存在这些斑状物的可能原因,这些斑状物也可能存在于早老性痴呆症中。
过多的聚集
当大部分研究人员热衷于围绕APP开展研究时,其他三个由马斯特斯和贝伊鲁瑟在最初研究时得出的重要线索,在未来十年大部分时间内几乎完全被忽略。
第一个是贝伊鲁瑟对不同溶剂混合物中A4形式的观察。他指出了由两个、四个或者更多的A4拷贝组成的稳定簇或者低聚体的存在。多肽形成的这些低聚体如此牢固,以致在特定溶剂中由两个A4拷贝组成的二聚体比单体更加普遍。
第二个是全长的A4极容易聚集。在获得全部的A4序列后,贝伊鲁瑟开始在实验室中合成各种长度的A4,包括起始于最长变异体的第42个氨基酸并朝着相反末端合成的一系列A4。“当接近多肽的末端,并将其从树脂上洗脱下来时,我们发现多肽变得容易聚合,”他回忆道,“我认为‘上帝啊,要下雪了!’多肽聚合得如此之快,这太可怕了。”
在马斯特斯和贝伊鲁瑟提出A4的首批抗体并将它们用于检测淀粉样蛋白的沉积物后,出现了第三个线索――这些淀粉样蛋白在尸检中具有前所未有的灵敏度,它们几乎总存在于80岁以上老人的大脑中。在稍微年轻的大脑中,这些斑状物往往是更加稀少和分散,但仍然可以在大约20%的认知能力正常的人群中检测到。这些人群在50多岁即死亡。在症状出现之前的三十年中,斑块就开始在大脑中形成,所以这暗示着早老性痴呆症几乎是不可避免的。“我认为这非常惊人。”贝伊鲁瑟说。
淀粉样蛋白假说
至20世纪80年代末,马斯特斯和贝伊鲁瑟已经大规模完成了A4方面的发现工作。而美国科学家在早老性痴呆症研究中起到了引领作用,首次将A4蛋白命名为β-淀粉样蛋白,其中β是指淀粉样蛋白中的β折叠分子结构。尽管他们没有对最初的与朊病毒之间的联系过多强调。马斯特斯说:“这其中有一些继我们之后的年轻科学家,他们似乎对朊病毒的概念不是很清楚。”
通常由神经元产生的个别β-淀粉样蛋白多肽能以至少两种形式聚集。一种途径指向不溶的、形成斑块的小纤维,其他途径指向可溶性的低聚体――它们小到可以进入突触。据推测,这些低聚体可能是早老性痴呆症中的主要有毒物。
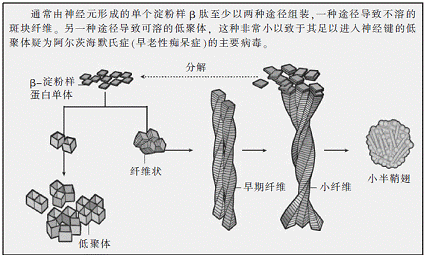
聚合的两种途径
即便如此,低聚体迅速聚集似乎被认为是β-淀粉样蛋白引起的早老性痴呆症。20世纪90年代早、中期,体外研究表明,β-淀粉样蛋白开始聚集时会对神经元产生毒性。对早发的早老性痴呆症家庭进行的遗传学研究,并结合在这些家族中检测到的编码APP基因变异体的分析发现,其中的一种变异体APP基因能引起β-淀粉样蛋白发生7倍的过量表达。在小鼠实验中,过量表达β-淀粉样蛋白形成的斑块与在早老性痴呆症中发现的相似,小鼠在测试中其行为表现出一些认知障碍。
淀粉样蛋白假说看上去很简单:当大脑中的β-淀粉样蛋白浓度变得非常高时,蛋白就会聚合成小纤维和斑块并开始杀死神经元。
最终弄清楚这个情况并不那么简单。进一步的遗传学研究发现,家族性早老性痴呆症,通常不总是由β-淀粉样蛋白过量表达,而是由β-淀粉样蛋白一种不常见的变体相对过量表达引起的。这种变体称为Aβ42,全长为42个氨基酸,这一极其容易聚合的变体引起了贝伊鲁瑟的警惕。
Aβ42的发现仍然与淀粉样蛋白假说相一致,研究人员在20世纪中期就意识到在大多数斑块中存在的变异体是Aβ42。问题是具有Aβ42过度剂量的老鼠模型,缺乏与人类疾病有关的大量神经元缺失和认知缺陷。这一老鼠模型与过度表达APP的首只患有早老性痴呆症的老鼠模型相似。长期从事早老性痴呆症研究的哈佛大学神经病学家布鲁斯•扬克尔(Bruce Yankner)说:“这些模型具有一些认知能力下降的特征,但无论怎样也不像人一样具有全面的早老性痴呆症症状。”
一些研究人员推测,与早老性痴呆症患者相比,大脑较小、存活时间较短的小鼠不能准确反映这一维持时间较长、患者大脑较大的疾病。但是,另一种在20世纪90年代末流行的观点是,β-淀粉样蛋白并不是痴呆症的真正诱因。例如,尸检研究表明,早老性痴呆症的进展并不与斑块的发展有很大联系。就像马斯特斯等人早先观察的那样,在任何认知迹象下降前,大脑中的斑块已经非常密集了。
然而,一些制药公司已将他们的赌注压在了β-淀粉样蛋白假说上了,众多药品研发方案很难说会在临床试验中成功。但在此期间,一些研究人员开始酝酿制定一个包括早老性痴呆症和各种其他淀粉样蛋白形成的疾病的新假说。
再访低聚体
遗传学证据差不多可确定β-淀粉样蛋白的聚集能以某种形式导致早老性痴呆症。斑块中的纤维是积聚物的最明显形式,因此是最明显的可疑物。只有在斑块假说失败后,研究人员才会返回到其他的积聚物――由贝伊鲁瑟等人在科隆首次发现的β-淀粉样蛋白低聚体。
像朊蛋白一样,β-淀粉样蛋白可能是以一种感染形式分布在大脑组织中。20世纪早、中期,加州大学欧文分校的查尔斯•格拉伯(Charles Glabe)和哈佛大学的丹尼斯•塞尔柯(Dennis Selkoe)利用β-淀粉样蛋白进行实验时发现了低聚体。在对致病纤维进行研究的过程中,他们将这些低聚体看作是可存在的中间体而不是这一疾病全面发展的驱动力。但在1998年,据位于伊利诺伊州埃文斯顿的西北大学的威廉•克莱因(William Klein)实验室报道,低聚体可能是早老性痴呆症的真正起因。当他们将一种化学物加入到β-淀粉样蛋白溶液中以阻止其形成纤维时,后者反而形成低聚体,并开始杀死临近的神经元。
由此看来,至少这种毒性似乎是低聚体削弱了神经元之间的连接点――突触――后的结果,同时也损害了突触的有助于学习和记忆的能力。不久后,相似结果在塞尔柯和格拉伯的实验室得到验证,而且老鼠模型也及时地揭示了低聚体的毒性。
在21世纪,一种新共识开始出现:β-淀粉样蛋白纤维本身具有较弱的毒性,这些纤维似乎能引起有害炎症。特别是当斑块异常密集时,它们易于将β-淀粉样蛋白丢弃,而这些淀粉样蛋白则会再次转变为低聚体。在这个模型中,β-淀粉样蛋白低聚体是更加使人烦恼的神经毒素。的确,β-淀粉样蛋白纤维可能在它们以一种危害较小的形式设陷阱捕捉聚集的β-淀粉样蛋白的范围内具有保护性质的。
研究人员现在认为,β-淀粉样蛋白低聚体通过直接结合到神经元的膜上或特异性受体上来产生有害效应。据推测,其中的特异性受体包括胰岛素和NMDA谷氨酸受体,这些受体和神经元的膜都是神经元信号传导所必需的。但是,如果β-淀粉样蛋白只对神经元产生毒性,它们可能永远不会制服大脑的清除机制,也不会引发疾病。要做到这些,β-淀粉样蛋白似乎需要其他的与朊病毒相关的毒性――传染性。
朊蛋白
探究朊病毒
早老性痴呆症可能是一种朊病毒病,这一想法最初由加州大学旧金山分校的斯坦利•普鲁西纳(Stanley Prusiner,1997年诺贝尔生理或医学奖得主)在1984年提出的。在发现β-淀粉样蛋白不同于瘙痒症蛋白后,他的这一想法曾引起广泛的讨论。但到了2005年左右,在本质上人们明白了普鲁西纳是正确的――β-淀粉样蛋白和朊病毒病都具有毒性和自我复制的状态。
普鲁西纳也同马斯特斯和贝伊鲁瑟一起参加了苏格兰的晚餐,但他关于复制机制的观点显然是错误的。最初他提出感染性的朊病毒是一种具有错误折叠形状的蛋白单体,能诱导正常版本的蛋白产生相同的错误折叠。
然而,如同麻省理工学院的彼得•兰斯伯里(Peter Lansbury)在20世纪90年代中期进行的一系列体外试验中所显示的那样,朊病毒病和早老性痴呆症中的关键自我复制子看似是一个低聚体而不是一个单体。一旦低聚体形成了,它就会变成一个能吸引新单体的模板或者“种子”,与附近的细胞核快速发生聚集。目前在剑桥市一生物技术公司任职医药首席科学家的兰斯伯里说:“这是一种非线性现象,在此过程中细微的变化能产生巨大的效应。”
一旦“种子”与细胞核聚集,其中的一种细胞核将作为模板以产生新的低聚体,另一种细胞核将产生不断延长的纤维。兰斯伯里表示这种最初的成核现象,比在朊病毒蛋白和Aβ42中发现的具有特殊粘性的一段氨基酸发生得要快――添加来自Aβ42的这段氨基酸甚至添加全长的Aβ42,能够引起附近所有β-淀粉样蛋白迅速聚集。贝伊鲁瑟所说的“雪花”比喻是恰当的:一个类似的成核现象位于冰和雪结晶的中心。
最近,扎克尔和其他人表明,包含来自早老性痴呆症患者的β-淀粉样蛋白的大脑物质能够集结小鼠中的斑块。β-淀粉样蛋白不如朊病毒蛋白耐寒,因此从一个人身上“跳”到另一个人身上的可能性要小得多,但β-淀粉样蛋白在组织中确实以一种类似于感染的方式传播。自从扎克尔表示其本质是具有感染性的之后,现已在海德堡大学工作的贝伊鲁瑟说:“尽管我远离β-淀粉样蛋白的研究已经很多年了,但我再次对它产生了兴趣。”
类似的感染性已经在tau蛋白和帕金森氏症的α-突触核蛋白的聚集体中观察到了,这也在早老性痴呆症末期所影响的细胞中出现。研究人员推测,许多其他与淀粉样蛋白相关的疾病都具有相同的毒性和寡聚机制,并且涉及到一项缓慢传播的病理学,这一过程从最易受到这一疾病攻击的大脑区域开始。兰斯伯里说:“我们知道,存在帕金森氏症运动神经迹象的群体总是差不多在20年后患有帕金森氏症痴呆。”作为对照,早老性痴呆症在早期就会影响记忆和认知能力。
根据贝伊鲁瑟的想法,原则上在我们的食物、空气和水中会有蛋白质结构,这些物质会进入大脑并促使引发疾病的蛋白聚集体不断恶化,“这些聚集体就像窗户上冰晶体中的一小部分尘埃,”他说,“如果那是正确的话,我们就有麻烦了。”
资料来源 Nature
责任编辑 则 鸣
――――――
本文作者吉姆•施纳贝尔(Jim Schnabel),佛罗里达州迈阿密市一科普作家。