长期以来,痛觉一直被视为生物进化所不可或缺的一种“痛苦的美好”。它检测伤害的存在,发出提示信号,就像智能而敏锐的警报系统,及时提醒大脑:请暂停一下下,看看自己身体有没有什么问题。
但痛觉真的仅仅是个警报系统吗?有没有可能,疼痛本身就是一种自我保护机制,不走大脑直接施法的那种?
哈佛医学院的科学家最近在小鼠身上发现了这种“痛苦的保护”。他们于10月14日在《细胞》杂志发文称,小鼠肠道内的疼痛神经元具备保护肠道的作用,因为它能调节肠黏液的分泌;当肠道处于炎症状态时,疼痛神经元会刺激肠道细胞释放更多黏液,从而增强对肠黏膜的保护。
论文通信作者、哈佛医学院布拉瓦特尼克研究所(Blavatnik Institute)的免疫生物学副教授艾萨克·邱(Isaac Chiu)表示:“事实证明,除了探测潜在伤害并向大脑发送信号,疼痛还可能以更直接的方式保护机体。这项工作揭示了肠道中疼痛介导神经与肠道上皮细胞之间的对话。”
邱副教授等人的成果让我们认识到神经系统在肠道内发挥的重要作用——不仅仅带给我们不愉快的感觉,也是维持肠道屏障的关键因素,应对炎症的高效机制。
肠道内的神经元和分泌细胞直接对话
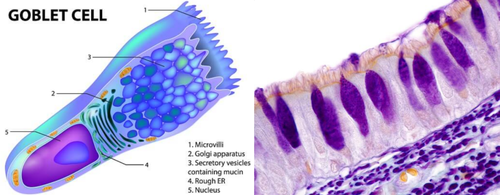
肠道和气道的上皮组织布满了杯状细胞,细胞内含由蛋白质和糖组成的凝胶状黏液,可作保护涂层,令器官表面免受磨损侵蚀。
杯状细胞的结构示意图(左)和组织学染色图(右)
通过对小鼠模型的观察和实验,作者团队发现:
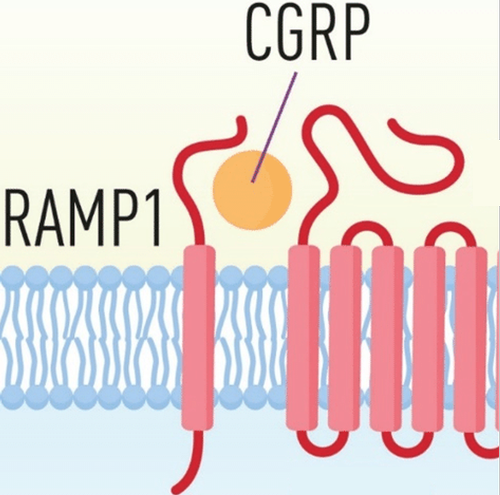
杯状细胞周边的疼痛神经元会被饮食或微生物信号,以及机械压力、化学刺激或温度的剧烈变化激活,进而释放一种名为CGRP(全称“降钙素基因相关肽”)的化学物质,CGRP刺激杯状细胞表面的RAMP1受体(全称“受体活性修饰蛋白1”),从而增加肠道黏液分泌。
微生物信号自然是来自肠道微生物的。根据邱副教授的说法:“杯状细胞周围存在的某些肠道微生物,似乎会刺激神经并导致杯状细胞释放黏液,从而保持肠道以及肠道微生物的健康。”
饮食因素在激活痛觉感受器方面的作用同样不容小觑。当研究人员给小鼠注射辣椒素(辣椒的主要成分,能引发剧烈的急性疼痛)时,小鼠的疼痛神经元迅速被激活,紧跟着就是杯状细胞释放大量保护性黏液。
这里需要指出,人类与小鼠的情况一样,杯状细胞中也有RAMP1受体,能对CGRP做出响应。
CGRP与RAMP1受体的示意图
相比之下,缺少疼痛神经元的,或是杯状细胞缺少可响应CGRP的受体的小鼠,肠道黏液较少,菌群失衡情况更严重,更容易患结肠炎。此发现也可以解释为何肠道菌群失调者可能更容易患结肠炎。
而当研究人员将CGRP人为地给予缺少疼痛神经元的小鼠时,它们的黏液分泌情况迅速改善,并得以免受结肠炎之苦。
论文第一作者、哈佛医学院的博士后研究员杨大平表示:“疼痛是肠道慢性炎症(如结肠炎)的常见症状。而我们的研究表明,急性疼痛也发挥着直接保护作用,CGRP则是导致保护性黏液分泌的信号级联反应的关键发起者。”
止痛药或能损伤肠道
鉴于针对结肠炎患者的治疗常用到止痛药,我们需要认真考虑阻断疼痛所可能带来的有害后果。
邱副教授指出:“肠道炎症患者的主要症状之一是腹痛。因此很多人会认为应当采取阻断疼痛的措施以减轻患者痛苦。但现在我们认识到这种疼痛信号可能具有直接保护作用,这引起了关于疼痛管理的思考——怎样以不导致其他伤害的方式来谨慎管理疼痛?”
此外,一类抑制CGRP分泌的常见偏头痛药物可能通过干扰这种保护性疼痛信号来破坏肠道屏障组织。
“如果偏头痛患者长期服用此类药物,长期阻断肠道的疼痛保护机制,会发生什么?药物会干扰黏膜内层和人体微生物组吗?”
治疗偏头痛的CGRP拮抗类药物
除了分泌保护黏液,肠道中的杯状细胞具备多种其他功能。例如,它们为抗原提供通道;其产生的抗菌物质可保护肠道免受病原体侵害。杨大平表示:“杯状细胞的其他功能是否也受疼痛纤维调节?这是我们之后要探究的内容。”
另一方面,他们也将探索CGRP信号通路的中断问题,并尝试确定炎症性肠病的遗传倾向性与肠道疼痛障碍之间的关联。
资料来源:
Study finds unexpected protective properties of pain
Pain-sensing gut neurons protect against inflammation
END