癌症是什么?癌症就是身体里面出现不死的、疯狂生长的异常细胞——癌细胞。癌细胞通常由人体内正常细胞发生癌变而形成。当正常细胞发生基因突变,就会产生癌变,而人体内有两种与癌症发生相关的基因,第一种是癌基因(oncogene),第二种是抑癌基因(tumor suppressor),如果这两种基因发生突变,就可能发生癌症。
那么癌症会遗传吗?抗癌的靶向药物有哪些?被誉为“靶向药物的圣杯”的p53靶向药物是什么?我国科学家在研发p53靶向药物上有哪些贡献?判断一个抗癌药物是否有效的标准是什么?很多这些有趣问题的答案,本文将为您一一揭晓。
癌症是什么?
癌症泛指所有的恶性肿瘤,英文名为cancer。cancer这个词汇的本义是“螃蟹”,这种动物有很多爪子,而且向周围横行伸出,活动时看起来横行霸道极具侵犯性的样子,像极了癌细胞。而肿瘤是人体在各种致瘤因素(往往是基因突变)的作用下形成的新生物(多表现为包块、肿块),英文名为tumor。肿瘤分为良性肿瘤和恶性肿瘤,由肿瘤细胞组成,包括实体瘤肿瘤细胞以及血液瘤肿瘤细胞。
癌症是一种危害全球人类健康的重大疾病。我国每年新发约400万癌症患者。中国男性和女性中死亡率排前5位的癌症均为:肺癌、胃癌、肝癌、食道癌、结直肠癌。每个人一辈子大概有40%的概率会患癌。随着人类寿命的进一步延长,未来人们的患癌概率还会进一步增加。
癌症是由正常细胞恶化成癌细胞造成的一种疾病。癌细胞有很多特征,比如:
1)失去了对细胞生长和分裂的正常调控,这会导致细胞异常、疯狂地增殖和扩散;
2)不会发生衰老和死亡。正常细胞在生命周期的特定阶段会自发地进入死亡程序,以保持组织结构的稳定和健康。然而,癌细胞却能够逃避死亡,这使得它们在体内无限制地生长和扩散;
3)此外还具有其他一些重要特征,包括无限增殖潜能、血管生成、侵袭和转移能力等。
这些特征共同作用,使得癌细胞能够在机体内形成恶性的、不停繁殖的、永远不会死的肿瘤,最终对机体造成严重危害。尽管在癌症治疗方面目前已经取得了一些进展,如手术切除、化疗、放疗、靶向治疗和近年来兴起的免疫治疗等,但仍然存在很多挑战和未解之谜。
癌症是如何发生的?
癌细胞是由人体内正常细胞发生癌变形成的。那么,正常细胞为什么会发生癌变?答案是基因突变!基因记录着生命的基本构造和性能,不仅决定了我们的高矮胖瘦、皮肤黑白、性格外貌等,还往往与癌症的发生有关。我们人体内有约20 000个基因,当细胞发生分裂时,基因就会发生复制,复制过程中偶尔会发生错误,我们称之为基因突变。如果突变的基因刚好是与癌症相关的基因,那么就有可能引起细胞功能紊乱,进而使该细胞变成癌细胞。
目前已知至少有500个左右与癌症相关的基因,它们可以分为两类:第一类是癌基因,这是一种促进癌细胞生长的“流氓基因”,这类基因编码一种可以促进细胞生长的蛋白,叫癌蛋白。当癌基因突变以后,编码出来的癌蛋白也突变了,突变的癌蛋白疯狂地促进癌细胞生长,导致癌症的发生。第二类是抑癌基因,这是一种抑制癌细胞生长的“警察基因”,这类基因编码一种可以阻止细胞生长的蛋白,叫抑癌蛋白。当抑癌基因突变以后,编码出来的抑癌蛋白也突变了,突变的抑癌蛋白会失去抗肿瘤功能,不能阻止癌细胞的生长,也可以导致癌症的发生。
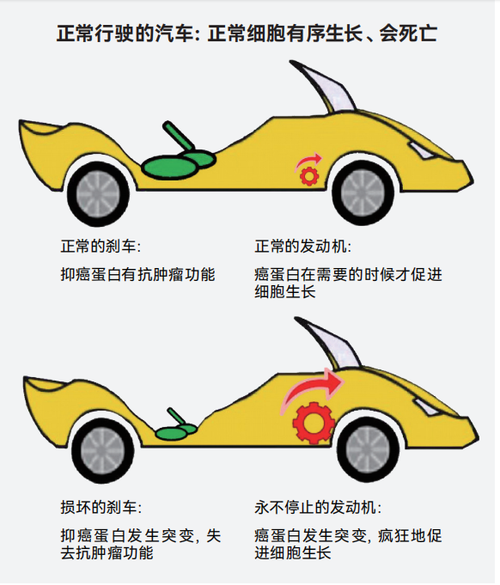
我们把细胞比喻成一辆汽车,这辆汽车需要有行驶功能(个体发育时需要细胞生长、分裂),同时也需要具有刹车功能(细胞发生损伤时,需要停止生长、分裂,甚至是自杀性细胞死亡)。正常细胞就像正常行驶的汽车,依靠正常工作的发动机(癌蛋白)以及正常工作的刹车(抑癌蛋白)控制汽车的正常启动和正常停止。而永生不死的癌细胞就像是一辆疯狂行驶、不受控制的汽车。其发动机始终处于最大功率的启动状态(癌蛋白发生突变导致其促进细胞疯狂生长),刹车则处于损坏状态(抑癌蛋白发生突变导致其失去阻止癌细胞生长的能力),因此无论什么时候,这辆汽车都处于超速行驶、失控的状态。
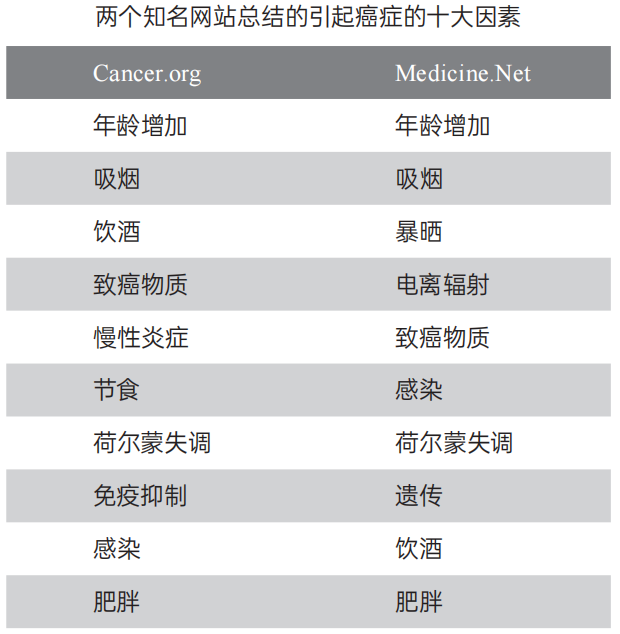
因此,可以想象,任何导致癌基因或抑癌基因发生突变的因素都将是导致癌症发生的风险因素。上表是引起癌症发生的十大因素,其中第一大因素是“年龄增加”,因为随着年龄的增大,细胞不断地发生分裂,基因在细胞分裂时会随机地、不可避免地发生突变,如果突变刚好发生于癌基因或抑癌基因,癌症就可能发生。卫生状况差、战乱频发国家的居民为什么不容易发生癌症?因为他们人均寿命短。空气质量良好、卫生条件好、医疗水平高的北欧、澳大利亚等发达国家居民为什么容易发生癌症?因为他们人均寿命长。因此,癌症本质上是一种老年病,甚至可以说:只要活得够久,一定会得癌症。
癌细胞就像一辆发动机从不停歇、刹车坏掉的汽车
除了“年龄增加”这个不可避免的风险因素外,烟草使用是最重大的致癌风险因素。一个不吸烟的人有大概0.5%的概率死于肺癌,但一个吸烟的人死于肺癌的概率可以提高至约10%。虽然年龄增加过程中发生的基因突变是不可避免的,但是吸烟、饮酒等引起的基因突变是可以避免的。如果不吸烟、不喝酒、采取健康饮食、保持锻炼,就能够预防1/4以上的癌症。
癌症会遗传吗?
癌细胞在人与人之间不会传染,癌细胞也不会由上一代传递给下一代。绝大多数癌症都是因为个体在成长过程中发生基因突变而诱发的。因为这些基因突变并不是遗传自上一代,因此这些癌症(肿瘤)叫非遗传性癌症(肿瘤)。
尽管癌症不会遗传,但“易患癌体质”是可以遗传的,其根本原因是下一代遗传了上一代体内突变的癌基因或者抑癌基因,这类癌症(肿瘤)叫遗传性癌症(肿瘤)。这类人群从受精卵开始就遗传了父亲或母亲的基因突变,出生时(天生)就携带可以诱发肿瘤的基因突变。比如有一类癌症患者,60岁前注定有80%的概率会罹患癌症,这是由于他们的抑癌基因TP53发生先天性突变,而这个TP53突变遗传自父亲或母亲。好莱坞明星安吉丽娜·朱莉(Angelina Jolie)就因为遗传了先天性突变的BRAC抑癌基因,具有“易患癌体质”,因此在年轻时就主动选择切除了易发生肿瘤的乳腺和卵巢。先天性基因突变导致的遗传性肿瘤大约占到全部肿瘤病例的5%~10%。已报道的遗传性肿瘤包括遗传性乳腺癌、卵巢癌、胃癌、直肠癌、白血病等至少10余种肿瘤类型。
一种比较有名的遗传性肿瘤是李法美尼综合征(Li-Fraumeni syndrome,下文简称LFS),是由TP53基因(编码p53蛋白)突变引起的。LFS是一种较为罕见的显性遗传病,以首先发现此疾病的两位医生的名字命名。这一类遗传性肿瘤的主要特征是发病年龄非常低。LFS人群通常在青年时期就出现多种恶性肿瘤,最常见的癌症类型包括乳腺癌、骨肉瘤、软组织肉瘤、急性白血病、脑癌和肾上腺皮质肿瘤,另外他们罹患黑色素瘤、肾母细胞瘤、胃癌、结肠癌、胰腺癌、食道癌、肺癌和性腺生殖细胞癌的风险也会增加。据统计,50%的LFS患者会在30岁前罹患某种癌症,在60岁前患癌的可能性增至80%~90%。目前,针对我国LFS家族的研究报道较少。在被认为是我国第一例LFS家族的报道中,有6名家庭成员罹患各种肿瘤。凤凰网曾经以“全球首例患5种癌症者公开求助!她19年来为何不断患新癌?”为题,报道了我国一例典型的LFS患者的情况。
由于政府、科学家、医生、家庭成员等对遗传性肿瘤征候群LFS缺乏了解,LFS的信息登记和科普网站也极少,因此,LFS在我国具有极大的、未被满足的被关注需求。LFS人群先天就具有极高的患癌可能性,而且在青少年时期就会罕见地同时发生不同类型的癌症。以45岁人群为例,LFS人群发生癌症的概率是正常人的30.7倍;死于癌症的概率是正常人的521.1倍。一生中,LFS男性的患癌概率为70%~80%,女性则为90%~100%。我国预计有10万~20万的LFS人群,但因为缺乏基因组测序信息,患者本人在肿瘤发生并进行基因测序前都不知道自己是LFS人群,因此难以成功预防LFS肿瘤发生或防止LFS后代的出生。
关于LFS,我们普通人能做什么?首先是密切关注自己的肿瘤家族史,如果亲属(尤其一级亲属)45岁前得了肉瘤等最开始提到的LFS常见肿瘤类型,或者有两位或以上亲属在低龄时就诊断出肿瘤(肿瘤是老年病,青年人极少发生除白血病和脑瘤以外的肿瘤,因此有两位或以上家族成员在低龄时发生肿瘤的概率极低,如若发生,最可能的情况是该家族具有先天性基因突变,如TP53突变),那么可以怀疑自己可能是p53先天性突变的LFS人群。如果怀疑自己是LFS人群,可自行拔下2~3根携带毛囊(指发根部位的一小块肉眼可见的白色头皮)的头发,或者去医院抽取血液,然后寄送头发或血液去基因测序公司进行TP53基因测序。如果确诊是LFS人群,那么需更加关注癌症预防和治疗的科学信息,进行更低龄更频繁的定期体检(特别是LFS高发的女性乳腺癌、骨肉瘤、淋巴瘤、白血病等)、必要的产前体检(因为确诊者下一代有50%的概率也是LFS患者,因此为了下一代健康建议生育前做早筛,避免LFS婴儿出生)。对确诊的LFS患者,建议每年进行全身磁共振(WBMRI)体检,避免放射性检测,同时也要养成健康生活习惯:不吸烟、不喝酒、多摄入水果和蔬菜、减少不必要的放射暴露、定期锻炼、避免肥胖、减少日晒。
神奇的药丸——靶向抗癌药物
靶向药物一般是指针对基因突变而研发出来的治疗药物,因其具有精准性、高有效性、低毒副作用而被称为“神奇的药丸”。靶向抗癌药物的作用机制往往是通过干扰癌细胞内突变蛋白的功能(突变的蛋白由突变的基因编码产生),从而抑制癌细胞的增殖和扩散。由于正常细胞没有这些突变的蛋白,因此,靶向抗癌药物对正常细胞的伤害很小。此外,有些癌症患者可能发生蛋白A的突变,但别的患者却没有发生蛋白A的突变,而是发生蛋白B的突变,因此后者只能使用针对突变蛋白B的靶向药物,不能使用针对突变蛋白A的靶向药物。靶向治疗精准针对某个病人中的某一个基因突变,由于其具有很强的针对性和特异性,因此被称为精准治疗、个体化治疗。比如针对癌基因EGFR突变,科学家研发出EGFR靶向药物;针对癌基因BRAF突变,科学家研发出BRAF靶向药物;针对抑癌基因TP53突变,科学家还在努力研发p53靶向药物。
靶向抗癌药物的设计理念源于对癌症发病机制的深入研究。在癌症的发展过程中,常常伴随着一系列基因突变,部分基因突变可能导致细胞信号传导通路的异常活化,进而促进肿瘤的生长、扩散、永生。靶向抗癌药物的作用机制往往是干预这些异常信号通路中的关键蛋白,使得癌细胞无法正常生长和分裂。一个典型的例子是针对EGFR突变肺腺癌的靶向治疗。EGFR是一种癌基因,它编码的癌蛋白EGFR在正常情况下参与调控细胞正常生长和分化,但在某些肺腺癌患者中,EGFR基因发生突变导致EGFR蛋白发生突变,进而导致这个蛋白始终处于活化状态,最终使得癌细胞疯狂、无限地增殖。针对这种情况,科学家们开发了一类名为EGFR抑制剂的靶向药物,它们能识别并结合突变的EGFR蛋白,阻止其促进癌细胞的增殖,从而抑制肿瘤的生长和扩散,提高患者的生存率。除了EGFR抑制剂外,还有许多其他种类的靶向抗癌药物,如FLT3抑制剂、BRAF抑制剂等。
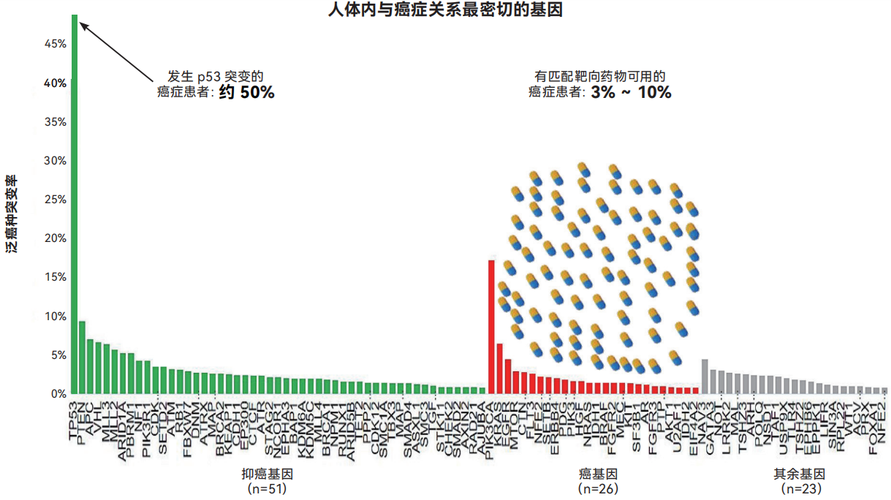
图中横坐标代表与癌症最相关的100个基因,亦即在癌症中突变频率最高的100个基因,他们发生突变以后可能引起癌症。其中有77个是已经明确的癌基因或抑癌基因。纵坐标代表该基因在癌症患者中发生突变的概率。药物图标表示已经获批临床使用的靶向药物。其中TP53是人类癌症中突变频率最高的基因,编码抑癌蛋白p53,它在全球约一半癌症患者中发生突变
不是所有癌症患者都可以使用靶向药物。发生什么基因突变,就需要精准使用针对该基因突变的靶向药物。比如只有发生EGFR突变的患者使用EGFR靶向药物,才有可能有疗效。EGFR基因没有突变的患者,则不应该使用EGFR靶向药物。因此,使用靶向药物需要对患者的肿瘤细胞进行基因测序,确定患者是否含有靶向药物所针对的基因突变。
神奇的药丸有哪些?终极的靶向抗癌药物是什么?
目前抗肿瘤的靶向药物有80多个,但这些靶向药物全都是针对突变的癌基因研制出来的,全球还无法研制出针对突变的抑癌基因的靶向药物。也就是说,临床获批的所有80多个靶向药物都通过“破坏汽车发动机”,即靶向癌蛋白,阻止癌蛋白发挥促细胞增殖功能来治疗癌症,因此这些靶向药物往往被称为“抑制剂”;但还没有任何一个药物可以通过“修复刹车”来治疗癌症,亦即现有靶向药物没有一个能够靶向抑癌蛋白,科学家还做不到恢复抑癌蛋白的抗肿瘤功能(如果能获得抑癌蛋白的靶向药物,这类靶向药物应该叫做“恢复剂”,而不应该叫做“抑制剂”)。总之,目前科学家只能做到“祛邪”,已经获得了80多个抑制剂;但还做不到“扶正”,迄今研发不出恢复剂。遗憾的是,癌症病例有一半以上与抑癌蛋白突变有关,只有少部分与癌蛋白突变有关,这意味着临床上对恢复剂的需求远超抑制剂。目前还没有任何恢复剂的情况造成了临床上只有约3%~10%的癌症患者有靶向药物可用的窘境。
p53是最知名的抑癌蛋白,它是癌症中突变频率最高的蛋白,在约50%癌症患者体内发生突变。如此高的突变发生率,意味着p53靶向药物(亦即p53恢复剂)具有极广的使用范围。如果出现p53恢复剂,光这个药物的适用患者群体(约50%全球癌症患者)就超过目前临床上所有80多个靶向抗癌药物适用患者群体的总和(3%~10%全球癌症患者)。因此,p53恢复剂被至少15篇顶级科学文献称为“靶向抗癌药物的圣杯”“终极的靶向抗癌药物”。不出所料,p53是科学界被研究最多的基因,也是历史上被引用最多的基因。
然而研发p53恢复剂具有巨大的难度,获得该圣杯需从0到1突破两项科学难题。第一,p53是抑癌蛋白,发生突变后失去抑癌功能,因此靶向p53需要恢复(而非抑制)其蛋白功能,但学术界和工业界尚无成功靶向抑癌蛋白的先例:癌症中最高频突变的100个基因中,有51个编码抑癌蛋白,然而临床上的靶向药物几乎都靶向癌蛋白,而无一靶向抑癌蛋白。靶向抑癌蛋白不仅缺乏成功先例,而且缺乏明确的逻辑支持:化合物(即小分子药物)结合到蛋白上,有可能导致蛋白功能受到抑制(如果化合物占据蛋白活性位点的话),但如何诱导蛋白功能恢复?其逻辑是什么?第二,p53蛋白表面光滑,化合物难以结合。癌症超级重磅靶点p53、PTEN、Bcl-2、KRAS、myc等很大程度上都是因为缺乏合适的化合物结合口袋而在成药道路上困难重重。化合物结合口袋指在生物分子(如蛋白质)中,能够与配体(如小分子)结合的区域,这个区域从蛋白质的表面上看,像张开的口袋。总之,这两项底层的科学挑战使科学家和药企难以获得该圣杯:截至2018年,国际上至少有70个团队报道获得了可以恢复p53功能的药物(以下简称p53恢复剂),但遗憾的是,和“室温超导”闹剧一样,没有人能检测到这些药物恢复p53抑癌功能的效果,唯一的例外是瑞金医院上海血液学研究所的科学家卢敏在2020年12月25日报道获得的p53恢复剂。
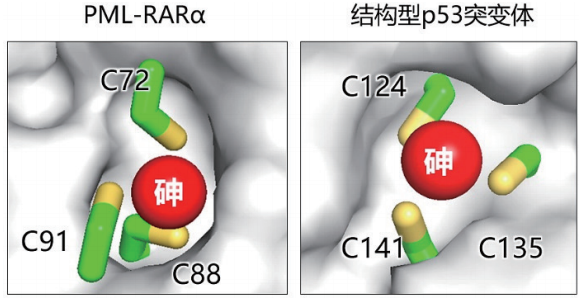
2020年12月25日,卢敏团队在《癌细胞》(Cancer Cell)杂志上发表论文,介绍了首次获得的有效p53恢复剂。该研究发现了p53恢复剂三氧化二砷(ATO)就是几十年来科学家一直在追求的靶向药物的圣杯。ATO靶向p53的机制和靶向急性早幼粒细胞白血病中PML-RARa蛋白(由PML基因和RARa基因融合后形成的癌蛋白)一样,都是同时结合三个空间结构上靠近的半胱氨酸的巯基。值得一提的是,中国医生和科学家使用ATO靶向PML-RARa,在与全反式维甲酸(ATRA)联用时治愈了急性早幼粒细胞白血病,使这类患者在停药后的五年生存率超过90%,因此这种白血病成为迄今为止唯一被靶向药物治愈的恶性肿瘤,这也是除了青蒿素治疗疟疾以外我国对世界科学史的另一贡献。然而,ATO又叫砒霜,具有显著的体内毒副作用,因此用于治疗p53突变的癌症患者时其临床获益是否大于毒副作用有待研究。此外,癌症中有上千种不同的p53突变体,这些突变体失去抑癌功能的机制各不相同,上千种p53突变体中,哪些p53突变体可以被ATO恢复功能进而用于临床治疗也有待研究。
ATO释放砷原子,结合PML-RARα和p53内的“三半胱氨酸口袋”
2023年4月5日,卢敏团队进一步在《科学转化医学》(Science Translational Medicine)杂志上发表论文,对ATO靶向p53做了系统性研究:1)测定了ATO对800个癌症中最常见的p53突变体的功能恢复效率,鉴定并公开了390个可以被ATO恢复功能进而用于临床治疗的p53突变体(可通过网站www.rescuep53.net查询,标注rescuable的是可以被ATO恢复功能的突变体);2)据此提出基于每一个p53突变体的被恢复效率来决定是否适用靶向治疗的精准治疗理论,最后利用该理论策略,首次在人体内实现p53突变体功能恢复,并减轻该白血病患者的肿瘤负担。过去七年来,该团队还建立了p53突变体的LFS小鼠(高频突变p53-R282W)模型,发现在饮用水里面加入ATO可以显著延长LFS小鼠的生存,但这些数据还未投稿和公开发表。需明确提出的是,这些实验室水平的细胞研究、小鼠研究都还远不能证明ATO靶向p53的临床疗效,请大家不要使用或轻易使用没有严格临床证据的药物。将来即使ATO在临床上被证明有效,也只可能对特定p53温度敏感型突变(比如V272M等)有效。
2024年2月22日,卢敏团队进一步在《癌细胞》杂志上发表论文。在这项研究中,团队共制备了超过10 000多个生物学样品,在10个实验系统中头对头比较了目前所有可获取的30余个p53恢复剂,包括14个最具代表性和影响力的p53恢复剂(其中6个恢复剂已进入临床试验),但不包括化学结构未公布且难以获取的恢复剂(如p53-Y220C单突变体恢复剂PC14586)。通过实验量化这些恢复剂对p53突变体的功能恢复效果,结果发现:1)除ATO(和其类似物PAT)以外,所有p53恢复剂在所有10个实验系统中均检测不到任何p53功能恢复效果;2)即使是ATO和PAT,也只能恢复结构型p53突变体(使p53蛋白丧失空间结构的一类突变体)的功能,而且只对温度敏感性高的结构型突变体有较好的恢复效果。
因此,我国科学家获得了有效的p53靶向药物、首次在人体内实现p53功能恢复、并被国际公认是唯一有效的p53靶向药物。p53恢复剂被英国TP53信托机构(TP53 Trust)、国际抗癌基金会(AntiCancer Fund)、肿瘤药物再利用(REDO)等国际抗癌组织推荐,领域同行基于其研究成果在美国临床试验注册网站(ClinincalTrials.gov)上启动了五项p53靶向治疗临床试验。p53恢复剂专利进入中、美、欧、日等十余个国家,中国区使用权完成高水平企业许可转化。这些科学发现使得笔者团队被广泛认为是p53靶向药物的获得者和抑癌蛋白靶向治疗领域的实质性开拓者。
尽管在癌细胞、患癌小鼠甚至一例癌症患者上的研究结果都支持ATO是有效的p53靶向药物,但这些都不足以确认ATO作为p53靶向药物的临床疗效,因为判断药物临床疗效的唯一标准是在“大规模、双盲、随机对照临床试验”中取得的结果。未来,尚需科学家和临床医生紧密合作,开展临床试验探索ATO作为p53靶向药物是否真的具有临床疗效。
————————
本文根据笔者在上海市科学技术普及志愿者协会主办的“海上科普讲坛”上的报告撰写而成