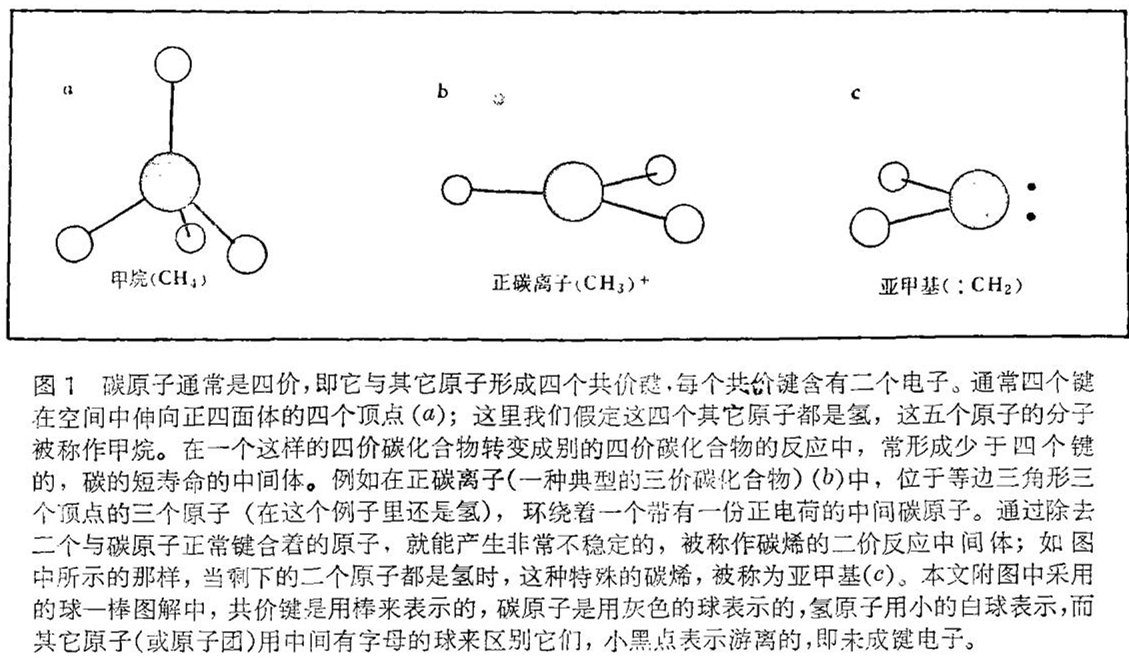
〔提要〕碳原子通常是四价,以四根共价键同四个其它原子相结合。如果从这四个原子中去掉二个就成为被称作碳烯的二价反应中间体。藉这类非常活泼的、短寿命分子之助,我们能够探讨有机化学反应的基本机理。本文原载Scientific American,Vol. 234,NO2,1976。作者是Jr. M. Jeans。
我觉得有机化学最有意思的是它直接使化学家陷入远古时代炼金术士的梦想中,即把一种物质转变成别的物质。研究者能够密切地注视实验室烧瓶中发生着的变化,并为如此巧夺天工的变化而感到无比欣慰。一个自然产生的问题是,这些变化究竟是如何发生的。更确切地说,分子是如何汇集起来而形成其它分子的?某些分子的形状是否比其它分子更适合于参加化学反应?为了促成某一变化需要多少能量?一个分子在变成别的分子时,是否有中间体分子参与?如果有的话,我们怎样能够检出和研究这种短寿命的实体?
目前有机化学的一个重要分支是从事研究上述最后一个问题的。当然,许多有机化学家仍忙于合成更为复杂的分子,但是也有一小部分有机化学家(通常叫做物理有机化学家的)则是从事反应机理的研究。更少的一些人,包括我和我的普林斯顿大学的同事们,是集中研究反应中间体性质的。这些分子仅在化学反应的中间过程中形成,但几乎瞬间就转变成新的分子了。
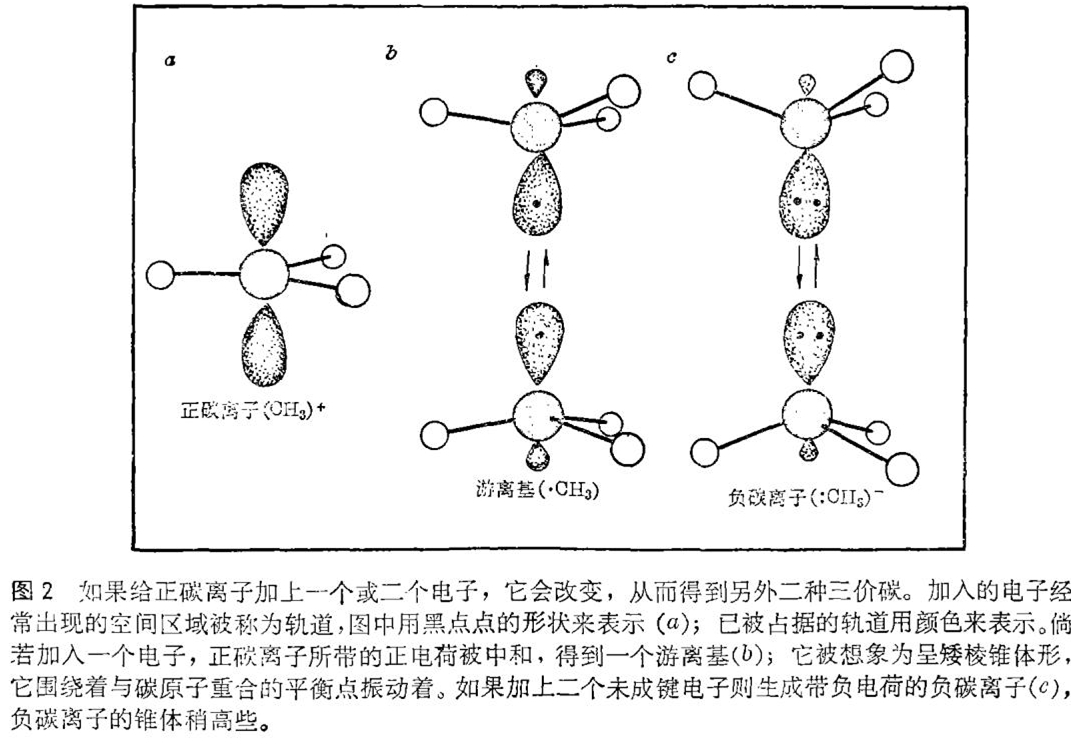
因为有机化学基本上是碳化合物的化学,所以最大的注意力放在含碳的反应中间体上是毫不奇怪的。碳原子通常是四价,也就是说它倾向于同其它原子形成四个共价键(即共用电子对)。四个共价键在空间中通常是从正四面体的中心向四个顶点伸展的。到最近为止,一个四价碳化合物转变成别的化合物时,形成的反应中间体中最常见的是三价碳。一个典型的例子是正碳离子。正碳离子中,位于等边三角形三个顶点的三只原子围绕着一个带正电荷的中心碳原子。如果设法将一个电子加在正碳离子上,正电荷就被抵消,结果形成一个中性分子,一个游离基。最简单的游离基大概呈矮棱锥体形状(见图1)。如果再加上一个电子的话,就得到带负电荷的负碳离子,通常负碳离子的锥体稍高些,而且振动也更快。虽然这些三价碳化合物的化学已经被广泛研究了四十年左右,但至今还不能够断言已经完全弄清楚了。
像这些三价分子一样有趣和有用,人们通过设法除去二个与碳键合着的原子,就能够对正常的碳原子作更大程度的改造。这样就得到了具有极大反应活性的,被称之为碳烯的二价分子。
据传说,1951年秋一天深夜在芝加哥,三位美国第一流的有机化学家威廉 · 多林(William Doering),索尔 · 温斯坦(Saul Winstein)、罗伯特 · 伍德沃德(Robert Woodward)在一辆行驶着的出租汽车里共同想出了碳烯(carbene)这一名称。当然,对他们来说,创用这一新的名字一定有其理由的。实际上,早在一百多年以前就有人第一次指出二价碳可能是一种活泼的反应中间体。五十年代初,对这些特殊化合物的二十多年集中研究的成果开始出现在化学文献中。
碳烯明显的不稳定性及伴此而来的极大反应活性引起了人们极大的兴趣。一碰到最简单的碳烯即亚甲基(略记作:CH2,这里元素符号前的二点表示碳原子的二个游离电子,即未成键电子),即使最牢固的碳的单键之一——碳氢键也会断裂。例如:亚甲基与甲烷(CH4)作用生成乙烷的反应,放出大量的热,清楚地表明反应物比生成物能量高得多,因而远没有生成物那样稳定。然而即使有大的能量差距存在,也不能轻率地说一个既定的反应是能发生的或容易发生的。因为在能量高的反应物同能量比它低的生成物之间,可能有某些基于能量或熵的关系而产生的重大障碍阻隔着。尽管如此,想象反应物处于比生成物高得多的能量悬崖上,这样一种形象有助于人们理解碳烯的显著的反应活性。
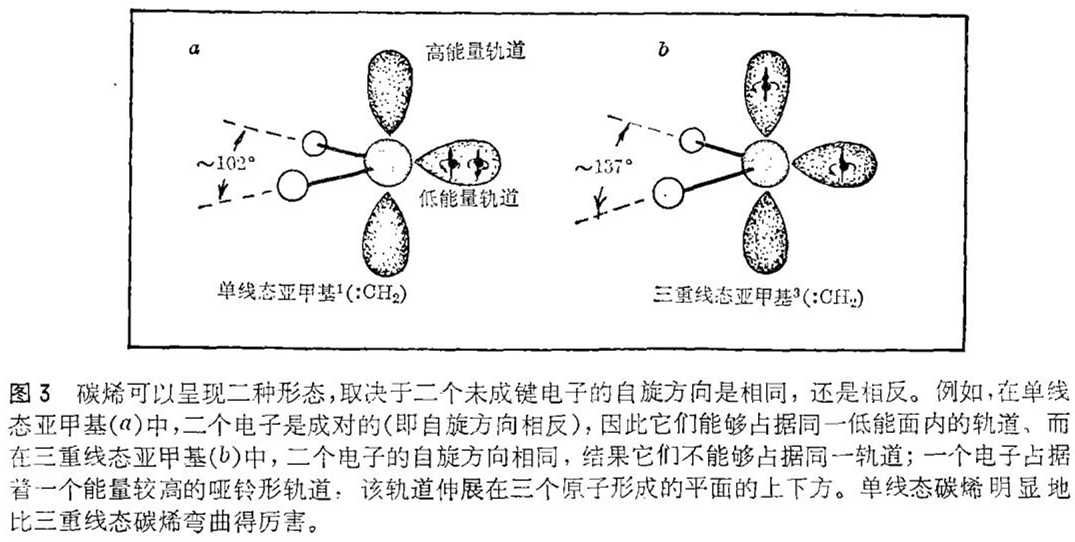
在详细研究亚甲基及其它碳烯与各种烃类的反应之前,必须考虑到一个复杂的因素。对环绕一个碳原子的电子的量子力学描述,一部分要涉及到它们的自旋量子数。电子的自旋量子数可取值+?或-?,取决于(笼统地说)自旋方向是顺时针还是反时针。因此碳烯的二个未成键电子的净自旋量子数是0(自旋符号不同)或1(自旋符号相同)。鉴于光谱学上的一些原因(与本文主题完全无关),这二种自旋状态分别被称为单线态和三重线态。对于任何既定的碳烯,人们都能够预想出二种略有不同的结构。于是就产生了一个重要的问题;一个单线态碳烯的化学反应同对应的三重线态碳烯的反应之间是否有足以检出的差别存在呢?
由于亚甲基是一种很小的分子,因此能够用被化学家允许的仍较粗糙的理论方法来加以处理。由于理论家们的努力,我们已经获悉了许多有关单线态与三重线态亚甲基的几何学知识。这二种分子都是弯曲的,单线态分子比三重线态分子弯曲得更厉害,但二者的未成键电子在空间所占的位置截然不同。这个空间位置称为轨道。一般来说电子总是尽量占据能量最低的轨道。紧要的是二个自旋量子数相同的电子不允许占据同一轨道。因此在三重线态亚甲基中,二个未成键电子是处于不同轨道上的:一个电子是在能量比较低的轨道上,该轨道位于三个原子形成的平面上,而另一个电子则占据一个能量稍高的哑铃形轨道,该轨道延伸在三个原子形成的平面的上下方(见图3)。在单线态中,由于二个电子自旋方向相反,这就不妨碍它们占据同一轨道,因此这二个电子同处于一个低能轨道,该轨道在三原子形成的平面内。
当结合在二价碳原子上的原子(或原子基团)比亚甲基中的氢原子更为复杂时,碳烯的结构可能有所改变,但仍保持着这样一种总的特征,即单线态分子弯曲得比较厉害而三线态分子更近于直线状。二种自旋状态能量差的精确数值近几年来已经成为大量研究工作的课题和某些争论的焦点。现在看来已清楚的是,除少数例外情况外,三重线态比单线态能量稍低些。这样,有关碳烯化学的重要问题之一就归结为是否从单线态转变为三重线态这样一个微妙的变化——仅仅涉及到一个未成键电子自旋方向的变化——就会导致二种不同的化学反应机理。
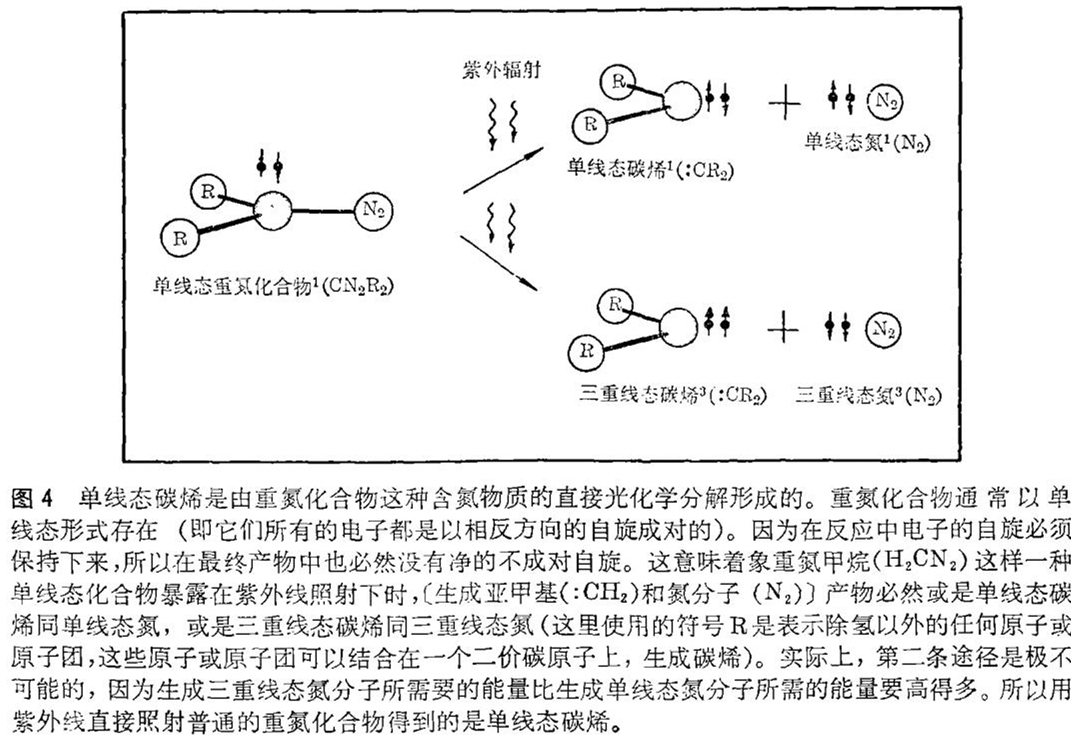
现在让我们来看看实验室里是怎样制备碳烯的。虽然要生成二价碳的化合物有各种方法,但我们在这里只采用最简单的,也许是最危险的方法。该方法是用加热或紫外线辐射来使那些被称之为重氮化合物的、颜色鲜艳的含氮化合物分解。这些有毒的、致癌的、容易爆炸的重氮化合物释放出氮分子而形成碳烯,生成的碳烯总是要设法回到通常的四价状态。
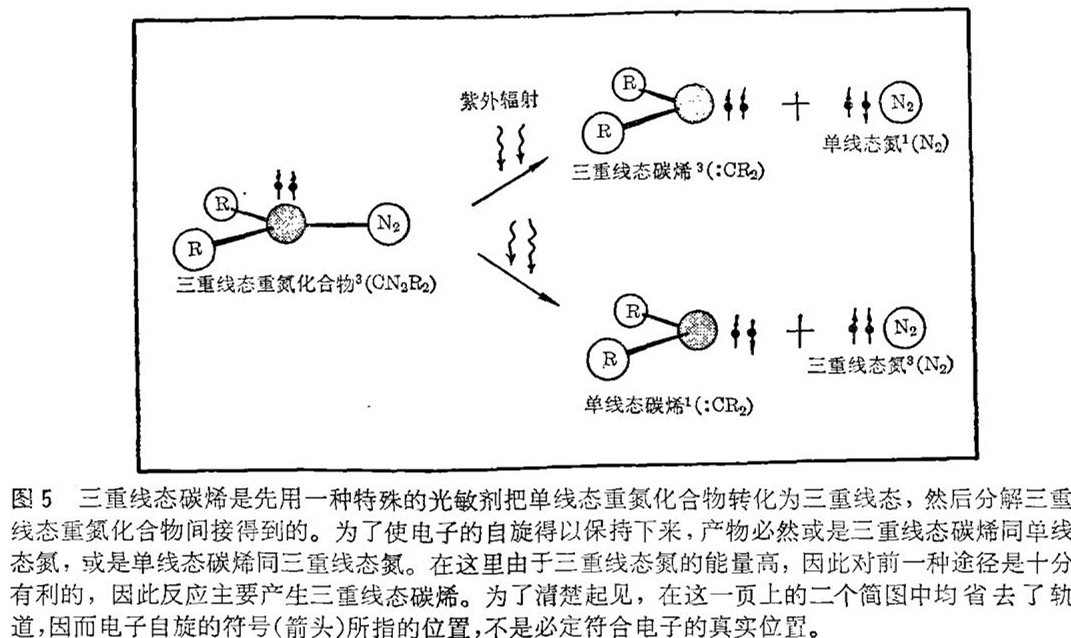
重氮化合物的光化学分解是产生碳烯的特别有用的方法,因为它既能产生单线态碳烯又能产生三重线态碳烯。例如,像重氮甲烷那样的重氮化合物直接分解的话,就产生一个氮分子和一个亚甲基分子(:CH2),二者都处于单线态。在这类反应中,电子的自旋(方向)是保持不变的。因此如果从单线态重氮化合物出发(在单线态重氮化合物中,所有的电子都形成以相反方向自旋的电子对),结果必然在最后的生成物中,也没有净的不成对的电子自旋。这种约束意味着,产物必定或是二个单线态分子,或是二个三重线态分子(见图4)。因为形成三重线态氮分子所需的能量比形成单线态氮分子所需的能量要高得多,所以实际上生成二个三重线态分子的反应途径是不可能的。
但是如果不是直接照射重氮化合物,而是首先用一光敏剂将所有入射的辐射能全部吸收,就能够制得三重线态的重氮化合物。进一步反应也存在着二种可能性:或者是一个三重线态碳烯同一个单线态氮分子一起形成,或者是一个单线态碳烯同一个三重线态氮分子一起形成(图5)。由于三重线态氮是能量高的,所以前者的可能性远远超过后者。
简而言之,虽然必须采用非常危险的化合物,但重氮化合物容易制备而且适用范围也更广,所以它们作为制备单线态及三重线态碳烯的出发物质是最恰当不过的。(更何况还有一种间接的方法能够避开危险,即通常可以使用重氮化合物的盐类来代替重氮化合物,此时重氮化合物仅在反应容器内产生,由于它立刻就被消耗掉,因此不必分离出来。)
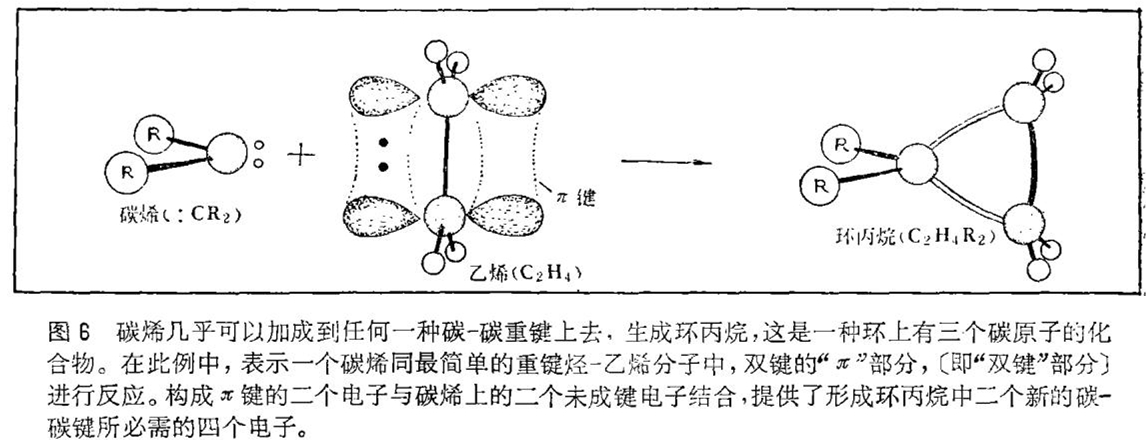
碳烯对于电子的胃口很大。因为要补足它们的正常化合价(即正常成键)还缺少二个电子,所以它们甚至能与非常微弱的电子供给源迅速发生反应,形成四价碳化合物。在此四价碳化合物中每个碳原子分享八个价电子(四个是它自己的,其余四个是由与它成键的原子提供的)。在实验室里,供给碳烯的最普通的电子供给源是碳 - 碳双键的π,即“双键”部分。这一反应的产物是一种环丙烷:三个碳原子形成一个环的一种化合物(见图6)。这一小环化合物由于键角高度变形,所以能量相当高,用常规方法是难以合成的。在某种意义上碳烯作为制备一类难以合成的分子所需的能源是很有用的。今天,如果一位有机化学家要合成一种环丙烷,几乎可以肯定,他的思路首先是想到碳烯。
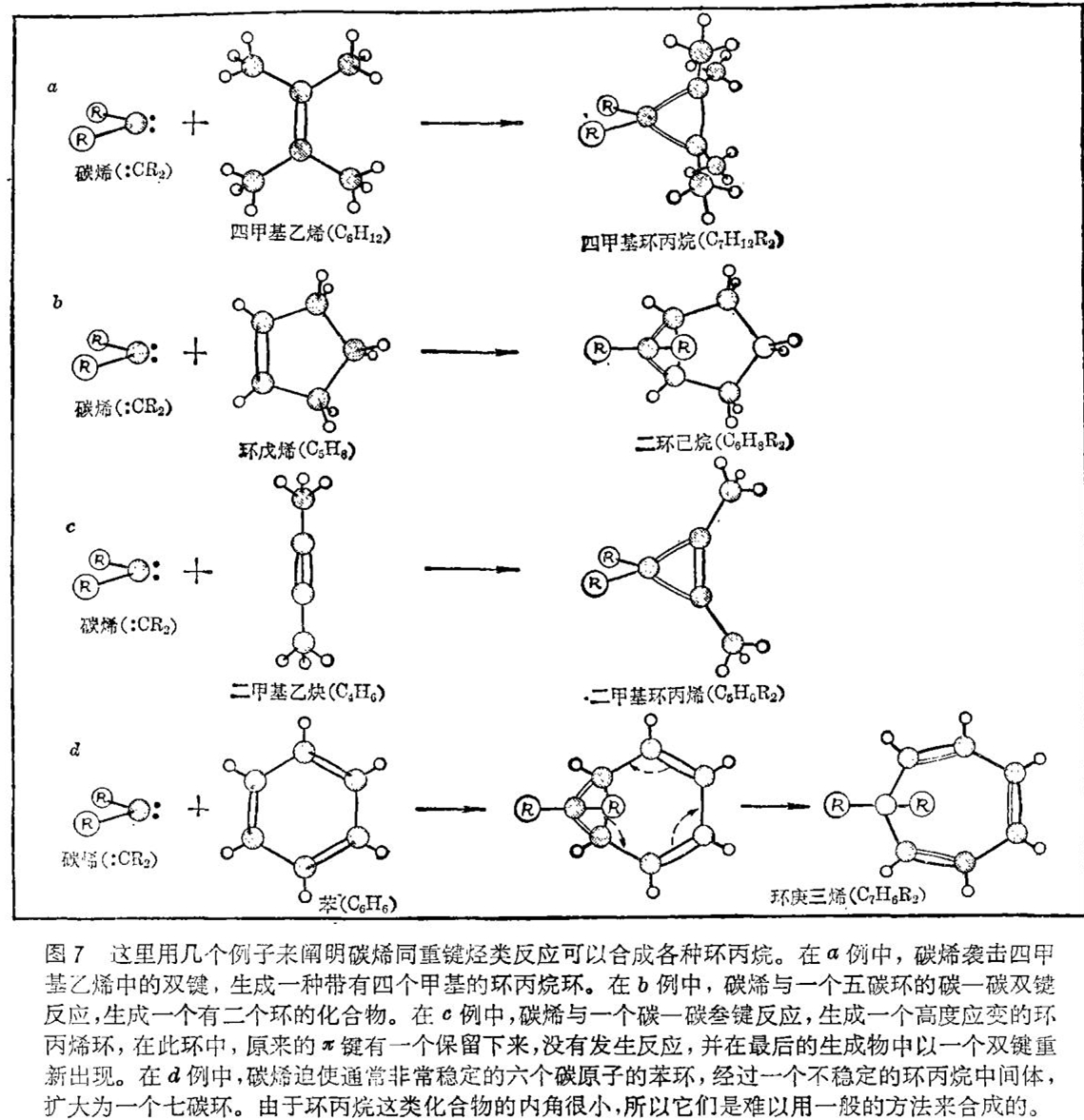
几乎任何一种碳 - 碳重键都会与二价碳反应。例如,像乙烯(C2H4)或四甲基乙烯(C6H12)之类的简单烯烃,与碳烯相遇就会反应生成三个碳原子的环丙烷环;碳烯同环烃的碳 - 碳双键反应就生成具有二个环的化合物;碳烯同碳 - 碳三键相遇,就反应生成具有高度应变及双键的环丙烯环;而六个碳原子的苯环与碳烯相遇的话,则经过一个环丙烷中间体扩大为一个有七个碳原子的环(见图7)。
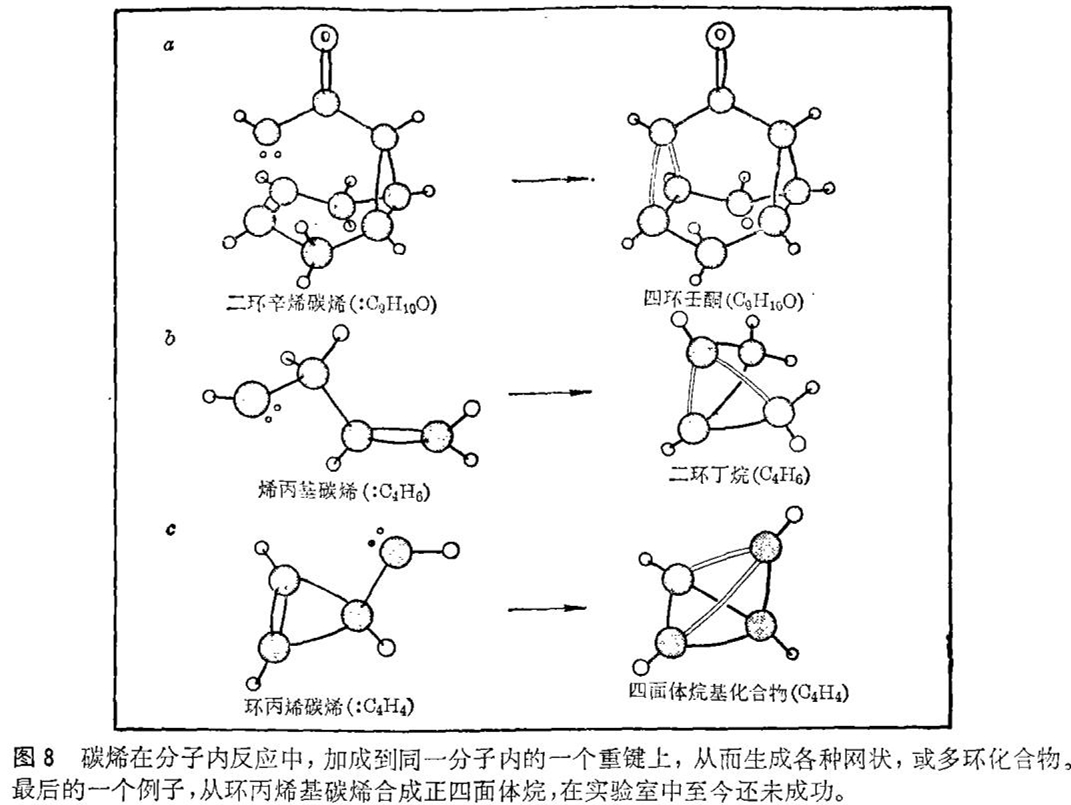
这类有碳烯参与的分子间反应为合成各种各样的化合物提供了一条捷径。尽管如此,最近大量的注意力集中在环丙烷环形成的分子内反应上。为了实施这样一个反应,人们必须设法使碳烯和接受碳烯的重键处在同一个分子内,并使它们适度地相互接近(见图8)。这种分子内加成反应能够导致生成高度应变的,带有很多环的网状化合物。如果碳烯和它的目标双键之间仅被一个碳原子隔开的话,那么这个产物就是二环丁烷(C4H4),其分子由二个连在一起的三碳环组成。当接受碳烯的重键本身是环烃的一部分时,那么就能够制备出更为奇特的环状化合物。
环丙烯基碳烯(:C4H4)的分子内反应大概可以说是环丙烷环形成反应的顶峰。如果让此碳烯进行分子内加成反应的话,那么生成物将是假设的正四面体分子——正四面体烷烃(C4H4)。虽然该反应已被反复试验过许多次,但迄今仍未分离出正四面体烷烃。这一令人费解的失败的确切原因尚不清楚,但是初步研究的结果认为正四面体烷烃可能是瞬间形成的,但在它能够被检出之前就进一步反应掉了。
有关环丙烷形成过程的实验数据虽然很丰富,但有关反应机理的资料却意外地少。例如:在空间中原子是如何相互接近的?在反应过程中,它们是如何扭转的?又是怎样回到原来状态的?有关这些问题的线索寥寥无几。最初热衷于反应机理研究的是实验家们,但他们的发现近年来已被理论家们大大地充实了,这些理论家们提供了反应的详细经过的报道。
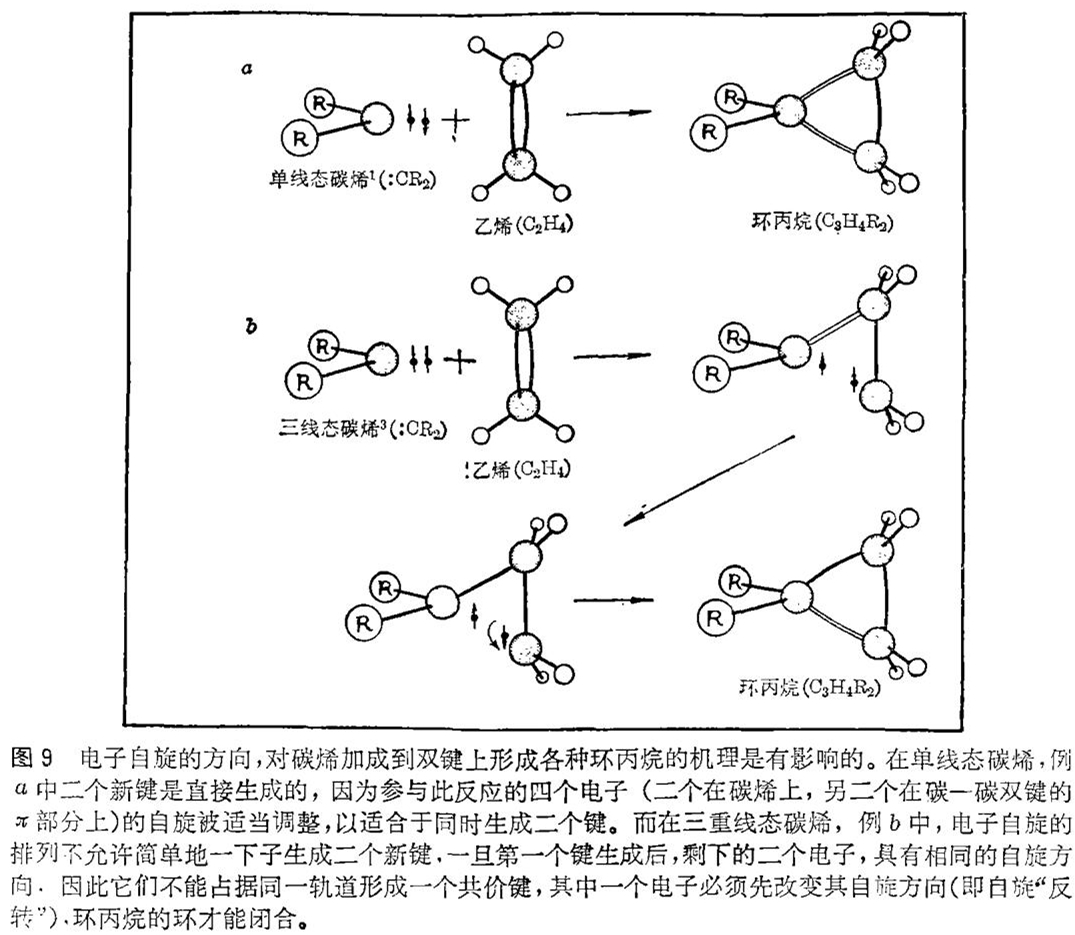
首先应该研究的问题是在环丙烷的形成反应中生成的二个新的碳 - 碳键是同时形成的呢?还是一个一个地形成的?宾夕法尼亚州州立大学的菲利普 · 斯克尔(Philip Skell)和耶鲁大学的多林(Doering)很早就认识到对此问题的答案,单线态碳烯和三重线态碳烯可能是不相同的。例如,就单线态碳烯来说;参与反应的电子的自旋(二个电子在碳烯上,二个在碳 - 碳双键的部分)被适当地调整,以便形成二个键,其中每个键必须含有二个自旋成对的电子(见图9)。然而对于一个三重线态碳烯来说,情况却不是这样,一步形成二个新键的直接反应是不可能的,因为电子自旋的排列不允许这样。首先必须形成一种具有净的不成对电子自旋的中间产物。假如这一中间体的一个电子的自旋能够改变一下的话,它就能转变为环丙烷。虽然这种自旋反转所需要的时间还没有确切地搞清楚,但这种自旋反转的机理在自然界里是存在的。所假定的中间体分子的寿命也是重要的。如果这样一种中间体生成的话,那么环丙烷是必然的产物。
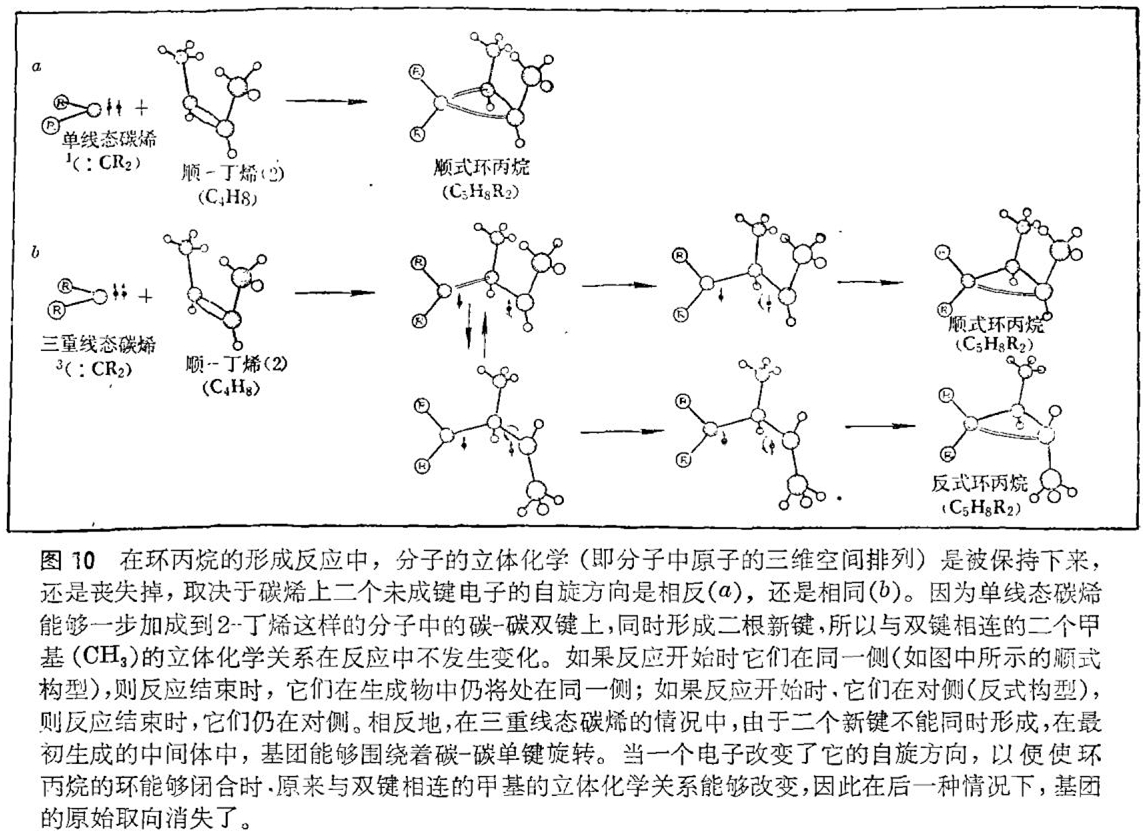
—个简单的实验可以用来区别二种过程:一种是有中间体参与的过程,另一种是没有中间体参与的。该实验所依据的前提是:在中间体分子中,与2-丁烯分子二种可能构型之一中原来的双键结合着的二个甲基(CH3),由于绕碳 - 碳单键迅速旋转,其立体化学,即三维空间排列可能丧失。在单线态反应的情况下,由于二个新的单键是同时生成的,因此不允许任何这样的旋转,原始的立体化学关系被保持着。因此得到两种略有不同的机理:一种是二个新的化学键直接形成的单线态反应过程,另一种是经过一中间体的三重线态反应过程,此中间体可能失去了存在于原分子中的立体化学关系(见图10)。换言之,即可以预期单线态碳烯加成到双键上去并保持着立体化学关系,而三重线态碳烯加成到双键上去则产生立体化学上不同的环丙烷的混合物。事实上,在后一种情况中,倘若中间体的寿命足够长的话,二种类型的环丙烷的最终比率是与反应物的立体化学无关的。
在斯克尔和多林提出他们的概念时,立体特异的碳烯反应(即保持立体化学关系的反应)已经是司空见惯的了,但此后不久少数非立体特异反应也被发现了。仅根据立体化学来决定自旋状态已成为常规的事了。而实际上如果不知道每种碳烯二种自旋状态的反应,那么把碳烯区别为单线态碳烯和三重线态碳烯是没有意义的。观察到的性质差别也许只不过是碳烯固有的性质差别引起的,而同电子的自旋全然无关。奇怪的是,直到进行关键性的实验时为止、许多年过去了,但最终的结果是确证了斯克尔和多林的推测。当研究同一碳烯的单线态和三重线态的加成反应的立体化学时,结果表明单线态碳烯是立体特异性加成的,而三重线态碳烯是非立体特异性加成的。
自此以后,理论家们已提供了有关这一反应的更为详细的说明。由于现代理论计算方法的进步,使我们能够研究单线态及三重线态亚甲基加成到乙烯(最简单的烯烃)上去时的电势——能量曲线。计算结果证实了相当贫乏的实验数据,特别是关于三重线态的加成反应。新近才弄清楚的是,在单线态加成反应中,新键也是一个一个形成的。这样,单线态加成反应同三重线态加成反应就不像初看时那样完全不同了。
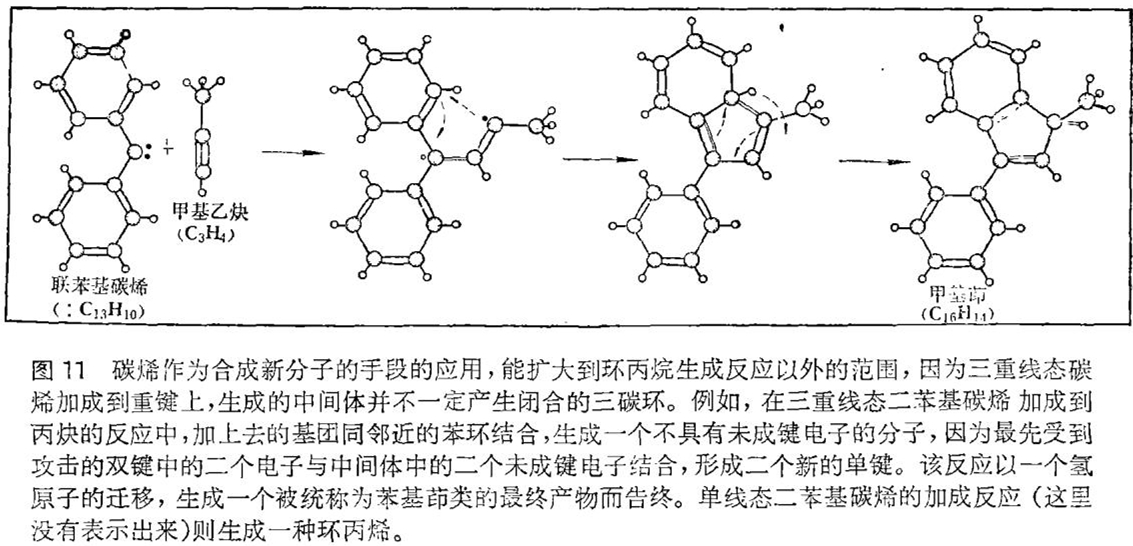
在普林斯顿我们尝试研究利用三重线态碳烯的逐步加成,以期使碳烯的应用范围扩大到除环丙烷合成反应以外的其它方面去。为此我们试图建立起能在分子内捕捉住最初形成的中间体分子的体系。一个典型的例子是三重线态联二苯基碳烯(:C13H10)加成到丙炔(C3H4)上去(见图11)。若是一个单线态碳烯,那么在这反应中仅仅形成一种环丙烯,但这里,三重线态碳烯的加成反应首先发生在三键不太拥挤的一端,产生一个中间体分子。这个中间体并不形成高度应变的、不稳定的环丙烯,而是在分子内部加成到其中的一个苯环上。该反应以一个氢原子易位、重新形成一个非常稳定的苯环体系而告终。在反应的某个阶段,有一个电子的自旋必须反转,但人们无法确切地知道反转是发生在哪一瞬间。我们所做的工作是不让反应向形成三碳环的方向进行,从而研究出一条新的途径来合成一类被统称为苯基茚类的物质。
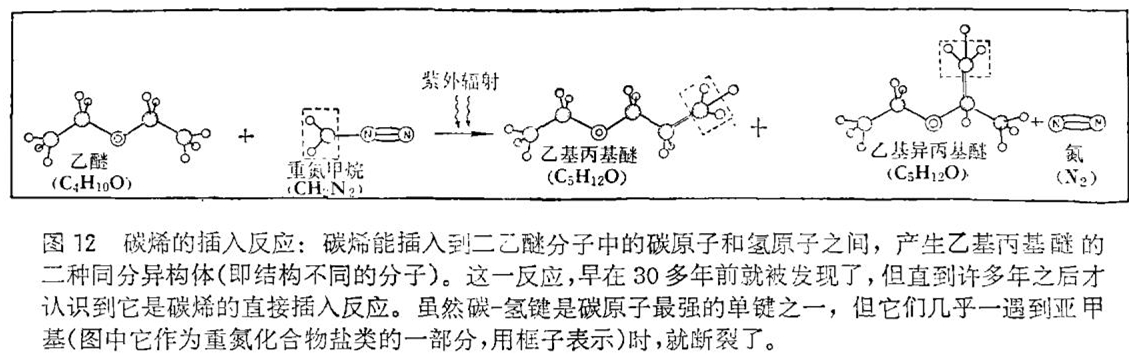
如果在加成反应不可能发生的情况下,使碳烯产生的话,那会怎么样呢?由于双键或叁键中的π电子结合得是不牢固的,所以重键体系是很容易受到攻击的。但是,碳烯的反应活性是如此之大,以至于牢固结合的碳氢键的电子也会受到攻击。事实上,我们所知的最早的碳烯反应之一是由玛伯格大学的汉司 · 米尔温(Hans Meerwein)于1942年进行的观察中得到的,即用光照射重氮甲烷(CH2N2)的二乙醚(C4H10O)溶液能得到乙基丙醚和乙基异丙醚(二种同分异构体,即有相同的化学式C5H12O,而结构不同的分子)。虽然其后过了好多年才弄清楚,这二神生成物是由于一个亚甲基单位插入到一个特定的碳 - 氢键的碳原子和氢原子之间而生成的(见图12)。后来当我们观察到各种碳烯插入到一切种类的碳 - 氢键中时,才知道这种被称为插入反应的过程是相当普通的。
在插入反应中,恰如在加成反应中一样,电子自旋的方向对于决定反应的途径是十分重要的。此时又只需对电子自旋作简单计算就足以表明单线态碳烯同时形成二个新键是可能的(虽然不是必要的),而相反,三重线态碳烯却不可能这样,它必须经过多步反应过程才能变为生成物。同加成反应的情况一样,通过实验能够初步弄清插入反应机理的概括特征,其后通过理论分析变得更为完善,理论分析提供对反应机理的详细描述。
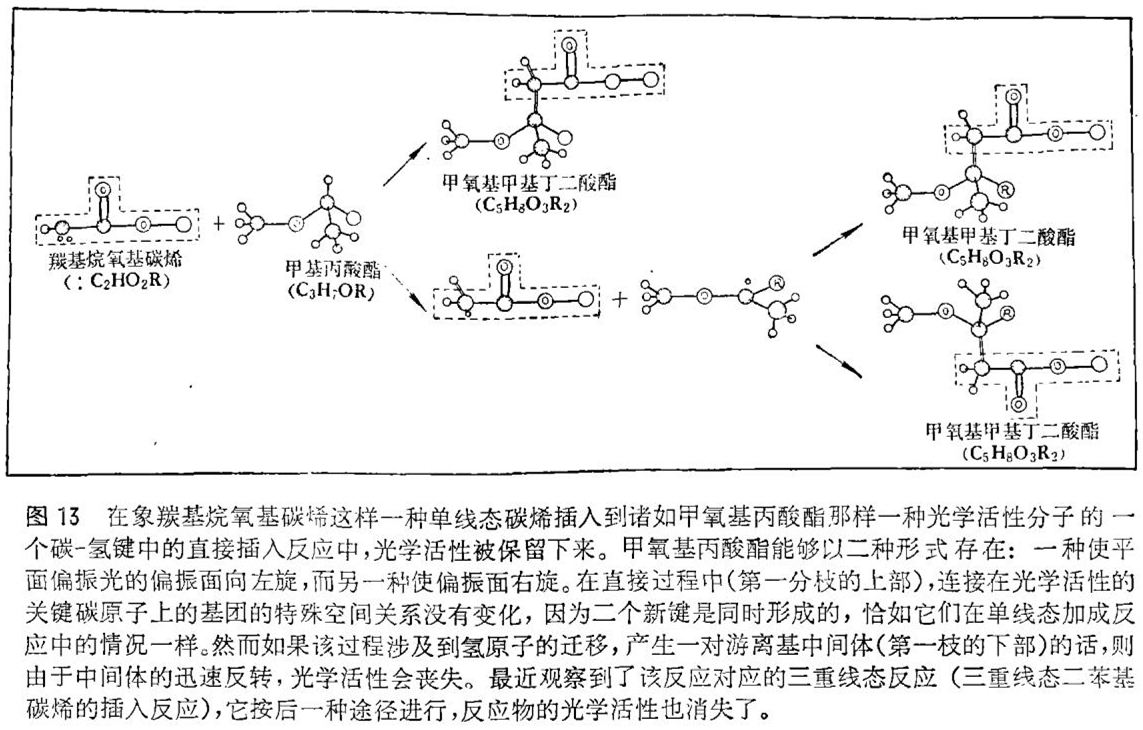
许多有机分子以左旋和右旋的形式存在。这种立体异构体互成镜像关系,除了它们对平面偏振光偏振面的旋转能力不同(一种异构体使偏振面向左旋转,另一种异构体使偏振面向右旋转)外,其它所有的化学和物理性质都是相同的。这样的分子就称为是光学活性的。
使一个碳烯直接插入到像甲氧基丙酸酯那样的光学活性分子的某一碳 - 氢键中时,可预期产生一个仍具有光学活性的分子。但是如果该反应机理中有氢原子的迁移,则由于生成的游离基迅速地反转,光学活性不可避免地会丧失(见图13)。已经知道有些单线态碳烯的插入反应结果会保持着光学活性。因此单线态碳烯插入反应的机理是通过二个新键的生成进行的,其间并没有明显的游离基的参与。最近,该反应的对应三重线态反应也被观察到了。三重线态联二苯基碳烯的插入反应会导致光学活性完全丧失。由此可见,三重线态碳烯的插入反应不是直接发生的,而是经过一对中间体游离基的。
理论的研究再一次证实了三重线态插入反应的机理。但是,对于单线态插入反应的描述在细节上却不同于实验所提供的反应的一般模式。仅仅用实验是不可能区别同时生成二个新键的真的直接过程,与产生一对相互不能分离的游离基的氢迁移过程。理论研究精确地描述出该反应的情景:虽然有一对游离基生成,但由于这一对游离基在生成的瞬间太接近了,所以必然导致它们一起破裂而形成单一的产物。
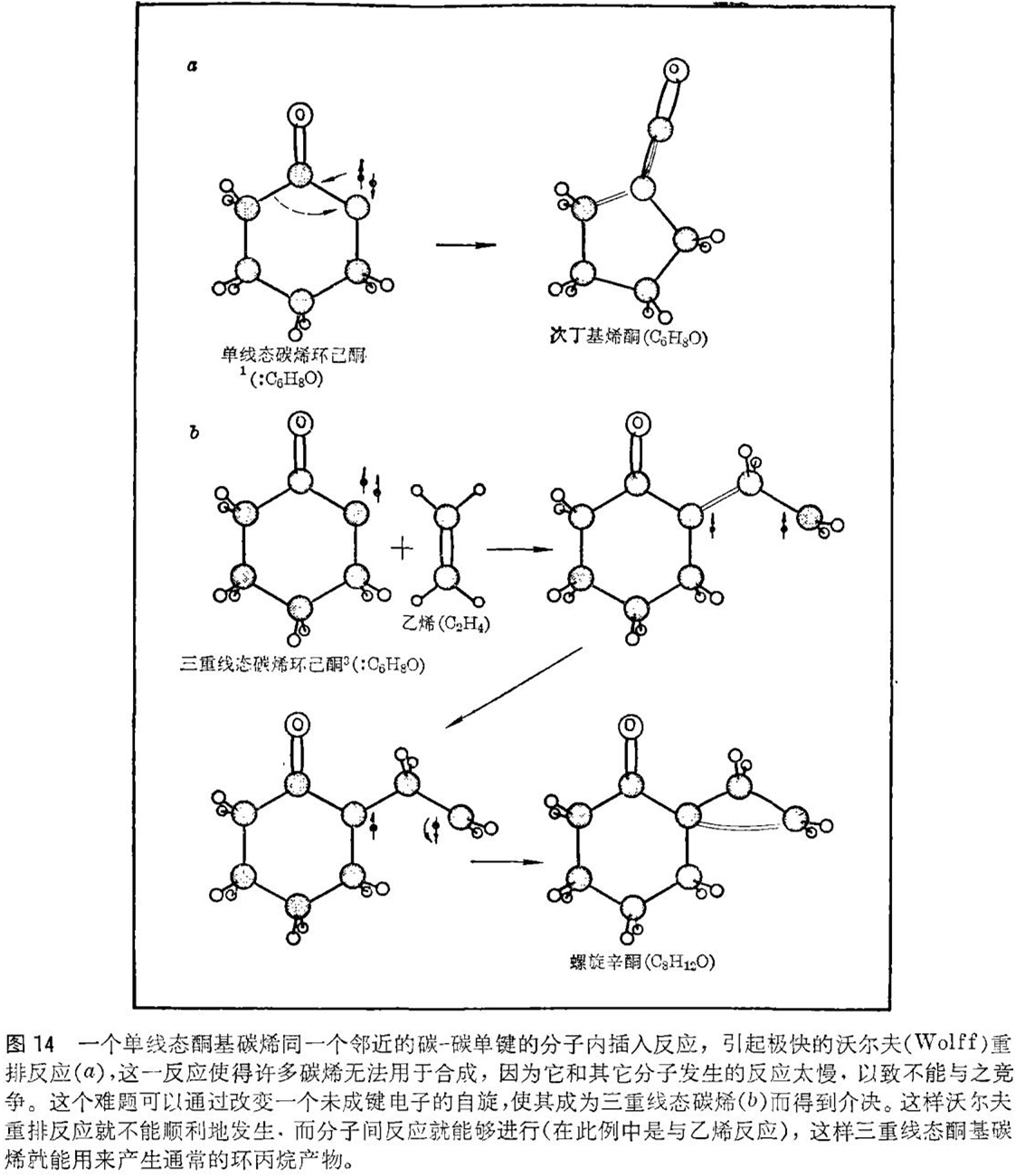
单线态碳烯的分子内插入反应的速度是如此之快,以致它完全凌驾于许多化学反应之上。要把某些单线态碳烯用于分子间反应是困难的,因为它们是极不稳定的,会非常快地同分子内邻近的键起反应。由于分子内反应不需要同其它的分子相碰撞,所以通常要比分子间反应快得多。业已发现许多碳烯对于合成新分子是完全无用的,其理由就是因为它们拒不参加任何类型的分子间反应。鉴于种种理由,我们认为三重线态碳烯对于分子内部键的反应活性不会像单线态碳烯那样大。
单线态碳烯的快速分子内反应的典型例子是酮基碳烯(具有一个氧 - 碳双键的碳烯)插入到相邻的碳 - 碳键中,产生烯酮的反应(见图14)。甚至即使在一种能同碳烯反应的溶剂中,使酮基碳烯产生时,大多数的酮基碳烯还是由于分子内反应(称为沃尔夫〔Wolff〕重排反应)太迅速,而以致不能生成有实用价值数量的加成产物。三重线态碳烯的情况则不是这样。用紫外线照射产生的三重线态酮基碳烯并不生成烯酮,而是生成通常的加成产物环丙烷。由此可见,三重线态的形成使碳烯发生了改变,从一种倾向于发生无实用价值的分子内反应的形态转变成一种更有用的形态。
概括地说,有二种二价碳。一种是单线态碳烯,它会迅速地和各种各样具有电子对的体系进行反应,而不生成可以检出的中间体。另一种是三重线态碳烯,它们虽然有时也产生一些同单线态碳烯产生的生成物结构大体雷同的生成物,但二者的反应机理却截然不同。依靠理论和实验巧妙地结合,我们对碳烯反应已经有了相当的了解,这就为未来的研究者开拓了能够更广泛地利用二价碳的道路。即使在今天人们也可以感到这门新的化学的开始。碳烯不仅已提供了一条有效地合成各种环丙烷和网状化合物的途径,而且也开始显示出它们可以被利用来产生更为奇异的分子。所谓奇异分子,就是意味着在某些意义上该分子是异乎寻常的,通过对这些奇异分子的研究,有机化学家想要寻求有关化学键的意外的新事实。
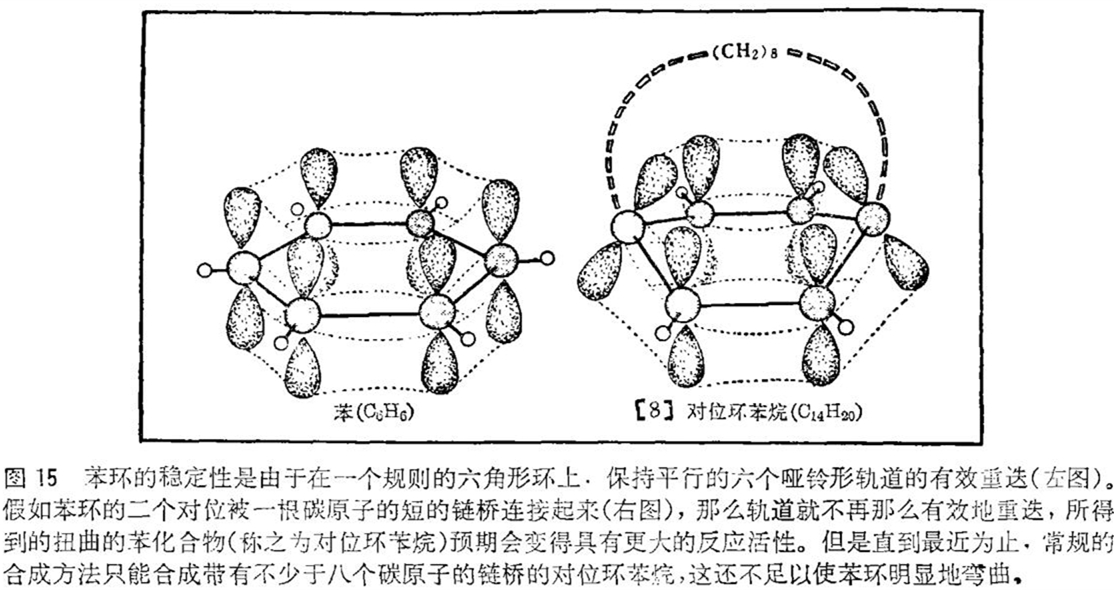
关于原子相互成键时所使用的轨道,我们已有了相当程度的了解,近似地说,二个不同原子的轨道重迭得越多,这二个原子就键合得越牢固。例如,像乙烯这样一类简单的双键烃类,二个哑铃形轨道重迭就形成了双键的π部分。苯分子由六个碳原子组成,这些碳原子通过六个互相重迭的哑铃形轨道这样一种特别稳定的排列,成环状地键合在一起。如果使这些轨道相互扭转,将会发生什么情况呢?苯环在失去它的稳定性之前,究竟能忍受多大的扭转,与此同时电子云的重迭会消失多少?一个扭曲了的苯环将会发生些什么反应呢?人们最终是否能推导出一个相互关系来表示分子的扭转角度同它所能够进行的化学反应之间的关系?这些都是物理有机化学家们想要解决的典型问题。
原则上,合成扭曲的苯环并不是一件十分困难的事情。称之为对位环苯烷的一类化合物已在本世纪五十年代和六十年代由一些研究小组所制得,特别著名的是由洛杉矶加利福尼亚大学的唐纳德 · J · 克拉姆(Donald J. Cram)所领导的和由诺曼 · L · 阿林格(Norman L. Allinger)(他当时在缅因州州立大学)所领导的研究小组。这些化学家们和其他研究者们费尽心机所做的工作就是设法用一根碳原子的链桥把苯环上的二个对位原子连接起来(见图15)。如果碳原子的链桥相当短的话,那么所生成的对位环苯烷的苯环就不得不弯曲起来。但这里存在着极大的困难,因为用常规的方法只能合成出链桥部分碳原子数不少于八个的对位环苯烷,而且即使这样也是花了九牛二虎之力的。但是用碳原子数为八或八个以上的链桥是无法使苯环显著地弯曲的 · 所以迫切期望着具有更短碳原子链桥的对位环苯烷。
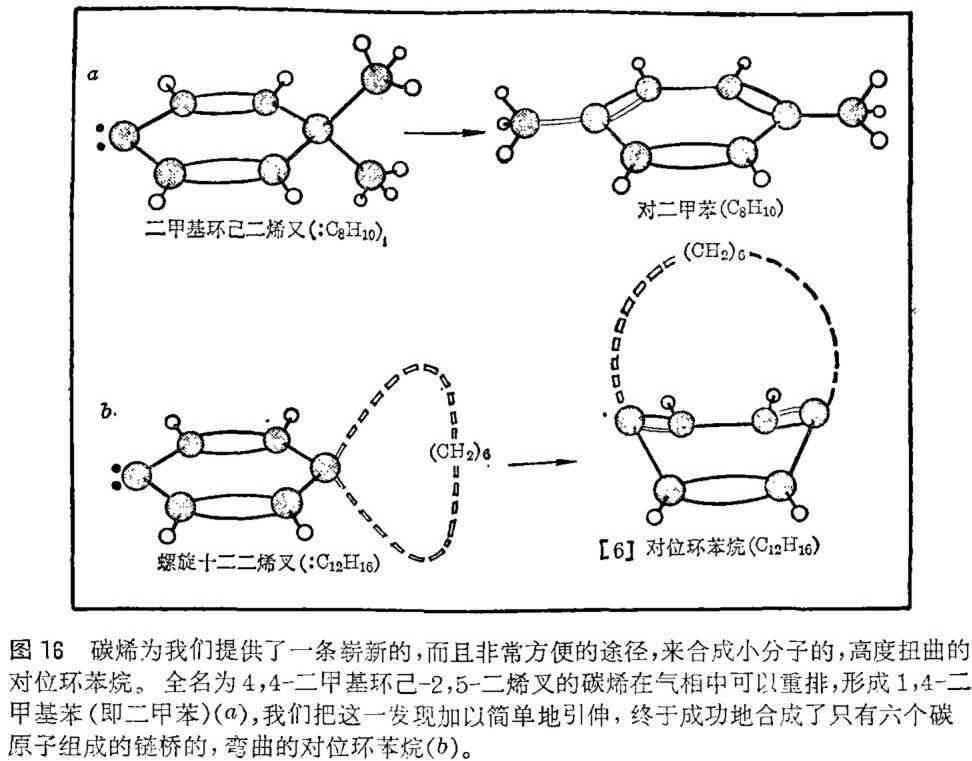
当时我们小组正从事研究碳烯的分子内反应,以期迫使碳烯进行更为困难的反应。我们一度曾想到用在气相中(同其它分子相遇的可能性能减到最低程度)产生碳烯的方法来使碳烯从其化学环境中分离出来。由此我们指望迫使碳烯找到某种途径,仅仅用其自身的分子内资源回到正常的四价状态。1967年,罗纳德 · 莱文(Ronald Levin)(他当时是一个大学毕业生,正在为他的博士学位完成实验工作)发现:一种被赋予4,4-二甲基环己-2,5-二烯叉这样一个奇长名称的碳烯在气相中发生重排,生成对位二甲苯(见图16)。特别令人感到惊奇的是该反应的特异性,它成为后来研究该反应机理的主题。这反应只生成一种形式的二甲苯分子——即只生成二个甲基处于苯环对位的那种异构体。这一点是一开始就清楚的,即这一反应为合成难得到的,极小的对位环苯烷提供了一条通道。原则上,只要把二个邻接的甲基改变成环,并期待环状化合物遵循同非环状化合物同样的反应途径就可以了。幸而剩余的问题很顺利地被解决了,具有六个或七个碳原子的链桥的对位环苯烷也被合成成功。更为幸运的是,结果弄清楚碳烯反应在环状体系中也和在非环状体系中一样容易进行,并且用这种方法仅在几天之内就合成了弯曲的对位环苯烷。
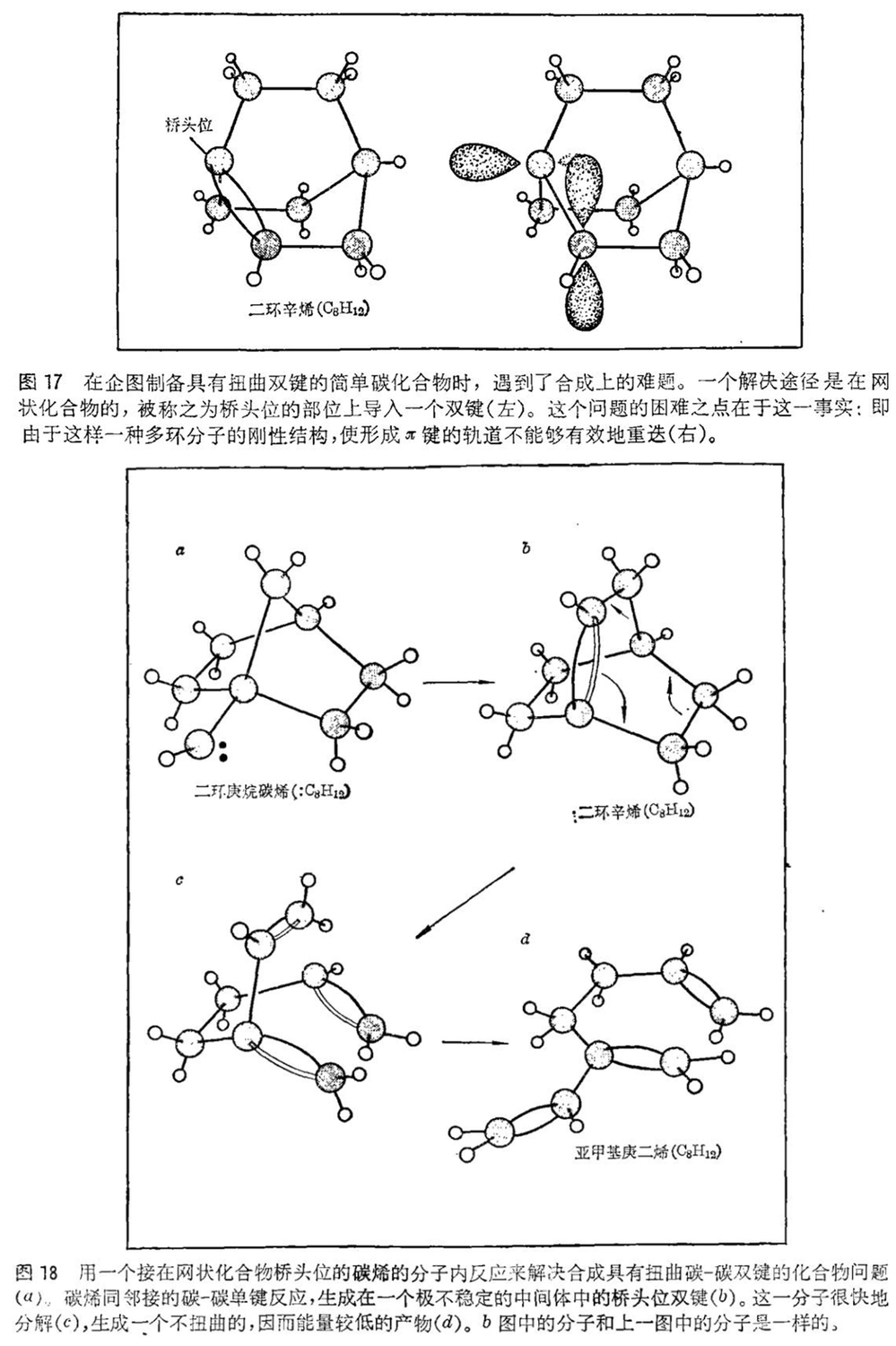
当我们的研究工作正在进行之际,也有一些人仍采用较老的合成方法,以期得到具有七个碳原子链桥的对位环苯烷,甚至在我们的工作完成之前,乔治亚大学的阿林格(Allinger)和T · J · 沃尔特(T. J. Walter)就宣告合成成功。但是显而易见,碳烯的气相重排反应是制备那些用其它方法虽不能说是不可能的,但需要耗时数月乃至数年的化合物的最简便的合成法。碳烯也很有希望作为具有扭曲双键的比较简单的化合物的原料。这又是许多化学家早就热衷研究的一个问题,但没有找到合成这种分子的一般方法。问题是要合成出在被称之为桥头位的部位具有双键的网状化合物(见图17)。这一合成的困难之处正是因为严格的、没有自由度的网状构造不允许组成双键的轨道有效地重迭在一起。这问题早在1924年就已经被德国化学家尤利乌斯 · 布雷特(Julius Bredt)所确认。在桥头位形成双键的困难,现在被归结称之为布雷特规则。今天虽然有许多化学家小组成功地合成了一些不服从布雷特规则的化合物,但我们认为碳烯可能为合成这种分子提供一条捷径。 · 我们的想法是在气相中制取碳烯,这样它除了反应生成在桥头位有一个双键的化合物外,就没有任何其它反应的路线了(见图18)。如果该体系设计得恰当的话,环除了扩大,生成一个“逆布雷特”化合物外,就没有别的选择余地了。这种化合物是极不稳定的,因此通常是不可能分离出来的,但是从我们已经分离出来的生成物来判断,显然我们的方法在合成具有强烈扭转双键的分子方面是成功的。
虽然,很难说在这一研究开始之际提出的所有问题已经完全得到了解决,但我们正在朝此目标不断前进。碳烯在便于我们研究有机分子是如何反应的一般问题方面,发挥了决定性的作用。有朝一日,当我们能够回答那些目前尚未解决的问题时,我们对化学键的知识将大大超过目前的状况,我们将更多地获悉有关我们周围化学世界的知识。
(李筱梅等译,胡志楠、莫汉庆校)