最近这几年,高等机体的一些基因被引入到大肠杆菌(E. Coli)细菌内,并在细菌里进行“无性繁殖”,就是说与细菌的遗传物质整合在一起。这样被插入的基因在细菌环境内自身一般不制造它们在天然环境中产生的蛋白质。因此,如果人们想把这些携带着外来基因的细菌转变成为合成蛋白质的小型工厂,关键在于强使它们表达传递给它们的信息。要做到这一点,迄今只是在极小的诸如生长激素释放抑制因子(somatostatine)的基因实例中获得成功。
近期,人们采用遗传工程技术(“遗传操纵”这个术语是广大公众比较熟悉的,但不恰当)已组构生产过诸如鼠胰岛素源和鸡卵清蛋白这样的蛋白质的细菌。这两项结果是决定性的一步:这些结果实际上说明了细菌生产高等机体蛋白质不存在任何困难了。这就为把这些技术应用于工、农和医药目的显示出广阔的前景。
组构细菌的技术
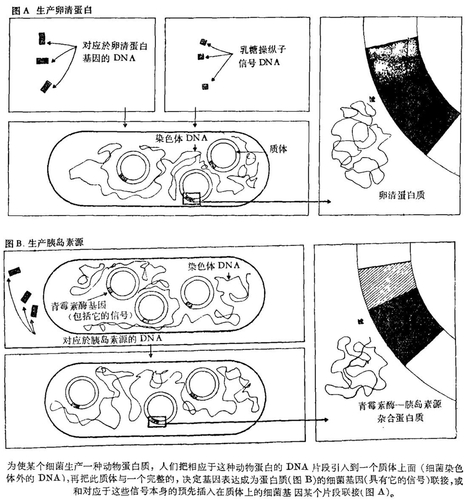
巴斯德研究所和法国全国科学研究中心某个研究组由于受到Ph. Kourilsky的激励,在斯特拉斯堡医学院的协助之下刚刚组构成一株大肠杆菌(E. Coli)菌系,大量生产一种与鸡卵清蛋白非常类似的蛋白质。人们知道,要把外来基因引入到细菌里并在其中进行无性繁殖,常常采用诸如染色体外的环状DNA小片断一样的但却能在细菌内增殖的质体。这些质体在天然状态下存在于许多的细菌菌系中。其中有些质体能在某个既定的位点上被打开;那么,它们就可能在这个位点上整合外来DNA的无论哪一个碎片,并把整合过来的碎片再引入到某个细菌里,而质体的增殖能力却不发生改变。于是,一个被质体运载的外来基因就能被引入到某个细菌里,并在其中保持活性。
对鸡卵清蛋白进行的研究工作,首先在于把卵清蛋白基因整合到某个细菌质体内。基因在这里意即DNA的一个碎片,理论上能控制386个组成卵清蛋白的氨基酸链的合成。但通过化学合成法未获得对应于卵清蛋白的DNA(这与生长的激素释放抑制因子是不同的):这一点几乎是不可考虑的,因为在它们中的卵清蛋白实例中,人们必须串列1158个核苷酸,而在它们中的生长激素释放抑制因子实例中,人们只须串列42个核苷酸。
采用一种酶系,人们通过拷贝卵清蛋白的mRNA而获得了DNA。必须注意到,此拷贝认真说来不是如人们在鸡细胞中发现到的卵清蛋白基因。这个天然基因很为复杂:甚至它的结构都与它在细菌里的表达很可能是不相容的。它实际上是用不连续的方式组合的,编码氨基酸的序列6次被其它功能不明的序列断裂。
1977年当人们获得了携带着人工合成卵清蛋白基因的细菌时,检测这些细菌合成卵清蛋白的任何企图总是徒劳的。结果,基因本身不自己表达。最切合实际的理由是,诸如曾经被整合到细菌内的基因就缺少被细菌生物合成装置所识别的信号,因为这些信号能起动基因表达。为了强使基因表达,自然就要设法把这样的信号嵌合在卵清蛋白基因上。由这些信号组构起来的细菌理应随后把外来的一些基因认作是它自己的基因,并且使它们产生卵清蛋白,而不产生半乳糖苷酶。作为适当的信号来源而选择出来的细菌基因组成大肠杆菌(E. Coli)的一个基因群,这就是很著名的Jacob和Monod的研究工作发表以来所一直沿用的名称——乳糖操纵子。为什么要选择这个呢?很简单,这是因为如同大肠杆菌(E. Coli)是今天人们了解最透彻的生命机体一样,参与乳糖操纵子表达的信号同样也是以大肠杆菌(E. Coli)最为人们所熟悉。
因此,实验主要在于把卵清蛋白基因与起动乳糖操纵子表达的信号进行融合。由于技术上的原因,必须保留少数毗邻于这些信号的基因的起始端(这个Z基因是编码一种所谓0一半乳糖苷酶的)。还必须剪切一部分卵清蛋白基因。这样,相应于Z基因信号和J3-半乳糖苷酶前8个氨基酸的序列,都嵌合在DNA的某个序列上,此序列相应于不包括卵清蛋白前5个在内的386个氨基酸。还必须把卵清蛋白的1143个核苷酸(3×381)翻译成相嵌合在Z基因起始端的24个核苷酸(3×8)上。实际上人们都知道3个核苷酸编码一个氨基酸,并且知道如果不考虑解读框架(每3个核苷酸为一组),人们就能得到一个全然不同的蛋白质。Z和卵清蛋白基因核苷酸序列的知识,使我们不惜对温和性DNA使用各种酶学操纵法来实现预期的组构。联合到某个质体上杂种基因(作为Z - 卵清蛋白的起始端的信号)再引入到大肠杆菌内。那么如我们所预期的那样,证明如此获得的菌系大量地(每个细菌生产5 ~ 10万个分子)合成一种蛋白质,无论就它的分子量还是就它的免疫化学特征都与鸡卵清蛋白接近。当然,这种蛋白质只是在设想细菌制造β - 半乳糖苷酶的条件下才被它合成。目前正进行鸡卵清蛋白和细菌产生的非常类似的蛋白质两者间的某种精细的比较分析。
这个实验的重要意义注重于理论方面。卵清蛋白从其氨基酸组成,根据营养范畴看,的确是一种“标准”蛋白质。如果再进一步提高细菌的产率,或许有可能利用它来作为与家禽媲美的人工合成食品。但是这个有意义的事实主要还在于具备重要价值的动物性蛋白质首次用细菌大量合成了。实际收率(根据大多数试验结果,每个细菌合成5 ~ 10万个分子的动物蛋白)与理论收率(10 ~ 20万个分子)几乎相差无几。细菌菌系虽然大量生产了某种奇异的对菌系本身无用的蛋白(卵清蛋白代表细菌蛋白量的0.5 ~ 1%)而耗费它一部分能量,但菌系本身是全然稳定的。
倾向于分泌奇异的蛋白质
生产胰岛素这件事情的本身,无论就其医药的和工业的意义都是显而易见的,因为全世界数以百万计的糖尿病患者每日就只靠注射胰岛素来治疗。所以有几个研究组正竭尽全力研究胰岛素基因在细菌中的表达。第一项成果是哈佛大学W. Gilbert研究组近期通过某种开创性的途径取得的。基本原理和上述的相同:首先,需获得一个胰岛素“基因”,这已经用mRNA的某种制剂,经过酶的合成而实现了。还必须精确测定mRNA对应于胰岛素的某种前体——胰岛素源(它在胰腺中被转化成胰岛素)。第二步,将此基因联合到具备有它的信号的大肠杆菌某个基因的起始端。第三步,实现某种融合,而融合是考虑到翻译相的,亦即3个为一组的核苷酸解读框架的。遵循的程序是以这后两步为出发点。
选择的大肠杆菌基因实际就是控制能穿过细胞内膜的某种蛋白质(一种青霉素酶)合成的基因,并且在某些条件下是人们在细菌的外部能获得的基因。决定向外部转移的青霉素酶的部分是位于分子的起始端(氨基末端一侧)。因而,嵌合在胰岛素源上的青霉素酶起始端而产生的某种杂种蛋白质就理应向外部移动。此外,为了实现两条成翻译相的DNA的融合,所遵循的程序主要在于把它们连接到远处的核苷酸上,只不过中间用长度不等的DNA的一条短的序列隔开。类此,就有1/3的可能性落在翻译相上。实际上,过去组构的一个细菌合成量低(每个细菌100个分子),连接到青霉素酶起始端的182个氨基酸上的,其实是胰岛素源的82个氨基酸。这项成果的意义从医药范畴来看不在于某个重要的分子,而是在于它为迈向分泌所合成的奇异蛋白质走出了决定性的一步,一方面使它们避免被偶发性降解,另一方面将会大大便利于把它们提纯出来。
因此,目前世界上存在着以生产三种不同的动物蛋白质为其特征的三株细菌菌系,这三种蛋白质是人的生长激素释放抑制因子,鼠胰岛素源和鸡卵清蛋白。生长激素释放抑制因子(14个氨基酸)是按照每个细菌数4个分子来生产的,鼠胰岛素源(82个氨基酸)是按照每个细胞100个左右分子来生产的,卵清蛋白(381个氨基酸)是按照每个细菌多达10万个分子来生产的。人们看不出有什么障碍将会阻碍这一可观的进展。可是却有人会提出一个还未找到普遍的解决办法的重大困难问题:即组构的细菌准确地合成人们所寻求的产物。因为,细菌合成的产物既不准确地对应于胰岛素源实例中的天然产物(图B),也不准确地对应于卵清蛋白实例中的天然产物(图A)。在胰岛素的实例中,还存在有待于W. Gilbert研究组说明的问题,即杂种蛋白质是否能重新产生胰岛素的生物学活性。这个问题是由下列事实引起来的,因为要精确地把细菌的信号缝合到外来基因的每个起始端上就更加困难了。采用化学合成法进行适当的多核苷酸缝合无疑会有利于解决许多的问题。
根据来自大西洋彼岸的消息,人胰岛素产生菌已经问世了。遗传工程不久当信守许给人类的诺言。
〔La Recherche 1978年第94期〕