神经元的覆盖物负责调节突触的变化,它们举足轻重,与记忆、精神障碍、孤独症、阿尔茨海默病以及成瘾息息相关。

1898年,杰出的意大利医生和病理学家卡米洛·高尔基(CamilloGolgi)发表了一篇有关“神经细胞”结构的里程碑式文章。文中涉及如今仍以他的名字命名的高尔基体,此外,他还描述了一种“纤弱的覆盖物”,它们覆盖着神经元细胞体,并随着树突延伸。同年,另一位意大利学者阿图罗·多纳吉奥(ArturoDonaggio)观测到如今被称作围神经元网(PNNs)的覆盖物存在一些开口,他正确地猜测到:神经元的轴突终末正是通过这些开口与相邻的神经元形成突触。
然而在那之后,科学界却忽视了PNNs,尤其是高尔基的“劲敌”圣地亚哥·拉蒙-卡哈尔(SantiagoRamóny Cajal,二者之后分享了诺贝尔医学奖)在实验中将PNNs作为组织学上的人工伪像而剔除。直到20世纪70年代,由于组织学技术的进步和免疫组织化学技术的问世,研究者确认PNNs存在于许多脊椎动物(包括人类)脑和脊髓的某些神经元周围。
PNNs由细胞外基质(ECM)分子组成,婴儿出生后开始形成,标志着所谓“脑可塑性提升的关键时刻”的结束。在出生后的一段时间内,外界环境对神经元回路的接通有着深远影响,并影响到机体的技能和行为,譬如语言、感觉处理和情绪特质的发展。但是到了幼年和青年时期,神经网络逐渐固定下来,以保证个体可以保持这些习得功能。过去的15年间,累积的证据提示PNNs通过稳定神经元间已经存在的连接,抵抗外来轴突形成新的连接,促进了许多脑区的固定化过程。
神经元细胞有限的可塑性导致中枢神经系统(CNS)的许多病症是不可恢复的,像中风、脊髓损伤和神经退行性疾病,因而以PNNs为靶点增强CNS的修复能力前景光明。此外,PNNs在记忆过程中的重要调节作用也逐渐被认识。
PNNs还可能在CNS正常功能中起到支撑作用。实验中反复观察到这层“外衣”出现在高活跃性的神经元周围,因此研究者假设这一结构提供了一个缓冲性的、充满负电荷的环境,以控制钠离子、钾离子和钙离子等的扩散,作为一个高效的阳离子交换器来保持神经元活性。PNNs还存在保护神经元免受氧化应激的能力,它们限制了过量活性氧对神经元功能和生存的不良影响。确实如此,在PNNs受到酶促降解后,神经元会对氧化压力更加敏感。
过去20年中,人们在阐明PNNs结构和功能方面取得了许多进步,确定了它们在CNS可塑性方面的作用,并研发出操纵PNNs的方法,以提升可塑性、记忆力和CNS的修复能力。但PNNs在脑中确切的作用方式以及它们在生理和病理条件下重塑的精确机制仍不明晰。
PNNs与可塑的脑
PNNs结束脑可塑性关键时期的作用现在已建立了较为完备的机制。2010年,我和我的同事们就通过基因敲除去除了小鼠PNN成分之一的连接蛋白,观察到小鼠表现出PNNs形成程度的下降,且在成熟后依然保持着年幼时的脑可塑性。
另一个证据是患有弱视的大鼠,弱视这一神经发育疾病的病因是:在视觉发育的关键时期双眼发出的神经信号不均衡。左右眼输入的信号在初级视觉皮质中的神经元首次汇聚时相竞争,在皮质的生理和结构上就会表现出两只眼信号的相对强度。这意味着,当一只眼睛丧失了视觉信号输入――可能因为先天性白内障――之后,大鼠就丧失了这只眼睛的皮质反应,而健侧眼睛的信号输入会被上调,最终导致了视觉缺陷。成熟后,由于可塑性关键期已结束,即使弱视的病因被根除,视觉缺陷将不会被治愈。将成熟大鼠的视觉皮质的PNNs移除,却有治疗弱视的效果。
在一些特殊情况,比如足够的环境刺激下,成年期脑会重获一定程度的可塑性,PNNs在其中表现出重要的中介作用。患有弱视的成熟大鼠如果被养在一个有很多玩具、梯子和跑步轮的笼子中,会表现出视觉皮质中PNNs的减少。若没有其他干预条件,患病大鼠在2~3周后有恢复正常视力的趋势。
2016年,我和我的同事们记录了前庭系统中PNNs与可塑性的相似关系,前庭系统监测头部的位置和加速度,稳定凝视和身体姿势,并有助于自体运动知觉。内耳前庭受体受到永久损伤的小鼠通常表现出不能保持体态和平衡,但随着时间积累会有所好转。这种好转是随着脑干中调节前庭功能的区域中PNNs的减少而开始的,且这之后PNNs会在体态和平衡加强后完全重塑。
除了这些感官缺陷恢复的例子,成年期脑在一般学习过程中也会表现出恢复可塑性的趋势,最近的证据指向了PNNs在记忆形成和保留中的作用。在啮齿类动物中,外显性记忆――能够被有意识地回忆起的信息――能够通过一种“新物体认知测验”来评估,测验中动物在同时面对熟悉的物体和新的陌生物体时,会花更长的时间摸索新物体。这类记忆需要大脑皮质中一个特定区域的突触可塑性。缺乏连接蛋白的变异小鼠,其PNNs减少,会表现出对熟悉物体更久的记忆,而通过细菌酶硫酸软骨素酶ABC进行PNN降解后,也有类似的结果。这两个例子中,移除PNNs都促进了对突触可塑性的诱导。
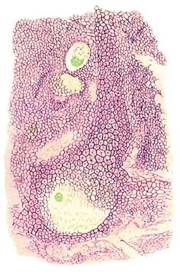
意大利神经学家卡洛·贝斯塔(CarloBesta)1910年染制的狗脊髓细胞,并于1998年在《神经科学动态》上再发表,图中可见PNN的多边形结构
除了阻止记忆形成外,PNNs还可能是阻止记忆消除的原因。年幼个体可以通过消退训练――一种涉及将恐惧诱发刺激和中性情境相关联的学习形式――来永久性地消除恐惧记忆,而成熟个体则对这种消除有所抵抗,并依旧表现出恐惧行为。这些行为的基础是杏仁核,在杏仁核中,成熟动物会有PNNs,而年幼动物没有。有趣的是,对成熟小鼠通过硫酸软骨素酶ABC处理杏仁核致PNN降解后,能够通过消退训练消除恐惧记忆的关键时期又会再次出现。除此之外,许多皮质区域中的PNNs近期被证实在储存恐惧记忆中有重要作用,而移除PNNs会干扰这类记忆的储存。
现如今,硫酸软骨素酶ABC在移除实验动物的PNNs中被广泛运用,但是这一操作缺乏特异性,因为在降解PNNs的细胞外基质分子的同时,它还影响到了CNS组织。研究者在寻找更精细的手段来操纵动物模型的PNNs,由此进一步理解PNNs在调节脑可塑性中的作用,同时实现对神经元可塑性的精细调校。此外,行为学研究已经充分证实了PNNs在调节脑可塑性中的作用,但其背后分子学机制的细节部分仍然未被探明。最近,有关PNNs构成的研究正为这一问题提供线索,对人们有所启示。
PNN结构与其对脑可塑性的控制
不少ECM分子在PNNs中表现出较其他细胞外区域更高的浓度。PNN结构的支柱是透明质酸,透明质酸上还结合着硫酸软骨素蛋白多糖(CSPGs)。这种连接正是由连接蛋白稳定的。CSPGs则由核心蛋白和附加糖链组成,糖链中不同的硫酸盐化形式为多种多样的分子和受体提供了特异性结合位点,影响着CSPG的功能。
PNNs控制神经元可塑性的机制之一就是通过CSPGs和同源蛋白Otx2的交互作用。同源蛋白作为胚胎发育时有关键作用的转录因子,控制组织脊椎动物脑分化为不同的区域。许多同源蛋白还作为旁分泌信号因子在细胞间穿梭。在小鼠实验中,减少视觉皮质神经元对Otx2的“捕获”,即阻止其结合CSPGs,会抑制PNNs的组装,进而增加可塑性,促进患有弱视的成年期动物视力的恢复。同时,2016年的一项研究证明了Otx2在调节PNNs对初级听觉皮质中经验依赖的“音高地图”(依据声音频率响应的神经元空间排列)形成的影响,以及声学偏好的获得(这一过程由内侧前额叶皮质调节)二者中的作用。
另一个调节PNN控制的可塑性的可能机制是依赖轴突引导分子――脑信号蛋白3A,它结合在CSPG上,在成熟生物脑不同的神经元集群的PNNs中都有很高的浓度。近期的研究表明在PNN糖类上培养的神经元只能生长出较短的神经突,而这种抑制作用在脑信号蛋白3A的作用下会有所加强。但是脑信号蛋白3A结合于PNNs的作用仍是未知的。PNNs可能直接通过神经元上CSPGs受体产生交互作用,正如CNS损伤后常见的那样:CSPGs在患处的表达被上调并结合于特异性受体,以抑制突触的再生长。无论如何,至今都没有明确证据证明包绕有PNN的神经元或突触存在CSPG受体。尽管PNNs影响神经元可塑性的确切机制并不明晰,这一影响的效果已有详尽的记录。研究者正逐渐将PNNs作为潜在靶向目标,通过加强可塑性来治疗各种疾病,如弱视、神经退行性疾病、精神分裂症及成瘾的精神障碍。

PNN结构:PNN由硫酸软骨素蛋白多糖(CSPGs)组成,图中可见其核心蛋白和侧面一定数量的糖链。CSPGs结合于由膜结合酶分泌的透明质酸,连接蛋白稳定着透明质酸和CSPGs间的交互作用。Sema3A和Otx2结合在CSPGs的糖链上,肌腱蛋白R是几个CSPGs间的交叉连接蛋白,协助PNN的大分子组装
PNN靶向治疗疾病
发现PNNs在记忆中作用的同时,PNNs与药物相关记忆有关的证据也逐渐积累。与过去药物使用相关的环境因素(比如人或者场景)能够作为药物寻找行为的强烈诱因,并导致成瘾的发展。因此打断这种关联性在成瘾治疗中可能有一定帮助。
啮齿动物的研究表明背侧小脑皮质的PNNs可能与可卡因相关记忆的形成和保持有重要关系,而在海洛因自身给药后,前额叶皮质中的PNNs有所减少,但再次暴露于海洛因相关因素后会立刻增加。与之相反,前额叶皮质中PNNs的降解会降低大鼠对可卡因记忆获得和保持,而在实验动物暴露于吗啡、可卡因或海洛因之后,杏仁核中PNNs的降解能够抑制药瘾的再发。总而言之,PNNs表现出形成和/或保持药物相关记忆的关联性,因此可作为靶点来减弱导致药瘾再发的记忆带来的影响。
用实验方法降解PNNs也展现出了在治疗各种形式脑损伤方面的前景。啮齿类动物研究证明了通过硫酸软骨素酶来降解PNNs会诱导新轴突分支和突触的形成,这就可以帮助在中风、心理创伤和脊髓受损后恢复一些特定功能。在阿尔茨海默病的小鼠模型中,该病会影响记忆形成,而通过脑内硫酸软骨素酶注射可以成功恢复形成新记忆的能力,甚至在当神经功能障碍已经扩散且细胞开始死亡的情况下也有效果。
有时并非PNNs的存在会导致问题,而是PNNs的结构异常。比如说,研究者观察到阿尔茨海默病患者负责复杂认知功能的脑区,如额叶皮质和内嗅皮质中出现PNNs密度的下降或形态的退化,这说明存在PNN异常的神经元可能更容易走向死亡。
在精神分裂症患者的脑尸检结果中也能够观察到异常的PNNs,与情感学习和联想感官信息处理有关的部位,如杏仁核、内嗅皮质和前额叶皮质中尤为明显。研究者们认为编码CSPGs、脑信号蛋白3A和其他一些正常ECM组分如整合素和重塑酶的基因变异,会带来精神分裂症的风险。而神经元在失去PNNs后,会对氧化应激带来的兴奋毒性效应更加敏感,而这一兴奋毒性效应被认为是精神分裂症的可能机制。
还有一些其他精神疾病可能与PNN异常有关。比如,基因学研究已经确认了一些ECM和PNN调控分子,包括脑信号蛋白3A、透明质酸表面受体CD44和Otx2,它们的异常可能是导致孤独症的病理因素。类似的还有,郁躁症患者的尸检结果显示,与杏仁核内PNNs相关的特定糖类或蛋白质含量都有显著下降。科学家认为编码CSPG神经聚糖的基因发生变异可能是郁躁症的风险因素之一。同样,进行了神经聚糖基因敲除后的小鼠会表现出狂躁的行为,这一点也增强了结论的可信度。更进一步的发现是,重度抑郁症患者、处于抑郁状态的郁躁症患者、精神分裂症患者和孤独症患者的血液样本中都存在基质降解酶含量的升高。
另一种可能被PNNs状态影响的脑部疾病是癫痫,其特征是神经活性模式的异常,并导致了惊厥、情感和感觉异常,以及失去意识。在癫痫的动物模型中可以观察到PNNs的减少,研究者们推测这会恢复突触重组的能力,而这一现象可能紧随痉挛发作而发生。相反地,PNN异常可能会导致痉挛更易发生。比如说,在缺乏帮助合成透明质酸的酶的小鼠中,可以观察到癫痫活动性的增加。
尽管许多问题尚未明了,研究的的确确证明了以PNNs为靶向来治疗一些脑部疾病有光明的前景。但至今为止,尚没有一种作用于PNNs的化合物被选作药物候选,因为这些化合物的作用都过于宽泛,因此科学家们仍在努力研发能够精准作用于PNN的特定物质。同时,发明无创的、精准靶向人类特定脑区PNNs的方法仍是一个挑战,研究者希望这能够为未来研发各类疗法铺路。
资料来源 The Scientist
责任编辑 彦隐
___________________
本文作者达尼埃拉·卡露里(Daniela Carulli)是意大利都灵大学神经科学系的助理教授,还是卡瓦列里?奥托伦吉神经科学研究所的一员。


