余金生
华东师范大学紫江青年研究员
周剑
上海分子治疗与新药创制工程技术研究中心主任,华东师范大学教授
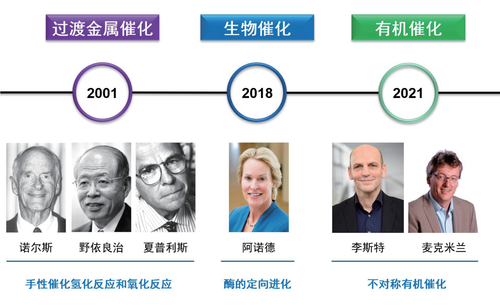
北京时间2021年10月6日下午,瑞典皇家科学院宣布2021年诺贝尔化学奖花落德国马普煤炭研究所的本杰明 · 李斯特(Benjamin List)教授和美国普林斯顿大学戴维 · 麦克米兰(David MacMillan)教授,以表彰他们在“发展不对称有机催化”方面所做出的杰出贡献。至此,不对称催化的三种基本方法均已获得了诺贝尔化学奖的青睐:金属催化(2001)、酶催化(2018)和有机催化(2021),彰显了手性化合物的高效催化合成这一领域的巨大研究价值和勃勃生机。
什么是手性
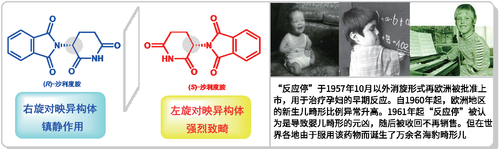
所谓手性,是指物质或物体与其镜像不能重叠,如同左手和右手的关系一样。手性是自然界的一种基本属性,大至星云、行星自转以及台风漩涡,小到攀援植物、螺壳以及微观分子如氨基酸、糖类分子等都具有手性。1848年,巴斯德首次实现从没有光学活性的混合物中分离出光学活性的部分,并发现所得的手性酒石酸钠铵盐晶体形成的溶液能使平面偏振光发生偏转,并预言互为对映异构体的左旋和右旋酒石酸的分子结构一定如同物体与其镜像的关系,从而打开了分子手性的研究大门。然而,人们认识到手性化合物的一对对映异构体在生物体中可能表现出截然不同的性质,则是在药物灾难“反应停”事件发生之后——旨在减轻孕妇妊娠反应的名叫“沙利度胺”的药,导致诞生了约2万名形如海豹的短肢畸形儿童。具有手性碳的“沙利度胺”药物是以消旋体的形式(等量左旋和右旋对映异构体的混合物)服用的,但右旋异构体能起镇静作用,而左旋异构体则强烈致畸。
这次惨痛事件让人们认识到手性分子的一对对映异构体尽管分子式和原子连接方式相同,但是原子空间排布位置不同的差别会导致其在生物体内的药理活性、毒性和代谢过程等方面存在着差别。这是因为构成生命体的核酸、蛋白质、糖类等基础物质都是手性的,它们在生命体内形成手性环境,而手性药物分子要与生命体内靶向分子的手性匹配,才能引起有效的药理反应。经过几十年研究,人们发现临床常用药的2/3是手性的,而手性药物和其对映异构体可能药理活性相同或相近,也可能对映异构体的活性低或者无活性,甚至两者药理活性不同,如“反应停”分子。因此,美国食品药品管理局于1992年起要求所有在美国上市的手性新药,必须分别对左旋或右旋异构体进行药理和毒性实验,我国也从2006年起要求如此。此外,手性农药、香料或者食品添加剂等同样存在着手性要求,如广泛使用的除草剂异丙甲草胺的活性主要由S-构型的异构体贡献;咖啡和冷饮里用的甜味剂阿斯巴甜,其甜度约是蔗糖的200倍,但它的对映异构体却是苦的。
图1 导致“反应停”事件的元凶沙利度胺分子的一对对映异构体
使用单一手性的药物可以提高药效和降低副作用。即使对映异构体无害但活性低,使用单一手性药物也可以在较低用量下达到疗效,从而减少代谢负担。使用手性农药还能减少施用量和次数,降低对环境的影响。如上述除草剂从1997年起以手性药物代替消旋体施用后,使用量减少了40%,相当于每年向环境减少排放8千多吨化学物质。
手性合成之不对称催化
随着手性物质在医药、农药、香料、材料和信息等多个领域应用越来越广,经济高效合成单一手性的分子无疑变得十分重要。最初,人们尝试从天然产物中分离获得手性化合物,但能从自然界中直接获取的手性化合物种类有限,而且含量也往往不高。以抗癌明星分子紫杉醇为例,从1吨红豆杉树皮中,仅能提取出1克紫杉醇。常规的合成方法只能同时获得一对对映异构体分子,需要通过手性拆分来获得其中的有效异构体。这将导致一半的产物被浪费,并且在分离过程中耗费大量能量、人力和物力,并产生大量废弃物。因此,必须发展手性合成方法来获得手性化合物。
人们先后发展了天然产物转化、手性原料参与的手性合成等方法,但这些方法只能从一个手性原料出发得到一个手性产物,难以满足对手性化合物的日益增长的多样性巨量需求。因此,如何实现手性增殖,即从一个手性催化剂出发获得成十上百甚至上百万个光学纯度很高的手性产物,成为合成化学的核心研究内容之一。这一研究称为不对称催化,在过去半个多世纪得到了蓬勃发展,并成功发展了金属催化、酶催化和有机小分子催化这三种策略。
金属催化是指利用配体和金属形成的手性金属催化剂来催化反应对映选择性地进行,通常是催化剂的金属提供反应位点,而手性配体营造手性诱导环境。这是美国孟山都公司诺尔斯(Knowles)博士在20世纪60年代开创的研究思路,随后得到蓬勃发展并已广泛应用到工业生产中。一些高效的方法如不对称氢化能实现利用一个手性金属催化剂产生几百万的手性产物。为此,诺尔斯与在这领域做出杰出贡献的日本名古屋大学野依良治(Noyori)教授和美国斯克利普斯研究所的夏普利斯(Sharpless)教授分享了2001年的诺贝尔化学奖。
酶催化因其高效和专一性也得到广泛应用,并形成了有机化学、生物化学和微生物学等多学科交叉的研究领域。特别是通过定向进化得到的工程酶因具有更高的活性、更高的热稳定性以及更优良的立体选择性等优势,将在不对称催化中发挥更大作用。加州理工大学阿诺德(Arnold)教授也因在“酶的定向进化”方面的开创性贡献获得2018年诺贝尔化学奖。
不对称有机催化的进展
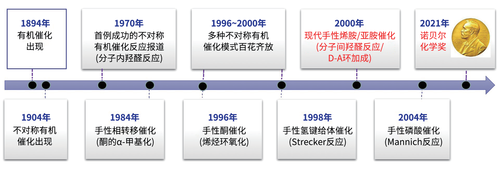
有机小分子催化,即使用有机小分子化合物而不是金属来催化反应,最早可追溯至1894年脑文格(Knoevenagel)利用乙二胺来促进甲醛和丙二酸酯的缩合反应。而不对称有机催化可考证的最早尝试是1904年利用生物碱类天然产物来催化制备手性羧酸。尽管陆续有尝试,但早期探索并未取得理想结果,直到20世纪70年代初,首例成功的不对称有机催化反应才由罗氏和先灵公司的多位研究人员分别独立报道。他们发现简单的脯氨酸可以在温和条件下催化具有重要应用的分子内不对称羟醛反应,取得高达93%的对映异构体过量值(ee)。尽管该研究展示了有机催化的诸多优点,但思维盲点导致人们认为该方法仅局限于分子内反应,所以未受到足够重视。随后的20多年里,仅有1984年默克研究团队发展了手性相转移催化这一亮点。
从1996年起,不对称有机催化的研究迎来了小高潮,进入了新的催化模式和催化体系百花齐放的阶段。一些标志性成果按照时间顺序介绍如下:香港大学杨丹教授(现任职西湖大学)和当年在美国科罗拉多州立大学的史一安教授(现任职常州大学)发展了手性酮催化,麻省理工学院傅(Fu)教授发展了手性吡啶衍生物的亲核催化,还在美国宾州大学的张绪穆教授(现任职南方科技大学)报道了手性叔膦催化,哈佛大学雅各布森(Jacobsen)教授开拓了手性氢键给体催化,布兰迪斯大学的邓力教授(现任职西湖大学)拓展了金鸡纳碱双功能催化。这些原创性研究让人耳目一新之余,从不同角度展示了有机催化的潜力,如星星之火点燃了21世纪初的有机催化的希望曙光。
进入千禧年,李斯特和麦克米兰两位年轻教授关于手性胺催化的研究工作横空出现。当时还是斯克利普斯研究所课题组长的李斯特教授和勒纳(Lerner)教授以及巴巴斯(Barbas III)教授合作,实现了脯氨酸催化的高对映选择性的丙酮和醛的分子间羟醛反应。这一手性金属催化也难在温和条件下实现的高选择性“分子间”反应,颠覆了以往氨基酸催化局限于分子内反应的错误认识,奠定了现代不对称烯胺催化的基础。几乎同时,加州伯克利分校的麦克米兰课题组报道了利用手性二级胺来活化共轭烯醛与共轭二烯发生[4+2]环加成反应,高立体选择性构建六元环化合物。这项研究开创了现代不对称亚胺催化的先河,其关键是利用手性胺现场活化共轭烯醛(酮)来形成亲电性更高的不饱和亚胺正离子。
图2 不对称催化三获诺贝尔化学奖
图3 不对称有机催化发展大事记
接踵发表的两份获奖工作,显示手性胺既可作为烯胺催化剂又可作为亚胺催化剂来发展新的不对称催化反应,并且反应条件比较温和以及操作简便。再加上手性胺通常容易制备和保存的特点,立刻吸引全世界很多课题组加入手性胺催化研究的赛道——利用各种结构的手性胺催化剂来发展合成手性醛或者酮的新反应,因为这些手性产物在天然产物、药物和精细化工品合成中具有重要应用价值。手性胺催化还有一个独特魅力是烯胺催化和亚胺催化这两种模式还可在一定条件下相互转化,相辅相成。同一个手性胺催化剂可以根据反应设计来表演“变脸”艺术,反复执行烯胺催化或者亚胺催化,从而可以模块化组合多个反应,实现从简单原料出发“一锅法”合成复杂多手性分子。这一特性,李斯特教授曾以“不对称胺催化的阴和阳”来进行形象的总结介绍。
手性胺催化的突破进展引发了有机催化研究的爆发式发展,促进新的催化体系和策略不断涌现。一个重要进展是日本学习院大学彰山(Akiyama)教授和东北大学的寺田(Terada)教授于2004年同时发展的手性膦酸催化,开辟了手性质子酸催化的新领域。此外,两位诺奖获得者还进一步丰富了手性胺催化。比如,麦克米兰教授提出了有机接力催化的概念,发展了手性胺的单电子占有轨道(SOMO)催化,以及把手性胺催化和光催化结合来实现单一催化不能解决的反应。李斯特教授结合手性磷酸催化拓展了烯胺和亚胺催化的范畴,进而发展了不对称抗衡阴离子催化的合成新策略,以及设计开发了酸性更强的手性强酸体系,将有机催化的效率提高到了一个新台阶。
时至今日,有机小分子催化已奠定了与金属催化和酶催化三足鼎立的地位,并展示了一些独特的优势:具有丰富的活化模式,可以根据底物的特点选用不同的活化模式来设计新反应;催化剂往往可以从光学纯的天然原料出发方便制备,且对空气和水不敏感,存贮和使用方便;催化剂和底物之间的作用可以通过共价键、离子对或者氢键作用等方式来实现,手性控制能力强;兼容性较好,有助于通过协同催化来实现单一催化不能解决的合成难题;无需担心重金属离子对产物的沾染等。这些优点对于药物研发非常具有吸引力。
不对称催化的未来
不对称催化研究再获诺贝尔奖似乎预示着手性合成的研究已经比较成熟。其实不然,这一领域还有许多问题值得深入探索。按照2001年诺奖获得者野依良治教授所指出的高标准:“未来的合成化学必须是经济的、安全的、环境友好的以及节省资源和能源的化学,化学家需要为实现 ‘完美的反应化学’ 而努力,即以100%的选择性和100%的收率只生成需要的产物而没有废物产生。”现有的大部分不对称催化方法的效率都还有很大提升空间。不论寻求“手性起源”这一未解之谜的答案,还是发展“理想”的不对称催化合成方法来提供各种手性物质满足生活和发展需求,都还需要上下求索。
值得一提的是,我国有机化学家从20世纪80年代开始发奋图强,在不对称催化领域奋起直追,目前已经大大缩小了与国际顶级水平的差距。设计发展了以周氏手性螺环配体、冯氏手性双氮氧配体为代表的一批享誉海内外的优势手性配体和催化剂,实现了以罗斯坎普 - 冯(Roskamp-Feng)反应为代表的系列高效不对称催化新方法。目前,我国已经形成了以中青年骨干为主的梯度合理的活力研究队伍,致力于发展具有自主知识产权的手性技术服务于国家新药研发、生态安全、高新材料等战略需求。中国科研工作者一定会为实现不对称催化“精准化”和“实用化”,为解决国家“卡脖子”的战略需求做出应有的贡献。