尿意是如何被我们感知的?这种基本冲动居然出乎意料地复杂,还会随着年岁增长而失常。
你正在驾车,眼睛紧盯着前方道路,突然感到下腹一阵轻微的刺痛。一小时前你饮下的超大杯可乐已经穿过你的肾脏进入膀胱。“该靠边停车啦!”你寻思着,同时眼睛四处搜寻着出口匝道。
对大多数人而言,把车开进高速公路休息区是很稀松平常的经历。但对研究大脑如何感知、解读并响应膀胱信号的神经科学家丽塔·瓦伦蒂诺(Rita Valentino)而言就没这么平常了。她对大脑能够接收膀胱的感觉、结合身体外部的信号(如路上的景象和声音),然后利用这些信息来行动(在这个场景中,就是要找到一个安全且得体的地方排尿)的能力感到着迷。“于我而言,这真的是大脑干得漂亮的事例之一。”她说。
科学家曾认为,控制我们膀胱的是相对简单的反射,是一种能切换尿液储存与尿液释放的模式开关。“现在我们意识到,它比那复杂得多。”瓦伦蒂诺指出,她现在是美国国家药物滥用研究所神经科学与行为学部主任。一个复杂的神经网络参与了决策制定、社交互动和身体内部状态感知(也称为内感)等功能,也参与了这一过程的决策。
这个膀胱控制系统不仅复杂到令人费解,也很微妙。举个例子,科学家预测,超过十分之一的成年人患有膀胱过度活动症(OAB),这是一种常见的症状组合,包括尿急(即使膀胱未满也感觉需要小便)、夜尿症(晚上频繁起夜)和尿失禁。德国美因茨约翰内斯·古腾堡大学的药理学家、主攻膀胱疾病疗法的马丁·米歇尔(Martin Michel)说,尽管现有的治疗方法可以改善一些人的症状,但对许多人来说并不奏效。他还补充说,研发更好的药物已经被证实极富挑战性,以至于现在各大制药公司都已经放弃努力了。
不过,近期有一波新研究为这个领域带来了新的假设与治疗方法。尽管过去膀胱疾病的治疗都关注膀胱本身,但新的研究表明,大脑是另一个潜在的治疗靶点,瓦伦蒂诺介绍道。休斯敦贝勒医学院的微生物学家英迪拉·麦索雷卡(Indira Mysorekar)说,这些研究与旨在解释为什么某些群体(如绝经后的女性)更容易出现膀胱问题的研究相结合,表明我们不应简单地接受“尿失禁等症状是不可避免的”这一观点。我们常被告知这些问题(尤其对女性而言)只是衰老的一部分。“这在某种程度上是对的,”她说,“但许多常见的问题是可以避免的,并且可以成功治疗,我们不必生活在痛苦或不适中。”
微妙的平衡
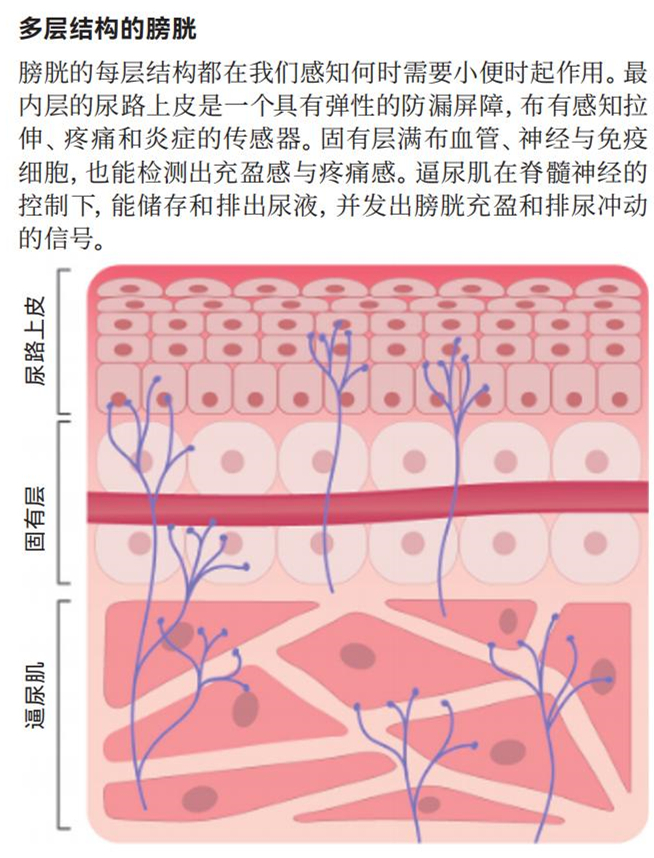
从最基本的角度来看,人类膀胱就是一个有弹性的袋子。大多数健康成人的尿容量是400至500毫升(约2杯),要充满至这样的容量极限,膀胱要经历人体所有器官中最极端的扩张之一,从其皱巴巴的空置状态扩张约六倍。
要扩张到这种程度,包裹膀胱的平滑肌壁(称为逼尿肌)必须放松。与此同时,环绕膀胱下端开口(尿道)的括约肌必须收缩,科学家将这个称为保护反射。
不管是正在蓄尿还是已经充盈,膀胱在超过95%的时间里都处于储存模式,这让我们在日常活动中不会漏尿。在某个时刻——理想情况是我们认为该小便的时候——膀胱就会从储存模式切换到释放模式。为此,逼尿肌必须强烈收缩以排出尿液,而尿道周围的括约肌要同时放松才能让尿液流出来。
一个世纪以来,生理学家们一直在努力拆解身体如何协调在储存和释放模式间相互切换的谜团。20世纪20年代,伦敦大学学院一位名叫弗雷德里克·巴灵顿(Frederick Barrington)的外科医生就试图在脑干(与脊髓相连的大脑最下方部分)中寻找这个开关。
不仅仅是感觉神经元可以检测到膀胱中的拉伸、压力、疼痛和其他感觉,其他类型的细胞,如形成尿路上皮抗尿液屏障的伞状细胞,也可以感知和响应机械力,例如,随着尿液充盈,膀胱扩张,三磷酸腺苷(ATP)这样的化学信号分子就会被释放
巴灵顿用电针在麻醉后的猫脑桥(脑干的部分结构,负责处理诸如睡眠和呼吸等重要功能)处轻微刺损不同区域。在猫恢复后,巴灵顿注意到有的猫会表现出想要小便的欲望——猫会抓挠、转圈或下蹲——但又无法自主排尿。与此同时,脑桥不同部位有损伤的猫似乎失去了感知小便需求的能力,会随机排尿,并且在每次排尿时都会显得受到了惊吓。显然,脑桥是小便功能重要的指挥中心,会告诉膀胱何时排尿。
超越巴灵顿氏核
巴灵顿的研究为我们目前理解控制膀胱的神经环路奠定了基础,但我们现在知道,远不止脑桥参与其中。
部分神经通路与脑区的简化版示意图,这些结构能让大多数健康人感知到膀胱充盈与否、预测还要等多久才能小便以及成功执行“憋住”或“释放”的计划。这种复杂双向的神经通信系统在任何阶段被干扰都可能导致膀胱功能失调,而这是全球数百万人都亲身体验过的
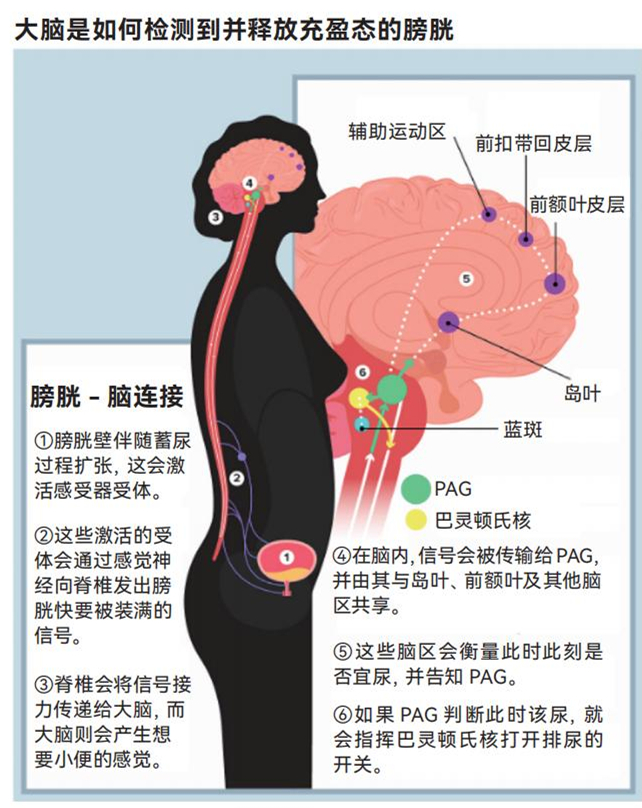
随着膀胱充满尿液,逼尿肌及膀胱壁内层的伸展感知细胞会把膀胱充盈的信号沿脊髓传递到脑干一处名为导水管周围灰质(PAG)的结构。接着,信号会传递到叫作岛叶的区域,岛叶扮演着类似传感器的角色:膀胱越满,岛叶中神经元发射的名为动作电位的微电脉冲就越多。
接下来,大脑中负责计划和决策的前额叶皮层会计算此刻是否是社交得体的小便时刻。如果答案是肯定的,前额叶皮层就会向导水管周围灰质发出信号,后者又向巴灵顿在猫身上识别出的脑桥特定区域发出清空膀胱的信号,这个特定区域如今被贴切地称为巴灵顿氏核,然后尿出来啦!
在过去的十年中,能为不同脑区如何联动绘制图谱的超精准工具让上述画面变得更加清晰。
瓦伦蒂诺课题组使用了一种可以同时监测和分析跨多处脑区、不同点位上神经元电活动的技术,并发现当膀胱达到一定的充盈水平时,脑干内蓝斑处的神经元会以稳定且有节奏的模式发射电信号。这种电活动会如潮水一般一波波扩散到大脑最外侧皮层处,并在排尿发生的30秒前唤醒大脑更警觉的状态。瓦伦蒂诺希望这样的观察可以为夜尿症和尿床等常见问题的治疗提供线索,不仅如此,这些观察也有助于解释大多数人都遇到的基本问题。
“我认为这是人在尿急时会醒来的主要原因之一,” 瓦伦蒂诺说道,“核心是在告诉你,‘不管你在做啥,停下,专注于尿尿’。”
学会憋尿
控制何时何地排尿的能力是需要花费时间来发展的,任何训练过蹒跚学步年龄段的小朋友学上厕所的人都能证实这一点。人在刚出生的时候,排尿并不由大脑主管,而是由当膀胱储尿达到一定容量后就会启动的脊髓反射来控制的。来自波士顿贝斯以色列女执事医学中心和哈佛医学院的神经科学家汉内克·沃斯特根(Hanneke Verstegen)说,只有在3岁或4岁左右,主管包括社交意识和决策等功能的脑区才会压制这一反射。
想要在人类婴儿的脑干中观察到这一过程如何展开是不可能的。但沃斯特根团队正在实验室繁育的小鼠幼崽身上研究类似的生理过程,并发现实验用小鼠在大约3至5周能获得排尿的自主控制能力。那时,幼鼠开始在指定的角落里尿尿——这个行为与进行如厕训练后的幼儿相似。有趣的是,我们在婴儿时期拥有的更原始、更自动的脊髓反射永远不会消失:当脊髓损伤到了在膀胱与大脑间传递信号的神经时,这一反射将会重新出现,常常会引发尿失禁或其他需要使用导尿管解决的问题。
脊髓损伤只是脑-膀胱通信失常的众多诱因之一。随着大脑衰老,向控制排尿区域输送并交换不同区域间信号的细长神经投射也会失去其完整性并扰乱正常的膀胱功能,这一过程在帕金森病和阿尔茨海默病中常会加速发展。
匹兹堡大学的医学物理学家贝姬·克拉克森(Becky Clarkson)及其团队通过使用功能性磁共振成像(fMRI)等神经成像工具来了解大脑控制排尿的“优雅”机制是如何失效的,该技术通过观测脑中血氧水平的波动来判断大脑哪些区域被激活了。“我们正试图弄清楚哪些通路可能发生了损伤。”她提到。“大脑是如何正常控制膀胱的?又是如何失去控制的?”
克拉克森的大多数研究被试都是超过60岁的女性,膀胱过度活动症在这一群体中的发病率最高。普通人中膀胱过度活跃的比例大约为11%,而超过45%的绝经后女性报告有相关症状。
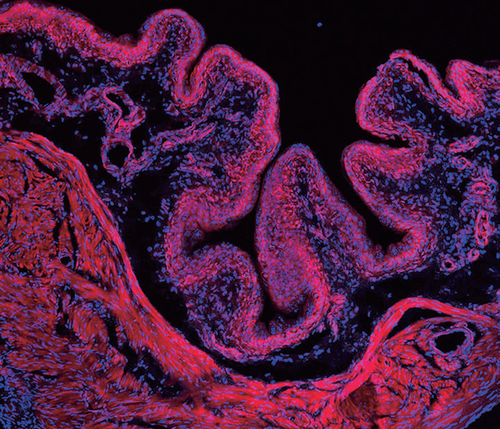
上图为小鼠膀胱壁切面照片。当膀胱空着或部分充盈时,它就满是褶皱。在人体中,这些额外的组织让膀胱的体积增加五或六倍,这是人体器官能做到的最大扩张之一
科学家不确定导致膀胱过度活动症的具体原因,也不知道为什么在老年女性中如此普遍。一些研究将关注点指向了膀胱自身的变化。例如,麦索雷卡发现,在绝经期间,免疫细胞会在女性膀胱内壁形成类似淋巴结的小团块。她说,这些病变增加了膀胱的敏感性,能让膀胱感知到哪怕极低水平的大肠杆菌的存在(大肠杆菌是导致大多数尿路感染的细菌,会引发慢性膀胱疼痛或膀胱过度活动症)。
导致女性和男性膀胱过度活动症的另一个主要原因是逼尿肌过度活动——膀胱肌肉的异常收缩会向大脑发送错误的“膀胱已胀满”信号。几乎所有的现有治疗方法都以抑制肌肉痉挛为目标。例如,临床最常用的一类药物——抗胆碱药物——就是用来阻断触发逼尿肌收缩的神经信号、名为乙酰胆碱的化学物质。
如果药物不起作用,临床医生通常建议通过注射肉毒杆菌毒素(也称为肉毒素)来减少逼尿肌的收缩。有时,医生还会通过手术植入物或放置在皮肤上的电极向脊髓神经传送电流,以此尝试恢复控制膀胱肌肉的脊髓神经的正常活动。
米歇尔说,所有这些旨在抑制逼尿肌的治疗方法都可能会产生它们不想要的副作用,包括在少数情况下会损害排尿能力。“就像在走钢丝,做得过了,你无法排尿;做得不够,储尿又有问题。”抗胆碱药物与认知能力下降的症状也有关系,尤其会出现在老年人群体中,这会引发安全性顾虑。并不是每个膀胱过度活动症患者都有过度活跃的逼尿肌,这促使一些科学家发问,是否对某些患者而言问题出在身体的其他地方,比如说大脑内部。
安全到家
如果你曾在工作一整天后回到家,刚打开前门就突然感到一种强烈甚至难以忍受的排尿冲动,那你就体会到了科学家早已知晓的存在于大脑与膀胱之间的紧密联系。这种冲动被称为“门锁尿失禁”,与膀胱有多满毫无关系,也不同于当我们打喷嚏、咳嗽或跳跃时无法控制尿液的情况(这种常见问题被称为压力性尿失禁,通常是由盆底肌无力造成的)。
一些科学家认为,膀胱过度活动症的紧迫感觉可能是条件反射,就像在19世纪90年代,俄国生理学家伊万·巴甫洛夫(Ivan Pavlov)训练狗将食物与节拍器的声音联系起来所产生的条件反射一样。克拉克森课题组假设,对于有的人来说,这种条件反射可能是多年来为了使用自己的洗手间所以都憋着等到回家再上厕所而形成的条件反射。对于其他人而言,它可能源于各种情况与触发因素(比如流水声)。这种强烈的感觉偶尔发生是正常的,但如果频繁出现,在研究人员看来就具有成为令人忧心的症状的潜质了。
克拉克森与其他研究团队发现,患有膀胱过度活动症的女性患者通常有着不同寻常的脑活动模式。在克拉克森实验室的一项经典实验中,研究被试平躺在功能性磁共振成像(fMRI)机器中,同时导管将液体注入膀胱,直到他们报告说感觉膀胱满了。技术人员移出部分液体,接着再注射填充,并将上述过程多次重复。
通过这种方法,克拉克森和其他研究人员建立了大脑如何控制膀胱的模型,而这一模型涉及了诸如处理膀胱满载信号的岛叶以及帮助判断此时此地是否宜尿的前额叶皮层等区域。额外的两个脑区——辅助运动区和前扣带回皮层——似乎共同合作来衡量尿意的紧急程度,并进行盆底肌收缩,这能帮我们把尿憋住直到找到厕所。这些脑区在一些膀胱过度活动症患者中更加活跃,可能导致即使膀胱只是部分充盈时也会有难以忍受的尿意。“我们认为这几乎像是一个弃船指令,” 克拉克森说,“当尿意袭来,你就得立马执行。”
几年前,克拉克森的一位同事指出,膀胱过度活动症的强烈尿意与戒烟者在某些情境中(如身处曾吸过烟的酒吧)所感受到的渴望感相似。受此启发,克拉克森与来自匹兹堡大学研究戒烟问题的研究员辛西娅·康克林(Cynthia Conklin)联手,采用戒烟研究中的一种方法来调查膀胱过度活动症女性患者对个人触发因素的反应。女性被试们会被展示能触发自己紧急感的地点照片,这些地点包括自家前门,或者对其中有位被试而言,塔吉特百货超市的入口。与“安全”照片相比,观看这些有触发因素的照片会增加与注意力、决策和膀胱控制相关的大脑区域的活跃度。
克拉克森介绍,某些行为疗法似乎可以帮助膀胱过度活动症女性患者对其紧急感触发因素做出更冷静的反应。例如,克拉克森团队的初步数据显示,像身体扫描冥想这样的正念技术可以减少膀胱感受强度。他们还发现,一种被称为经颅直流电刺激(tDCS)的非侵入性脑刺激方法可以缓解紧急感。
克拉克森课题组还研究了接受肉毒杆菌毒素治疗和盆底肌治疗有反应和没反应的女性脑活动有何不同,目前他们正在调查服用常规膀胱处方药是否会影响大脑对排尿的控制方式。
许多老年女性以及男性在寻求膀胱过度活动症的治疗方法时,已经在服用多种药物,其中包括最常见的膀胱药物——抗胆碱药。考虑到这种药物服用过多可能会导致认知问题,克拉克森希望将非药物治疗作为选项加入备选菜单,“如果我们能让人们不依赖药物,那就太好了”。
膀胱过度活动症产生的原因
大多数研究人员都一致认为,寻找更有效的膀胱过度活动症疗法的主要障碍是诊断的模糊性:膀胱过度活动症并不是单一的疾病,而是由一系列情况(包括帕金森病、脊髓损伤、糖尿病,甚至以上皆不是的情况)引发的症状集合。然而,威斯康星医学院的神经科学家阿伦·麦克尔(Aaron Mickle)说,这些病例通常被混为一谈,好似它们都是同一种疾病。
麦克尔正在研究不同情况会如何影响膀胱内层,即尿路上皮——一种柔软的、可自我更新的组织层,能通过拉伸和变平来适应膀胱体积的变化。尽管科学家曾认为尿路上皮是一种能使膀胱壁不透水的被动屏障,但现在已明确在感知膀胱充盈的信号中,尿路上皮起着关键作用。
尿路上皮如此敏感的一个原因是其自身的许多细胞含有多种机械门控离子通道——位于细胞膜上的蛋白质,实际上是物质进入细胞的通道。澳大利亚新南威尔士大学的生理学家凯特·普尔(Kate Poole)解释说,当细胞膜被拉伸、推挤或以其他方式发生形变时,这些通道会打开,允许带正电荷的离子进入细胞。普尔曾于2022年在《生理学年鉴》(Annual Review of Physiology?)上发表了一篇关于哺乳动物体内机械门控离子通道的文章。
延伸到尿路上皮的感觉神经元含有这些机械力感应离子通道。当这些神经中的正离子流达到一定阈值时,它们就会通过电脉冲直接与脊髓和大脑中的神经进行沟通。然而,尿路上皮中的非神经元细胞也含有多种机械力激活的离子通道,这表明它们也可以传递膀胱充盈的信号。
2023年,麦克尔使用光遗传学技术——一种通过激光束远程激活或抑制动物体内选定细胞的技术——选择性地刺激了这些尿路上皮非神经元细胞。这足以激活感觉神经元并触发膀胱收缩,也是研究人员首次做这样的尝试。最终,麦克尔希望能开发一种无线光遗传学系统,可以持续监测和调节人体中特定类型膀胱细胞的活动。(尽管光遗传学技术迄今主要用于实验动物,但研究人员正在探索其在人体中的应用。)
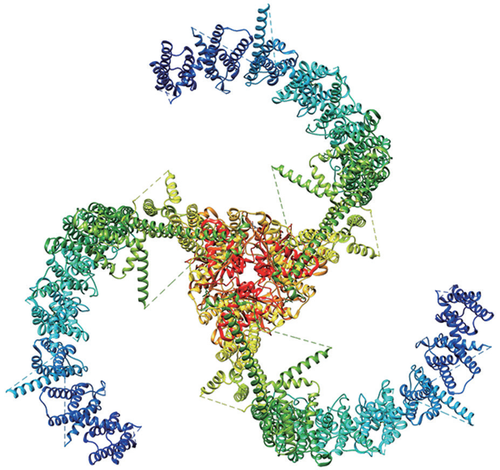
其他课题组正在研究将膀胱细胞中的机械力感应离子通道以及其他对各种神经信号化学物质和激素做出反应的通道作为药物靶点。这些通道包括一组被称为Piezo通道的螺旋桨形机械力感应蛋白,它们在膀胱感觉中起重要作用。2020年,刊登在《自然》(Nature)杂志上的一项研究表明,患有一种名为Piezo2的罕见基因突变疾病的人除了有其他类似行走困难等严重缺陷外,在感知膀胱充盈时也存在问题。有些人必须按照设定的时间表排尿,或者用力按压膀胱才能排尿。
一些科学家希望靶向Piezo2通道来治疗各种膀胱疾病。普尔指出,靶向这类通道的一个优点是它们“本身是可药物化的”,这意味着即使它们一般对机械刺激做出反应,研究人员通常也可以找到能打开或关闭它们的小分子。
但这也有一个缺点:就像研究人员曾经尝试过在膀胱中靶向的其他离子通道一样,Piezo2通道在身体各个部位都存在,包括肺、关节和心脏。因此,任何能影响膀胱中离子通道的药物也可能会影响身体的其他部位,引发安全问题。米歇尔指出,一种在膀胱中作用于另一类离子通道(允许钾离子进入细胞)的药物因为被发现会引发肝脏问题而在临床试验中被叫停。
在理论层面上,至少有一种方法可以克服这个障碍:专门靶向膀胱组织的基因疗法,原因在于这种疗法可以实现直接注射到逼尿肌或通过导管注入尿道。2023年,科学家公布了一项有67名患者参与、靶向膀胱钾离子通道的基因疗法的临床试验数据,尽管只是初步数据,却令人备受鼓舞。
图为在膀胱内发现的一种机械力感应蛋白通道,这种三叶螺旋桨形的Piezo2通道位于细胞膜中,会在感受到机械力(如拉伸和压力)时打开。最近,研究人员发现携有影响Piezo2功能的基因突变的小鼠与人类都存在排尿功能障碍,这包括感知膀胱充盈或充盈的能力减弱
尽管专注研究膀胱和尿道的科学家历来与研究脊髓和大脑的科学家分开工作,但如今这些长期分头行动的领域开始联通合作,把脑-膀胱难题的更多碎片拼到了一起。例如,麦克尔最近与一个神经影像实验室合作,该实验室将帮助他观察小鼠大脑如何在光遗传刺激其尿路上皮细胞时做出反应。
瓦伦蒂诺说,在过去,“我们从未关注过大脑”,但新研究“让我们能对这些其他靶子思考得更多”。
资料来源Knowable Magazine
————————
本文作者艾米丽·昂德伍德(Emily Underwood)是《可知杂志》(Knowable Magazine)的副编辑及其在线直播活动的制作人。撰写本文对她自己的小膀胱而言也是一个挑战