在病原体和宿主之间的进化军备竞赛中,被称为转座子的遗传因素常常发挥着细胞防御的攻击性武器之功效。

转座子构成了多达90%的玉米基因组,并导致玉米粒颜色的差异。这是造成多样性免疫防御体系的根本原因
研究人员现在意识到,遗传物质一旦简化为整齐的有机体包,就不仅限于个体,甚至物种――当包内的遗传物质转化为稳定的感染性病毒微粒后,可以将部分或全部基因导入宿主基因组,即使病毒本身已经离开,但残留物依然存在。在较小范围内,裸露的遗传因子如转座子(transposon)、细菌质粒或跳跃基因,经常穿梭般地往返于基因组之间,似乎整个生命历程就是由这种移动的转座子和其细胞宿主之间进行的一场连续不断的拔河比赛。
转座子遍及整个生物圈。在我们所研究的栖息地中,从海洋、土壤,再到人类肠道,可检测的病毒颗粒数(主要是噬菌体)至少超过细胞的十倍,甚至更多。此外,转座子及其残留物构成了很多生物体基因组的大部分――多达三分之二的人类基因组和接近于90%的植物,如玉米基因组。
尽管转座子普遍存在于不同的基因组中,但历来被视为无功能的垃圾DNA。从二十世纪中叶开始,通过植物遗传学家芭芭拉·麦克琳托克(Barbara McClintock)的开创性工作,并在其后的几十年中,科学家将研究范围从植物延伸到生物体,证明了转座子序列可以执行各种细胞功能,特别是对基因表达的调控。近期的研究表明,很多生物体也通过转座子在基因组之间移动或修改DNA序列。可见,无论是脊椎动物还是微生物,在适应性免疫进化中转座子的作用举足轻重。直到最近,还发现一种适应性免疫,即成簇的规律间隔的短回文重复序列(CRISPR-Cas)相关蛋白基因,已经引发了新一代的基因组改造工具的开发。
转座子与适应性免疫
就细胞的防御体系进化而言,几乎发生于包括从细菌到哺乳动物的所有生物体。但仔细研究后,就会发现其机制进化很大程度上依赖于转座子,而转座子本身就是宿主免疫防御的目标。
如同现实生活中的小偷盗取主人财产一样,寄生虫也会在离开或死亡前杀死它们的宿主,最终导致整个生态群落的崩溃,尽管宿主对此并非毫无防备。而免疫系统的多样性和复杂性是惊人的:其功能从直接的、非特异性的本能反应,到精心编排的适应性反应,范围极其广泛,包括在最初遭遇病原体攻击之后发生的适应性反应直至产生终身免疫记忆。
在过去二十年左右的时间里,越来越多的研究证明,几乎所有的生物体都拥有多个先天免疫机制。比如,大多数动物具有的Toll样受体(TLR)在遭到入侵时,能够从病原体中识别出保守因子并激活免疫系统中的恰当成分。而更古老且普遍存在的RNA干扰(RNAi),则是一种利用被称为小干扰RNA(siRNAs)作为介导的防御体系,以抵御入侵的主要为RNA病毒核酸。从概念上讲,小干扰RNA的生物学功能类似于Toll样受体,即本能的对多类别病原体作出免疫反应。
就原核生物而言,它自身固有的一套先天免疫机制在抵御入侵物的同时,其遗传物质甲基化酶会修饰相应的位点,以保护细胞自身DNA不被限制性内切酶破坏。这被称为限制修饰系统(RM)。如果遭遇大量病原体入侵,为防止其传播,大部分原核细胞会程序性死亡或休眠――被感染的细菌或古生菌激活毒素-抗毒素系统(TA),进而导致细胞休眠或死亡。
然而,很多病毒会对RM和TA进行编码。实际上这些病毒是一种独特的转座子,在利用RM方面,病毒与其原核宿主有着同样的目的:甲基化酶可以对病毒基因组修饰,内切酶则降解宿主细胞中被修饰的基因组,为病毒基因组的重新拷贝提供核苷酸。而TA能够确保细胞内质粒或病毒的存留。
至于毒素蛋白和抗毒素蛋白的区别,则在于细胞中蛋白水解酶对它们的影响不同:前者稳定,后者易变。若这两种基因在细胞分裂过程中丢失,抗毒素蛋白会迅速降解,剩余的毒素足以阻止细胞的合成,至少使其休眠。但如果转座子丢失了,一个在基因组中携带TA模块的质粒或病毒就会在被其激活的宿主中植入一个自毁机制(如图1所示)。
当转座子插入到宿主基因组时,通常会利用一个由转座子编码的重组酶(也称作整合酶或转座酶)对其进行修饰,确保转座子在宿主基因组内繁衍。然而,考虑到转座子在生命形式中无处不在,宿主肯定会通过一些自然进化的基因组工具达到自己的目的,而免疫记忆是这些工具中效用最明显的一个。现在看来,转座子及其重组酶对适应性免疫原核形式起源的关键贡献,也就不足为奇了。

左为转座子的伪色透射电子显微照片:这段DNA可以在染色体和基因组之间移动;右为大丽花的颜色差异是由转座子引发的突变造成的
关于免疫机制的假说
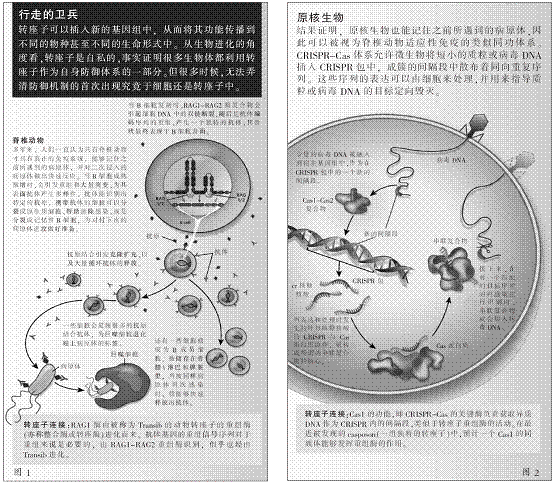
一直以来,原核生物被认为完全缺乏脊椎动物那种抵御寄生虫的适应性免疫。然而,该观点被研究者们以一种引人注目的方式推翻:即CRISPR-Cas以及基于RNA干扰(RNAi)的防御体系被发现存在于迄今被研究的大多数古生菌和细菌之中。2005年,西班牙阿利坎特大学的弗朗西斯科·莫佳卡(Francisco Mójica)、法国巴斯德研究所的达斯科·埃利希(Dusko Ehrlich)各自发现镶嵌在CRISPR之间的被称为间隔段的独特序列(与噬菌体或质粒基因组断片相同)。结合对Cas蛋白质的详细分析,上述这些发现使库宁(Koonin)及其团队于2006年提出,源于CRISPR-Cas起到一种原核适应性免疫的作用,加上CRISPR包(成簇的短小、直接重复序列)里储存的感染记忆在非重复性间隔段中穿插,由此产生了一个关于免疫机制的假说。
在随后进行的一系列研究与实验,都证实了这一假说,即CRISPR-Cas执行其功能的途径是:将外来噬菌体或质粒DNA断片整合到CRISPR包中,并通过这些独特间隔段的转录来指导RNA识别并断开重复入侵者的基因组(如图2所示),其关键特征有能力将有效的、特定的免疫代代传播。因此,CRISPR-Cas不仅是一种适应性免疫系统,而且是拉马克进化的一个真正机器,即环境的挑战,在这里就是由病毒或质粒直接造成基因组发生特定的变化,进而导致一种遗传后代的适应。
根据参与CRISPR转录处理和目标识别的Cas蛋白质群,大量关于基因组结构的比较研究都体现了CRISPR-Cas体系多样化的特征。比如,I型和III型体系采用由多个Cas蛋白质组成的复杂蛋白质复合物,II型体系则与一个被称为Cas9的单独的蛋白质发生反应。这些发现为开发新一代基因组编辑工具敞开了大门――众多实验室都在利用基于Cas9工具进行基因组工程开发。这比前CRISPR时代可用的方法更快、更灵活和更具多样化用途。
利用CRISPR似乎并不是人类独有的专利,病毒也在做同样的事情。例如,一个感染了致病性霍乱弧菌的噬菌体,会携带其自身的适应性来应对驻留在宿主基因组的另一个转座子――在噬菌体感染时,另一个转座子[即导致染色体岛状成分的噬菌体(PLE)]将自己从细胞基因组中切除,以抑制噬菌体繁衍。与此同时,CRISPR-Cas则以毁灭PLE作为目标,来确保噬菌体的成功繁衍。
因此,在原核生物中,所有防御系统似乎都是供出租的武器,为出价最高者服务。有时,不可能确切地知道,不同的防御机制究竟首次出现在细胞还是转座子中。
或有更多的拉马克机制
我们团队最新组织的证据也支持了CRISPR-Cas体系的转座子起源,即CRISPR-Cas的关键酶Cas1是负责获取外来DNA,然后将其插入CRISPR包中的间隔段。这与多样转座子重组酶活动有惊人的相似性,尽管Cas1不属于任何已知的重组酶科。但作为CRISPR-Cas系统的一个无所不在的成分,Cas1很可能对于CRISPR-Cas免疫的出现是至关重要的。
在最近一次对古生菌DNA暗物质(即测序基因组中成簇的非特征性基因)的探测中,我们意外地发现了一个新型的类转座子科,它对于Cas1的起源发挥着关键作用。这些之前未曾关注的转座子在其两个末端都有反向重复序列,就像其他转座子一样。但它们的基因含量是不寻常的,即存在于古生菌和细菌基因组中的新转座子是高度的多态化(不同的成员包含6到20个基因不等),其中只有两个保守的共享基因,其一负责对DNA聚合酶编码,表明这些转座子为自身复制提供关键的蛋白质。更令人惊喜的是另一个保守蛋白质,即Cas1的同族体,为CRISPR-Cas体系中的关键蛋白质。
与脊椎动物相比,适应性免疫在原核生物中的作用方式是完全不同的,在生命周期中,后者是基于对特定病原体T-和B-淋巴细胞抗原受体的获取。由于大多数免疫球蛋白受体是少数基因通过专门处理方式产生的,其过程被称为V(可变的)、D(多样性),和J(连接)片段(V(D)J)的重组和突变(如图3所示)。
与CRISPR-Cas相似的是,脊椎动物适应性免疫的起源似乎也有转座子的影子――V(D)J是由RAG1-RAG2重组酶复合物介导的(RAG1源于一个被称作Transib的独特的动物转座子群的重组酶)。而免疫球蛋白基因重组信号序列,则由RAG1-RAG2重组酶识别,至于V(D)J基因片段,似乎也经由Transib进化发育。
事实上,鉴于转座子是免疫系统的主要目标,原核Casposon中的CRISPR-Cas起源和脊椎动物Transib转座子V(D)J的重组看似是矛盾的。然而,考虑到转座子的无所不在和多样性,在生命历程中似乎有更多的拉马克机制(一种系统的生物进化学说)在指导着基因组的变化。
此外,对于基因组改造和其他所需实验工具的开发,免疫系统的基因处理能力提供了几乎无限的可能。几十年来,抗体作为蛋白质检测工具以及RM作为DNA分子的特异性片段化所具有的效力,对于生物学的发展至关重要。CRISPR-Cas系统最近已被添加到工具包中,可以说它是新一代最有前途的分子生物学的方法。至于生物体防御系统中很多未知的方面(特征也不明显),这对于基因组工程来说其中还隐藏着多少机会呢?
资料来源 The Scientist
责任编辑 则 鸣
――――――――
本文作者:尤金·库宁(Eugene Koonin),生物学家,就职于美国国家生物技术信息中心;马尔特·库珀维奇(Mart Krupovic),微生物学家,就职于法国巴斯德研究所。


