摘要 酵母是进行外源蛋白生产的很有吸引力的寄主。与原核系统不同,酵母具有真核亚细胞组织,能完成译后的各种折叠、加工和修饰过程,通过这些过程才能产生出“真实的”、有生物活性的哺乳动物蛋白。另外,它们还具有单细胞微生物的生长快速和遗传操作简便的优点。酵母表达工作的极大部分集中在已经充分研究过的酿酒酵母(Sacharomyes cerevisae)上。然而,随着DNA转化技术的发展,越来越多的非滚酒酵母正在成为生产重组多肽的宿主,其中包括:多形汉逊酵母(Hansenula polymorpha)、乳酸克鲁维酵母(Kluyveromyces lactis)、巴斯德毕赤酵母(Pichia pastoris)、粟酒裂植酵母(Schizosaccharomyces pombe)、西方许旺酵母(Schwanniomyces occidentals)和解脂亚罗酵母(Yarrowia lipolytica)。本文将综述以上替代酿酒酵母的酵母表达系统的性能,并讨论其优缺点。
早期在外源蛋白的商业生产上取得的成功是采用经充分研究的细菌——大肠杆菌作为宿主达到的。然而,由于表达的重组蛋白的性质越来越复杂,工业与学术机构实验室的科研人员开始探索其它有潜力的宿主系统。
酵母用作复杂蛋白的表达系统有若干长处。作为单细胞微生物,它像细菌系统一样易于操作和生长。另一方面,酵母又拥有真核亚细胞组织,能对许多哺乳动物蛋白进行准确的译后加工和修饰。
酵母分泌外源蛋白是通过一个多组分的分泌性细胞器进行的,在该细胞器中发生二硫键形成,激素原蛋白水解的成熟,N-、O-连接的糖基化,以及其它译后修饰。这对于外源蛋白的商品化生产尤为重要。此外,酵母应用于工业上的酿造和焙制工艺历经数百年,其大规模生长特性与代谢已获得充分研究。因此,用酵母表达重组蛋白常常是一种理想的选择,因为它既是高效率的生产方式,又能够恰当地译后修饰蛋白质。
酿酒酵母生产系统
用酵母生产重组蛋白大多是用酿酒酵母为宿主系统来表达的。选择这种生物主要是基于分子生物学家对它了如指掌,业已累积其遗传学和生理学的大量资料。已详尽描述过若干营养缺陷的标记,分离了强启动子,还鉴定了一种高拷贝数的细胞有丝分裂时稳定的质粒。此外,通过酿酒酵母在酿造和焙制工业上的应用,有大量资料说明它不愧为是“公认安全”的生物。
首次报道重组蛋白在酿酒酵母上表达是在1981年,第一个被FDA批准用于人体的遗传工程疫苗——乙型肝炎表面抗原就是用酿酒酵母生产的。在酿酒酵母中表达的其它一些外源蛋白也在进行临床前或临床实验甚至已投放市场。
然而,已发现酿酒酵母作为表达外'源蛋白的宿主存在某些局限。例如:产量通常较低,除了少数值得一提的例外,即使使用强启动子,外源蛋白产量最多也只占总蛋白量的1~5%。再者,由于合成克隆基因产物使细胞受到额外的压力,故采用自主复制表达质粒一般会导致生产过程中质粒稳定性降低。这个现象的后果是生长速度和产量的降低,总生产率下降。为了尽可能消除不利影响,常采用可诱导的质粒启动子,且控制产物合成的时间,使得酵母生长和克隆基因表达有某种程度的分开。然而,即使采用了可诱导启动子,质粒的稳定性仍显著降低,以致该表达系统很难放大到生产体积。当表达的产物对宿主有某种毒性时,质粒不稳定就尤为严重。除了放大生产有困难外,一些报道还指出酿酒酵母中分泌性糖蛋白的高糖基化,可能引起免疫原性的显著变化、活性的减弱以及血清中重组蛋白含量的降低。多种酿酒酵母分泌的蛋白不是游离于培养基中,而是以一种与细胞结合的形式保存于胞质周边的间隙里。这给纯化带来不便,降低纯化制品的产量。
已做了大量工作改进酿酒酵母表达系统,同时若干实验室却另辟新径,研究其它酵母宿主用于稳定而又大量地生产恰当修饰的重组蛋白。已鉴定和发展了一些非酿酒酵母,它们所具备的特点使之成为生产外源蛋白的有吸引力的系统。
替代系统
· 非酿酒酵母替代系统的选择 随着其它替代酵母表达系统的出现,人们能观察种种不同的酵母宿主,以发现适合于表达某种特异外源蛋白的特征。有了多种多样的表达系统,正确而又高效地生产某种蛋白的可能性就增加了。不言而喻,其中有些系统必定比酿酒酵母更适合于一定的重组蛋白的生产。
要开发一种替代的酵母宿主作为表达系统,第一步是发展一种细胞转化系统(包括将外源DNA转入细胞和转化子选择的方法)。已报道过的酵母转化系统至少有十几种,而且每年都在增加,但只有不多几种得到开发用于外源蛋白的商业水平表达。这些系统有:利用甲醇的巴斯德毕赤酵母和多形汉逊酵母、属于裂殖酵母的粟酒裂殖酵母、利用烷烃的解脂亚罗酵母,合成乳糖酶的乳酸克鲁弗氏酵母以及分解淀粉的西方许旺酵母。
对于一种在商业规模上成功应用的外源蛋白表达系统,除了外源DNA转化之外,其它一些因素也是必不可少的。这些因素包括:转录调节顺序(含终止区和促使产物高水平合成的合适启动子);对必需译后成熟的蛋白质有准确的高效率的加工能力;以及放大至生产体积的能力,即在大体积发酵罐中能维持外源DNA、被转化细胞的稳定生长和产率的恒定。
酵母细胞在商业水平体积的发酵罐中生长时,工业生产过程要求其遗传型稳定,且生长状况十分确定。上述替代酵母系统的一个共同特点是,它们起初都是为这种工业生产而发展的。除了粟酒裂殖酵母外,这些酵母并非实验室规模上深入研究的材料,所以用来发展蛋白生产系统的菌株仍然属于工业上一直成功应用的那些酵母。
· 替代酵母系统的蛋白质表达 根据近几年发表的研究结果,上面提到的每种替代酵母系统都可以看作是表达外源蛋白的有效宿主。但是,从已报道的利用每种替代系统进行高产表达的实例来看,显而易见其中有些酵母表达宿主的发展更快。属甲醇营养酵母的巴斯德毕赤酵母和多形汉逊酵母已成为20多种商品蛋白质的表达宿主,它们的产物包括非常复杂多样的蛋白质,如22腿乙肝表面抗原颗粒,小肽激素如表皮生长因子(EGF)和胰岛素样生长因子-1(IGF-1),以及工业用酶如葡萄糖淀粉酶、蔗糖酶和α-半乳糖苷酶。虽然其它替代宿主如解脂亚罗酵母、乳酸克鲁维酵母、西方许旺酵母和粟酒裂殖酵母较少用于外源蛋白的表达,但它们也已生产了同样广泛的工业与药理产品。现在,甲醇营养酵母可以认为是替代酿酒酵母进行商业性外源蛋白产品表达的研究得最充分的系统。
· 替代系统与酿酒酵母之间产率的比较 鉴于实验设计的差异,直接比较替代宿主与酿酒酵母之间的生产能力很困难。然而,在酿酒酵母上表达的一些蛋白也已用其它酵母进行表达,所以为了说明最普遍应用的宿主酿酒酵母的已知数据与多种替代系统的实验数据之间人们可能会遇到的某些差异,定性的比较仍是有用的。
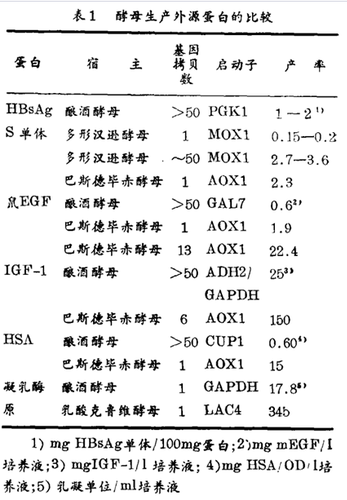
如前所述,过去酿酒酵母是作为乙肝疫苗商业生产的宿主得到发展的。现在也用甲醇营养的巴斯德毕赤酵母和多形汉逊酵母来表达HBsAgS抗原。(表1)含50拷贝HBsAg基因的多形汉逊酵母菌株其表达比含相同拷贝数的酿酒酵母宿主略高。多拷贝酿酒酵母宿主的表达水平与只含一个拷贝基因的巴斯德毕赤酵母可比拟。
对巴斯德毕赤酵母和酿酒酵母的表达还可以作其它比较。例如:两种酵母都被用作宿主表达鼠的EGF、人的两种蛋白质IGF-1和血清白蛋白(HSA)。无论何种蛋白质生产,两种酵母产率的比较显示巴斯德毕赤酵母的产量均高于酿酒酵母(表1)。这些结果表明,此种替代酵母宿主能像酿酒酵母一样有效地生产外源蛋白,而且随着基因拷贝数的增加 · 它的产率可以超过酿酒酵母。
还可对比一下凝乳酶原在酿酒酵母和乳酸克鲁弗酵母上的表达。凝乳酶原在这两种宿主中的产率的比较是通过含有整合的一个拷贝基因的菌株进行的(表1)。乳酸克鲁弗酵母凝乳酶原的总产量(细胞内加细胞外的)几乎等于酿酒酵母的20倍。乳酸克鲁弗酵母也被应用于IL-1β和HSA的表达。采用相同的信号肽顺序以及与报道的酿酒酵母相似的摇瓶培养条件,乳酸克鲁弗酵母IL-1β的产量为80 mg/l,而酿酒酵母只有1-2 mg/l。同样,乳酸克鲁弗酵母分泌的HSA产量超过酿酒酵母,而与巴斯德毕赤酵母的差不多。
对于表1所列的酿酒酵母和替代系统之间产量的差异,一个可能的解释为当使用的启动子来自糖酵解基因时,耗氧发酵过程中酒精的累积最终减少了酿酒酵母的产物产量。当表达产物对细胞有毒性,组成型启动子也有麻烦。如前所述,现在普遍使用调控型启动子来驱动外源蛋白在酿酒酵母中表达。被选来引发重组基因在非酿酒酵母系统中表达的启动子同样常常取自那些不受耗氧发酵产物抑制的高表达及严格调控的宿主基因。
· 替代系统中的调控型启动子 列于表1中的巴斯德毕赤酵母和多形汉逊酵母表达系统所采用的启动子的来源为编码甲醇耗用代谢时第一个酶的基因。在这两种宿主中甲醇能诱导HBs Ag的表达:当巴斯德毕赤酵母细胞在葡萄糖或甘油存在下生长时,AOX1启动子受阻遏;而对于多形汉逊酵母,葡萄糖存在时MOX启动子受阻遏,甘油存在时则解阻遏,表达量约达到诱导水平的四分之一。耗氧发酵时限量供给甲醇能达到醇氧化酶(天然AOX1产物)和外源蛋白在AOX1或MOX启动子的控制下很高水平的表达(表1)。
· 质粒稳定性 在西方许旺酵母上,是用GAM启动子表达外源蛋白,这种启动子受葡萄糖的严重抑制,而麦芽糖存在时又被诱导Q乳酸克鲁维酵母上LAC4控制的表达以及解脂亚罗酵母上XPR2控制的表达同样可通过培养基成分准确调节。除了产物合成的严密控制外,一个成功表达系统的另一必不可少的特性是生产菌株的稳定性。大多数酿酒酵母的表达载体以2μ质粒顺序为基础,在摇瓶培养时,其有丝分裂稳定性比含染色体ARS(自主复制顺序)的质粒高得多,但是在发酵的生产期仍存在质粒从细胞遗失的问题。
在乳酸克鲁弗酵母上,质粒和整合性表达构件均得到成功应用。利用从K. drosophilarum(其ARS为2μ样的复制原点)分离的多拷贝载体,获得了表达HSA和IL-1β的重组乳酸克鲁弗氏酵母菌株。据报道在非选择性条件下,摇瓶和中试规模培养生长时期此ARS都显示了良好的稳定性。
一些研究替代酵母表达系统的工作者业已提出了一些方法以便将多拷贝外源基因的表达构件稳定地整合进宿主的基因组中。由于采用的宿主细胞含整合的若干拷贝表达质粒,分泌性凝乳酶原的乳酸克鲁弗酵母生产系统(表1)曾放大到41,000升而无生产能力下降。 Siegel等和Vedvick等发展了用于巴斯德毕赤酵母的串连式重复表达构件(包括AOX1启动子——重组基因一一AOX1终止顺序)的载体。转化后,预定数目的基因拷贝通过这种载体整合在一个确定的位置上,因而在过程中可进行菌株的验证。Romanos提出了在硝基纤维素滤膜上原位裂解转化细胞的方法,以筛选发生过多次整合事件的巴斯德毕赤酵母转化子,Janowicz采用含弱ARS的质粒在多形汉逊酵母上完成达100拷贝的表达质粒的整合。通过采用可整合的表达载体,巴斯德毕赤酵母HBsAg表达系统从摇瓶放大到中试规模时每细胞的生产能力保持不变。利用同样的整合方法,牛溶菌酶的每细胞产量也在连续发酵过程中维持了恒定。
· 蛋白质分泌 除了采用调控型启动子的稳定性生产菌株外,一些替代酵母生产系统的另一个特点还在于蛋白的分泌。一般而论,在酿酒酵母上分子量超过30 KD的分泌性蛋白质会留在细胞内或胞浆周边空隙中,需要通过强烈的生化或物理手段使其释放。业已报道了一些蛋白质分泌效率高的突变型酿酒酵母,然而在许多情况下,它们仍然比不上野生型替代宿主的分泌水平。另外,酿酒酵母分泌的糖蛋白常常是过度糖基化的,每条连接的寡糖链可达100甘露糖单位。
非酿酒酵母表达的外源蛋白许多都是分泌性的。在许多情况下,这些蛋白都分泌进培养基中。在多形汉逊酵母上,从西方许旺酵母获得的150 KD葡萄糖淀粉酶分泌进培养基的浓度可达1.4 g/L。还是这种宿主,分泌到培养基的Cyamopsis tetragonoloba α-半乳糖苷酶超过90%。乳酸克鲁弗酵母分泌凝乳酶原的效率超过95%,与此相比,野生型酿酒酵母仅10%。同样地HSA和IL-1β也能有效地从乳酸克鲁弗酵母分泌。解脂亚罗酵母表达的人组织型血纤维蛋白溶酶原激活物、αl-干扰素、凝乳酶原和过敏毒素粟酒裂殖酵母表达的XⅢa 因子,以及西方许旺酵母表达的纤维素酶全都能分泌到培养基中。巴斯德毕赤酵母表达的蔗糖酶和HSA(两种蛋白均超过50 KD)都能有效地以超过1 g/l的水平分泌进培养基。
尽管用于比较的例子数目有限,但仍能说明穿过细胞壁分泌蛋白质是替代酵母宿主的共同特性,而酿酒酵母对这些蛋白的分泌程度却是变化不定的。
· 蛋白质糖基化 Grinna和Tschopp研究了由巴斯德毕赤酵母获得的糖蛋白的寡糖链,发现平均链长仅为Man8-14,而酿酒酵母的则达到Man>40。分析巴斯德毕赤酵母表达的蔴糖酶表明,其糖基化的程度类似于酿酒酵母sec 18突变种的蔗糖酶,此突变种的蛋白质从内质网向高尔基体的转移受阻断。这就导致每个N-连接的糖基化位点仅加入8个甘露糖残基。因而,野生型的巴斯德毕赤酵母不像野生型的酿酒酵母那样使分泌性蔗糖酶过度糖基化。另一种替代酵母系统西方许旺酵母也不能超糖基化分泌性蛋白。从这种酵母得到的天然糖蛋白其N-连接的碳水化合物仅占约10~15%。解脂亚罗酵母中分泌的组织型血纤维蛋白溶酶原激活物(tPA)只含有约8~10个甘露糖残基组成的寡糖短链。由此可见,若干种类的酵母其糖基化模式近似于哺乳动物高甘露糖类型的糖基化,而有别于酿酒酵母的糖基化。
替代宿主系统之间的糖基转移酶的活性也可以有差异。这一点可以从关于多形汉逊酵母表达的重组α-半乳糖苷酶的超糖基化的报道看出来。因此在选择酵母宿主前,有必要确定产物是否需要糖基化以及表达系统的特性。
· 译后加工 任何分泌系统的重要特征均是其对引导新生肽链进入内质网的N端信号顺序进行正确加工的能力。在非酿酒酵母系统上,分泌性重组蛋白的N-末端顺序一旦确定后,信号肽酶就能准确识别预定的裂解位点并有效地发生酶解。
酿酒酵母也具有一种二元的肽内切酶,即Kex2基因产物Kex2(yscF),此酶在高尔基体中。Kex2的蛋白水解作用使性外激素α-因子成熟。它与酿酒酵母的α因子导向顺序一起用于酿酒酵母上,引导外源小肽如EGF和IGF-1的分泌。巴斯德毕赤酵母同样有类似于Kex2的二元肽内切酶活性物,已证明采用酿酒酵母的α因子导向顺序也能使巴斯德毕赤酵母有效地分泌小肽。另外,已发现巴斯德毕赤酵母细胞不同于酿酒酵母,含有若干高尔基体,所以这种酵母可作为重要的模式,以进一步研究分泌通道的各种组分是怎样组装成的。
已经观察到在多形汉逊酵母上与HSA融合的α-因子导向顺序受到正确加工。在解脂亚罗酵母上,Kex2样活性物能准确加工一种碱性胞外蛋白酶导向肽,使后者从tPA、凝乳酶原及过敏毒素C5a上脱下。再者,由于采用了酿酒酵母的α因子导向肽,乳酸克鲁维酵母能有效地分泌凝乳酶原。考虑到野生型乳酸克鲁维酵母能编码具有α-因子活性及二元肽内切酶活性的蛋白质,这些资料表明其它替代酵母系统适用于小肽的分泌。
我们的结论是,各种替代的酵母是现有的蛋^质生产表达系统之外的有价值的选择。我们有足够的理由相信,本文所讨论的这些酵母的特性将会使这种微生物在重组蛋白的商业规模生产中占有十分明确的地位。
[Bio/technology,1991年11月]