
为了开发灵丹妙药,一些制药公司不惜投入大量资源遍地找寻。然而,只需把我们的视界停留在自身的肠道内,那儿有数千种不断产生和释放生物活性分子的细菌――制药公司赖以生存的由不同化学成分组成的小分子混合物。比较典型是高级生物体内的类固醇与肽类激素,其中蕴含着许多重要的生物学功能。
早在1905年,英国生理学家欧内斯特·斯塔林(Ernest Starling)为了描述身体器官或腺体内产生的化学信号提出了激素一词,这些信号能影响其他器官并引发生理反应。在人体中,小分子激素的重要功能包括调控免疫系统、性征发育、应激反应、新陈代谢以及矿物质平衡等。
细菌的群体效应
显微镜下的肠道微生物群落分布示意图
我们对生物活性小分子的大部分了解都出于对哺乳动物与植物激素的研究,人们已经知道,细菌不仅能产生和感应多种小分子信号,还能对这些信号做出反应。亚历山大·托马什(Alexander Tomasz,洛克菲勒大学教授――译者注)对肺炎链球菌(Streptococcus pneumoniae)外源DNA的提取与整合,以及约翰·W·黑斯廷斯(John Woodland Hastings,哈佛大学教授――译者注)对费氏弧菌(Vibrio fischeri)发光的研究让人们第一次意识到扩散性分子在微生物的生命周期中充当了重要角色。
接下来数十年的研究结果揭示,这些类似激素的化合物是由处于基态的细菌产生的(产生量随细菌数量的增加而增加)。托马什与黑斯廷斯的团队均发现,在达到一定浓度后,这些小分子能调节外源DNA的整合和发光量,但上述活动只对群体才有效(细菌个体也能摄取DNA,但群体摄取DNA时的遗传多样性更大,这样更能增加个体幸存的机率)。虽然这些发现未得到完全认可――不清楚这种行为是否在所有的细菌上都存在――但已经奠定了细菌通信研究的基础。细菌利用小分子化合物与同种细菌的其他个体,或其他种类的细菌以及宿主间通信,这一观点已得到广泛认同。因为这一现象决定于细菌密度的一个阈值,细菌通信又被称作“群体感应”(quorum sensing)。
细菌化学通信的方式多种多样,新的生物活性分子接连不断地被发现,但我们对这些分子的了解却很有限。研究人员主要利用在实验室生长的、纯培养的微生物来研究细菌信号传导。在自然环境中,一种细菌会同其他多种细菌共同生活在宿主体内,它们之间会表现出竞争和合作关系,这与实验室环境是不同的。
一个最显著的例子便是根瘤菌与豆科植物间的共生关系,许多化学信号促进了这种互利关系的建立。例如,发育中的植物根部会渗出类黄酮[flavonoid,植物的一类次生代谢产物,它以结合态(黄酮苷)或自由态(黄酮苷元)的形式存在于水果、蔬菜、豆类和茶叶等食源性植物中――译者注],诱使周围的根瘤菌向根部表面迁移,促成了酰化高丝氨酸内酯(acyl-homoserine lactones)的产生并导致群体效应的出现(根瘤菌结瘤因子作用于根部),最终实现了这种内共生关系。自然界中存在许多复杂的微生物种群,毫无疑问,微生物信号传导又在这些群体中起到了重要作用。虽然关于土壤化学信号传导的研究已经比较多了,但在微生物信号传导领域仍有大量工作要做。
在高浓度下,细菌信号还能起到抗菌作用。一般来说,当浓度没有高到影响自身生长时,细菌会起到抗生素的作用。此时,这些化合物的主要功能很可能是调节基因的表达而非毒害细菌群体。小分子化合物在生物学系统中的作用已经被研究得较多了,对从细菌和其他生物体中提取的化合物的研究还提供了这一额外的信息。只要有可能,人类就会将这些天然产物用作对疾病的治疗,经典的例子就是青霉素的发现。除了抗生素,天然产物还被用作抗癌与消炎药物。许多药物都是从微生物中分离出来的,还有一些是从植物和海洋生物中提取的。由于人体是由复杂的生态系统组成的,这一发现暗示着,人体也可能成为生物活性分子的来源之一。
埋藏在人体内的宝藏
从一出生开始,人体就被各种复杂的微生物群落所拓殖。这些群落是在生命的头一年里建立的,它们被称为微生物丛(microbiota)、微生物群落(microflora)或微生物组(microbiome)。人体内的微生物群落非常丰富,近1014的细胞对我们的健康十分重要,它们在人类的皮肤、胃肠、泌尿生殖器和呼吸道上繁衍生息。研究人员估计,人体内的微生物基因总量超出了人体基因的100倍,这意味着人类基因组主要由原核生物基因组构成。
虽然我们身体的几乎每一个表面都暴露在环境微生物面前,但到目前为止,胃肠道仍是微生物繁衍最多的地方。在人体肠道内已经确认有1100多种细菌存在;每个人的肠道内至少有160种细菌,其中仅1/10是人体共有的。这为微生物-微生物以及宿主-微生物间的协同进化提供了很好的机会,其相互间的关系很多是通过小信号分子的活动传递的。
人们知道,共栖的有机体是通过扩散性信号与它们的宿主相互作用的。而人类胃肠微生物群主要成员之一的多形拟杆菌(Bacteroides thetaiotaomicron)可以产生控制宿主基因表达的信号,这样细菌就能使营养的供应利于自己的生长。最近有研究发现,肠道共栖菌与病原菌之间的通信会产生一种有待确定的信号,这种信号通过出血性大肠杆菌控制毒性因子的产生。那么,包括多形拟杆菌在内的其他细菌是否也是哺乳动物用于控制毒性细菌感染的一种手段呢?
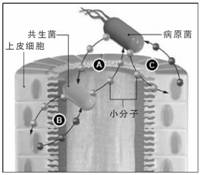
这些关系并不总是由微生物群发起的。宿主产生的小分子也能同时对共栖菌产生显著影响。有研究表明,两种哺乳动物应激激素(肾上腺素与正肾上腺素)会影响胃肠道内的共栖微生物种群。虽然其中的机制还不清楚,但这些激素确实促进了人类微生物组中某些特定种类细菌的生长。除了正常的生理学作用,这些应激激素还能通过入侵病原体影响其毒性因子的产生。例如,通过感知肠道肾上腺素与正肾上腺素,出血性大肠杆菌激活了其主要的毒性因子III型分泌系统的产生。同样,正肾上腺素能增加空肠弯曲杆菌(Campylobacter jejuni,经常引起食物中毒)进入宿主细胞的能力。
最近几年关于人类微生物群的数据在不断积累,有新证据暗示,微生物群落的作用并不总是局部的。微生物群落对宿主组织与器官施加的影响,其范围远超出肠道之外。例如,肠道内的共栖菌数量与相邻器官中的其他疾病如糖尿病、哮喘、肥胖、癌症、自闭症甚至抑郁症都有关系。尽管这些器官与肠道共栖菌没有直接联系,但这暗示了可能是化学信号在起作用。又如,有人很久以前就怀疑抗生素的使用可能与变态反应疾病有关,认为这可能是肠道微生物群落在作怪。
微生物与人体免疫系统之间的相互作用在产生病理反应时固然起到了重要作用,但深层次的原因是否是肠道微生物群落以一种更一般的机制影响着代谢系统。最近,斯克利普斯研究所的威廉·维科夫(William Wikoff)和同事发现,肠道微生物对哺乳动物血液代谢物有显著影响,尤其与氨基酸代谢有关的代谢物关联密切,暗示了肠道微生物对人体的影响主要取决于小分子的活动。虽然其中一些影响可能是由微生物信号直接引起的,包括其他肠道细菌引发的信号传导机制也可能发挥了作用。
哺乳动物的肠道在排泄废物方面发挥着重要作用。由于这些废物产生过程的存在,许多宿主产生的小分子代谢物就在肠道内循环。胃肠道内的其他小分子如激素、胆汁酸不仅对自身产生重要影响,同时还能通过再吸收过程影响其他器官。也就是说,有潜在生物活性的小分子不一定是微生物群落产生的,还可能出自我们体内的废物。
一些小分子是由宿主和微生物产生的,它们在维持宿主与共栖菌关系平衡上发挥了重要功能。因为这些小分子对人类健康意义重大,具有被开发成维持或重建人体内平衡以及预防或治疗疾病的潜能,尤其是肠道有可能成为新的抗生素的来源。人们知道,微生物群落在哺乳动物免疫系统的成熟过程中起到的重要作用,那么,肠道内的小分子能否以可控的方式调节这种关系呢?一种大胆的设想是,利用这些小分子来操纵体内器官和生物学系统的生理机能――通过一些能抗击特定疾病的微生物来产生相应的小分子,反之,这些小分子又可以用来预防或治疗疾病。
离药物开发还很遥远
这一设想的应用前景虽然诱人,但还需要进行更为细致的研究。这种活性小分子潜在来源的局限性在于,哺乳动物肠道中的大部分微生物目前不能在实验室环境中培养。满足细菌的理想生长条件并非易事,人们被迫利用一些非培养方法研究人体内的微生物群落。
从系统的观点来看,尽管这些工作需要利用宏基因组学(metagenomics)或是DNA片段无偏测序来完成,因为这样可以确定一个给定样本是由哪些微生物组成的,但却无助于说明产生的化合物的功能或细菌间的相互作用。在分析肠道宏基因组(胃肠道所有基因的组合)的基础上,我们可以预言:许多生物学反应还有待发现。近来,研究人员还利用其他非培养方法如宏转录组学(metatranscriptomics)和宏蛋白质组学(metaproteomics)研究了肠道环境,然而这两种方法分别需要对信使RNA和蛋白质进行无偏分析。关于哺乳动物肠道内微生物群落的大量相关信息,直到最近我们才开始解释这些群落的分子功能。
由于最近在化学分离与结构分析技术方面的进步,特别是复杂样本高通量分析方法的出现,使我们拥有了重要的分析工具。其中一项技术是傅里叶变换离子回旋共振质谱分析技术(FTICR-MS),这项技术已被首次用于哺乳动物宏基因组的高通量分析。FTICR-MS能用于复杂样本中数千种小分子的快速检测与相对定量分析,是一项极为敏感和精确的技术――在哺乳动物肠道宏基因组的研究中,发现了肠道中有数千种小分子。有趣的是,大部分小分子的含量在经抗生素处理后会发生变化,暗示了肠道微生物群落不仅可以调节肠腔的化学组分,而且通过对这些化学组分变化的分析还可以解释特定的病理状态。
目前,肠道小分子用于开发潜在的新药只是一个美好的设想,离现实还很遥远。尽管这些“组学”类的研究很有启发意义,但仍需要在基本的实验室环境下接受考验,包括剔除一些特定的宿主-微生物之间的相互作用――动物模型下的单分子(天然或人工合成)实验可以验证一些假说。从中,不仅可以考察机体的健康状态,还可以看到病理状态是怎样维持或修复的。
DNA、RNA与蛋白质是生命核心这一点无可辩驳。然而,生物体的功能不仅取决的于这些分子,多数情况下还与多级代谢途径的末端产物有关。也就是说,大多数时候小分子才是生物学功能的关键。虽然还有其他一些生物活性分子源也不容忽视,但我们必须注意到人体肠道就是一个小分子聚宝盆――这些小分子在与人类及其他微生物伙伴多年的协同进化中已经特异化了。认识这些小分子,不仅有助于我们理解代谢途径的功能与它们(指小分子)间的相互关系以及复杂的生物学系统,还可以帮助我们更好地理解生命分子的复杂性。就这点而言,我们不能仅仅从知识的角度看待这项研究的意义,还应该从实际的角度看到这些分子会给我们带来什么。
资料来源 The Scientist
责任编辑 则 鸣