近年来,纳米生物医学已成为生物学、医学、材料学等多学科综合交叉领域的前沿和热点。其中,诊疗纳米医学是纳米生物医学研究领域中一个新兴的重要分支,这种以多功能纳米结构材料(简称纳米诊疗剂)构建的集医学疾病诊断和原位治疗于一体的新技术,将提供一个集早期实时监测、定位诊断与个性化干预于一体的诊疗系统,有望在未来人类重大疾病的诊断和治疗中发挥重要作用。
基于稀土化合物的上转换发光纳米颗粒(UCNPs)作为一种新型的多功能纳米诊疗剂,具有近红外光激发、上转换发光(UCL)成像、磁共振成像(MRI)等功能优势,在肿瘤的多模式影像诊断和高效治疗中的应用基础研究备受关注。笔者所在的课题组长期从事无机功能纳米材料的化学制备及生物学应用研究,近三年,笔者主要围绕如何实现癌症的高效诊断和治疗这一主题,开展了一系列研究探索,在基于UCNPs的新型高性能多功能肿瘤诊疗剂研究中取得了一系列重要创新进展。
新型多模式医用造影剂
非侵入性的疾病成像模式在肿瘤诊断、疗效评估、转移监控等许多方面具有重要作用。然而任何一种成像模式都不是完美的,不同成像技术原理不同,反应信息各有侧重,具有各自的优缺点。因此,开发一种集多重成像模式且具备理想的高空间分辨率和高灵敏度的探针(造影剂),在未来疾病诊断和监控,尤其是癌症早期诊断上具有重要意义。UCNPs是一类具有诱人前景的发光成像造影剂,若对其进行适当离子掺杂或与其他功能性物质联合,有望形成功能强大的双模式或多模式成像探针,对一些特定疾病的早期诊断具有重要意义。
基于此,笔者对基于UCNPs的新型多模式医用影像造影剂进行了系统研究。首先,针对如何提高钆掺杂造影剂(Gd-UCNPs)的UCL/MRI双模式成像性能,我们构建了具有不同体相钆和表面钆分布密度的三种结构模型,澄清了体相钆和表面钆在T1-MRI性能上的争议,并首次提出了在无机Gd-UCNPs造影剂中UCL和MRI两种成像模式存在着“正负晶格屏蔽效应”(Adv.Funct.Mater.2011,21,4285-4294)。在此基础上,通过构建多种表面修饰的Gd-UCNPs,进一步阐明了无机Gd-UCNPs造影剂的T1-MRI机理,在该机理指导下,通过同时优化Gd-UCNPs内核结构以及表面修饰,获得了目前基于该类材料报道的最高r1值(14.73 mM-1s-1);同时,证实了所制备的Gd-UCNPs纳米探针在小鼠活体内具有优异的UCL/T1-MR双模式成像功能(Adv.Funct.Mater.2013,23,298-307)。
在此基础上,我们系统开展了基于UCNPs的肿瘤多模式造影剂及其生物学效应研究。综合考虑不同成像模式在空间分辨率、成像深度和应用领域中各自的优势,借助于金颗粒(Au)的高X射线衰减吸收系数,将粒径1-2 nm的Au纳米颗粒嫁接于NaYF4:Yb/Gd/Er/Tm SiO2表面,形成“芝麻球”状的多模式成像探针,在小鼠肿瘤区域成功实现了UCL/MR/CT多模式成像诊断(Biomaterials 2012,33,1079-1089)。
为了提高探针的多模式成像性能和生物相容性,我们进一步发展了NaYF4:Yb/Er/Tm NaGdF4 TaOx核壳结构纳米探针,TaOx外壳不仅提供优异的生物相容性,而且TaOx本身即是优良的CT成像造影剂(Biomaterials 2012,33,7530-7539)。为了进一步考察多模式探针在活体内的分布、代谢及组织毒性等,我们设计和制备了Yb-UCNPs多功能纳米探针(NaYbF4:Tm),该探针无需任何功能化即可实现高的上转换发光和CT成像性能(比临床用碘剂提高一倍);系统研究其在体内的分布、代谢及组织毒性后发现,该纳米探针具有良好的生物相容性(Biomaterials 2012,33,5384-5393)。
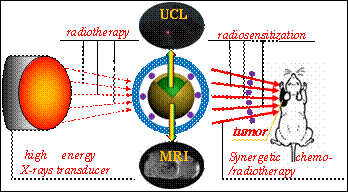
新型多功能肿瘤诊疗剂
在传统临床医学中,肿瘤的诊断和治疗是两个相对独立的过程,用于肿瘤诊断的造影剂和用于肿瘤治疗的抗癌药物也是两种独立的制剂。这种情况下,患者往往需要先接受诊断,再接受治疗,而且两者时间间隔较长,容易贻误肿瘤治疗的最佳时期。近年来,研究人员发展了一种全新的肿瘤处理方式――诊断治疗学――即将肿瘤诊断和治疗两个过程合二为一,用于诊断治疗学的试剂被称为诊断治疗制剂(简称诊疗剂)。笔者在基于UCNPs的多模式造影剂的基础上,又系统研究了多种基于UCNPs的多功能诊疗剂在肿瘤化疗、放疗及多模式联合协同治疗上的应用。
临床医学中,化疗是用于治疗肿瘤常用的方法之一。纳米诊疗剂在化疗中的成功应用有效避免了自由药物带来的全身毒副作用,但传统的纳米诊疗剂携带的抗癌药物需要从细胞质扩散至细胞核,且效率极低,所以化疗效果并不理想。如果能使诊疗剂直接进入细胞核,抗癌药物直接在靶点细胞核释放,将显著提高治疗效果。在细胞核直接给药的同时,如能进行实时成像将有助于监控化疗效果。
基于此,笔者设计了一种兼具宫颈癌高效细胞核直接给药和实时MRI/UCL双模式成像的UCNPs基多功能纳米诊疗剂。首先,选用具有UCNPs作为双模式成像探针,然后对探针进行PEG表面改性赋予其生物相容性,同时PEG层可担载抗癌药物分子;最后通过高效的生物分子偶联技术,对纳米诊疗剂进行宫颈癌细胞核特异性靶向配体的嫁接,赋予其宫颈癌细胞核高效主动靶向性。这种新型纳米诊疗体系可以将破坏DNA结构的抗癌药物直接输送至细胞核中的靶点周围,显著提高了药物的利用度及疗效(Biomaterials 2012,33,7282-7290)。
在此基础上,为了使化疗药物可控释放,并降低其在生物体内的毒副作用,我们发展了具有近红外光(NIR)光控药物释放功能的多功能纳米诊疗剂:首先合成偶氮苯类化合物,并通过-Si-O-键将该分子的一端固定于介孔壁;其次将在980 nm激发下发射紫外和可见光的UCNPs嵌入至介孔二氧化硅中形成核壳结构;980 nm照射下,介孔内的偶氮分子在UCNPs发出的上转换紫外和可见光的作用下,发生快速、稳定、连续的光异构化运动(旋转-翻转运动),从而实现控制介孔孔道内抗癌药物阿霉素分子的释放速率,达到阿霉素的可控快速释放的目的(Angew.Chem.Int.Ed.2013,52,4375-4379)。
放疗也是临床医学中用于肿瘤治疗的常规手段之一。放疗没有手术治疗那样强的入侵性,更没有化疗全身毒副作用,在剂量安全范围之内可以有效杀死异常增殖的癌肿,同时机体又再次尽可能发挥最大的调节功能。但是,放疗也有明显的弊端,如放疗对乏氧细胞和肿瘤细胞群中的S期细胞的杀伤作用不明显,易造成残余肿瘤细胞的转移及肿瘤的复发。单纯依靠提高放射剂量又容易对人体造成极大伤害,因此,如何通过低放射剂量达到较显著的放疗效果,是放疗领域面临的一个巨大挑战。
为了解决这一问题,笔者尝试采用放疗剂量增强效应和混合增强效应两种技术,以期提高治疗效果。针对剂量增强效应,我们设计了一种基于双重金属的UCL/CT双模式探针(BaYbF5:Er/Tm),该探针具有体内血液半衰期长、CT造影成像性能优异的特点,并具有高效主动靶向胶质瘤的CT成像性能。借助于探针中高原子序数元素Ba和Yb对X射线的光电效应以及电子对效应,使探针周围的光电子、自由基和X射线的剂量得到有效增加,从而实现了活体肿瘤区域的放射治疗增敏,显著提高了放疗效果(Scientific Reports,2013,DOI:10.1038/srep01751)。
如上所述,在临床医学中,由于单一化疗和放疗均存在自身不可避免的缺点,因此,化/放疗协同疗法成为肿瘤治疗手段中的首选技术之一。在众多化疗药物中,顺铂属于细胞周期非特异性药物,近期研究表明其具有放疗增敏作用,但因其全身用药后毒副作用大、瘤体内浓度低,使全身大剂量化疗及同步放疗综合治疗方案的应用受到限制。为了解决这个问题,我们将顺铂装载于多功能纳米诊疗剂中,使其应用于放疗增敏以及协同发挥化疗和放疗的功效:内核钆掺杂上转换发光纳米颗粒Gd-UCNP可作为MRI/UCL双模式成像造影剂,较高的成像灵敏度和空间分辨率将有助于提高肿瘤的早期确诊率;空腔结构的引入可实现抗癌药物(顺铂)的高效装载;顺铂作为化疗药物杀死肿瘤细胞的同时,还可作为放疗增敏剂用于增强乏氧肿瘤对X射线的敏感性,这种放/化协同治疗效果明显优于任何一种单一模式或两种单一模式的加和治疗效果,从而达到协同高效治疗的目的(J.Am.Chem.Soc.2013,135(17),6494-6503)。
结束语
基于UCNPs的新型多功能纳米诊疗剂的研究,是近年来十分热门的一个研究方向,具有诱人的应用前景。在未来可预见的五年内,将迎来基于UCNPs的新型多功能纳米诊疗剂在活体多模式成像和诊疗上的更多新进展。其中,基于UCNPs的靶向结构设计、更多模式的高效引入、活体分布的调控、干细胞的示踪、纳米毒理学的深入评价等均将获得新的进展。纳米医学材料的研究最终需要服务社会,作为一种潜力巨大的多功能诊疗剂,UCNPs基诊疗剂自身临床转化的研究将受到更多的重视,并有望在未来肿瘤高效诊疗中发挥重要作用。
致谢:本研究工作得到了国家自然科学基金、上海市启明星跟踪计划、上海市“科技创新行动计划”纳米科技专项和上海市人才发展资金的支持。
本文作者步文博来自中国科学院上海硅酸盐研究所
责任编辑 则 鸣

