将人类大脑类器官移植到小鼠大脑后,类器官发育出了血管并融入神经元网络内部。
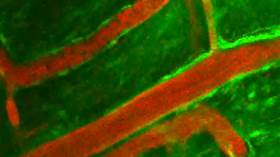
在移植到活鼠大脑的人类大脑类器官内,血液流过新生长的血管
研究人员在《自然-生物技术》杂志2018年第4期上提出:小鼠大脑成为人类大脑类器官的良好生长地。
大脑类器官,也就是所谓的“迷你大脑”,是从干细胞中生长出来的微小大脑细胞丛,正在被研究人员用来研究自闭症和其他神经疾病的神经基础。但是,这些类器官在培养物中通常只能生长数月就会死去,这大大限制了其作为真实大脑模型的有用性。新的研究报告指出,将三维结构的人类大脑组织移植入小鼠大脑后,类器官持续发育,生长出维持生命的血管和新的神经连接。这项研究工作推进了应用大脑类器官来研究人类大脑发育和疾病等复杂问题,这些问题难以用目前技术进行研究。科学家展望,大脑类器官移植甚至可能有朝一日为创伤性大脑损伤或中风提供治疗方案。
生命的存在(至少)是三维的。通过黏附在硬塑料培养皿上的扁平细胞研究生命的分子和细胞基础,可以揭示生物学的一些奥秘,但也仅此而已。最近,科学家在他们的工具箱内增添了一种靓丽的新工具:模拟体内组织的三维多细胞干细胞衍生结构或类器官。鉴于类器官(作为工具)在探索人类生物学和疾病方面的巨大潜能,被《自然-方法》杂志评为2017年的年度方法。
类器官不是全新的工具,而是不断发展的工具;对细胞和器官碎片的三维培养毕竟是古老的学科。直到最近,一方面哺乳动物发育和组织稳态的知识,另一方面是胞外基质生物学的发展,再结合干细胞培养的经验,使得干细胞及其衍生物的奇妙自组织特性在人类组织的外体模型上成为现实。类器官模型已经涵盖许多器官:大脑、肝脏、肾脏、乳腺、视网膜和胃肠道等。
这些类器官的潜在应用是多方面的。类器官是产前发育和组织维护的明显模型,否则,在人体内进行相关研究是非常艰难的过程。类器官也为研究许多生物学进程提供了人体组织的来源,例如,近期的研究报道了活的人体(大脑)组织内中间神经元迁移的首次观察。类器官正在用于建立疾病模型,包括传染病(如寨卡病毒感染)、单基因疾病(如囊性纤维化)和复杂疾病(如癌症)。从更广义的角度来看,因为启动干细胞可以进行编辑以携带某种遗传变异,或者可以从许多遗传背景衍生而来,这些干细胞为检查基因的表型结果提供了强大模型,甚至可用于研究进化问题,对人与猿的组织进行比较研究。有文献报道和讨论了使用衍生于干细胞的大脑类器官来模拟大脑这种最复杂器官的前景与挑战。
作为研究工具,类器官最强大的特点之一是:类器官可以同其他前沿方法协同发挥作用。例如,成像技术在过去的10年里已经取得了巨大进步,特别是在它能够以更快的速度捕捉生物和足够温和而不破坏样本。有文献讨论了成人干细胞衍生的类器官成像(固定或活组织中、小规模或高通量)如何增加我们对人类生物学的理解,尤其是癌症。
类器官包含的细胞类型令人印象深刻,例如肾脏类器官,已经有报道它们至少有10种真实复杂的结构。但是,正如人们对体外结构所预期的那样,类器官就细胞类型表现、结构和功能成熟度而言还不是完美的模型,这些模型需要不断进化,需要不断评估;任何生物学解释需要考虑方法的局限性。显然,动物模型实验也不能放弃,人类胎儿组织的数据可以作为基准,同时还需要考虑到技术和生物学上的变化。
维也纳分子生物技术研究所的分子生物学家约根·克诺布利希(Jürgen Knoblich)在给《科学家》杂志的电子邮件中说:“尽管类器官在人类神经科学中是一项巨大进步,它们还不是完美的,它们还不能提供血管、免疫细胞,不能提供与神经系统其他区域的功能连接。这项移植实验的目标是证明类器官与其他组织的融合是可能的。”
这项研究的共同作者弗雷德·盖奇(Fred“Rusty”Gage)是位于加州的索尔克生物学研究所的神经科学家,在几年前开始研究这种构体时,他和他的同事就考虑到了大脑类器官的健康问题。这种三维组织丛中心的许多细胞会死去,盖奇告诉《科学家》杂志:“那些细胞得不到存活所必需的血液和营养。”
当他考虑这个问题时,盖奇回忆起20世纪七八十年代他在瑞典与哥德堡大学的乌尔夫·斯蒂尼维(Ulf?Stenevi)和隆德大学的安德斯·比约克隆德(AndersBjorklund)两位神经科学家合作的工作:他们将大鼠神经组织移植到大鼠脑腔内看组织是否能够生长,他们得到的答案是肯定的。盖奇期望每个人类大脑类器官能够顺利地放入到小鼠大脑微小的腔洞内并得到生长,事实证明他是对的。
盖奇团队使用人类多潜能干细胞发育出大脑类器官,大脑类器官在培养物中可以生长40至50天。然后,他们将这些类器官插入到小鼠压后皮质内挖出的腔内,这是运动和空间学习的关键区域。盖奇说,小鼠具有“人性化”的免疫系统,这意味着他们的免疫细胞被设计成不攻击人体组织。在移植5天后,可以使用一种荧光染料检测到类器官内的血管,到了第14天,人脑组织移植物内生成密集的血管网;类器官的某些标记物(如NeuN+和PSD95)的浓度显示,人类神经前体细胞正发育成神经元和形成突触,从而使二者互相连接。在移植90天后,科学家观察到:小鼠大脑内的人脑移植物长出了轴突。
钙成像也显示,类脑的神经元与培养基中的类脑神经元不同,后者分散、孤立活动,前者相互协调,表明活跃的神经元网络正在发育中。此外,光遗传学实验显示,类脑神经元被融入小鼠大脑的突触回路中。
荷兰的胡布勒支研究所的分子遗传学家汉斯·克里夫斯(HansClevers)在写给《科学家》杂志的一封电子邮件中说:“类器官功能的最后实验说明:类器官可以融入宿主。”克里夫斯并没有参加这项研究,他和其他人一起证明了“相对简单的类器官”如肠上皮、肝或胰腺组织的此种功能性。他说:“迷你大脑是到目前为止从类器官生长出的最复杂结构。”盖奇和他的同事的工作“提供了证据:表明移植的‘迷你大脑’和小鼠大脑之间密集生长出血管和神经连接。”
他指出:结果证实了他的发现,即“类器官最令人吃惊的现象:类器官几乎不可阻挡地达到越来越高的自组织水平。”
这样的自组织正是研究人员研究大脑类器官的原因。宾州大学的神经外科医生艾撒克·陈(IsaacChen)通过电子邮件告诉《科学家》杂志:“大脑的功能不仅来自个体神经元之间的相互作用,而且来自特定结构的神经元群的组合活动。在细胞培养物中,这种结构并不存在,因此它有着其固有的局限性,限制能够进行的实验类型和能够得到的结论。”模式生物体的大脑研究可以探索大脑活动如何产生于神经元群、不同的神经元群如何相互作用。但是,显著的物种差异限制了将结果推广到人类大脑。
陈说:可移植大脑类器官可以使研究人员学到更多关于正常人类大脑随时间发育的知识,还可以移植特定疾病病人的类器官以构建疾病的更准确模型。可操作的移植方法可以使科学家研究应用大脑类器官作为治疗方案的优点和局限性,即代替由创伤性脑损伤、中风和其他神经疾病导致的丧失或损伤的组织。
资料来源 The Scientist
责任编辑 岳峰