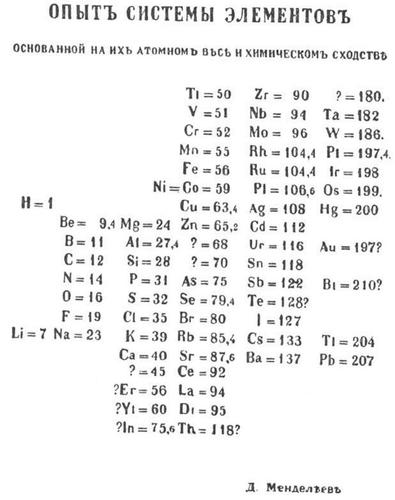150年前,门捷列夫发现了化学元素之间的关系。

俄国化学家门捷列夫是首位发表元素周期表的人。元素周期表将已知元素按逻辑顺序排列,并为尚未发现的元素预留了空间
每一个科学领域都有其钟爱的周年纪念。对物理学来说,是1687年牛顿的《原理》一书出版的日子,该书介绍了牛顿运动定律和引力定律;在生物学领域,是达尔文的《物种起源》(1859年)以及他的诞辰(1809年);天文学爱好者则纪念1543年,哥白尼正是那个时候认识到太阳是太阳系的中心。
而在化学界,没有什么比元素周期表的起源更值得庆祝了。150年前的3月,俄国化学家德米特里·伊万诺维奇·门捷列夫(Dmitri Ivanovich Mendeleev)创造了元素周期表。
对于化学专业的学生来说,门捷列夫的元素周期表如同会计师对电子表格一样熟悉。它用大约100个包含符号和数字的正方形总结了一门完整的科学,列举了构成地球上所有物质的元素,并将其按照能够揭示其性质的顺序排列,从理论和实践上为化学研究提供指导。化学家彼得·阿特金斯(Peter Atkins)写道:“元素周期表是化学领域最重要的贡献。”
门捷列夫的周期表看起来像一张特别的图表,但他想用这张表格来阐释他发现的一个深刻的科学真理——周期律。该定律揭示了已知化学元素之间深刻的家族关系,门捷列夫也因此能够预测那些尚未发现的元素的存在。这些化学元素按原子质量的顺序排列时,在规律性的间隔(或周期)内表现出相似的性质。门捷列夫称:“在该定律公之于众前,化学元素在性质上只是零碎的偶然事实。有了周期律,我们第一次能够在化学视野此前无法企及的地方看到未发现的元素。”
门捷列夫的元素周期表不仅预测了新元素的存在,还证实了原子的存在——这一观点在当时曾经备受争议。该表反映了亚原子结构的存在,并预测了最终在量子理论中揭示的物质规则背后的数学机制。凭借元素周期表,化学完成了从中世纪魔法神秘炼金术到严谨现代科学的转变。
奠定基础
传说门捷列夫在一天之内构思并创建了元素周期表,这一天是俄历1869年2月17日(世界上其他大部分地区为3月1日)。不过,这一说法可能有点夸张。在此前数年时间里,门捷列夫一直在考虑将这些元素分组。在这之前的数十年,其他化学家也曾多次考虑过元素之间的关系。
事实上,早在1817年,德国化学家约翰·沃尔夫冈·德贝莱纳(Johann Wolfgang Döbereiner)就注意到了元素组合的特性。在那段时期,正如英国教师约翰·道尔顿(John Dalton)在1808年提出的原子理论所描述的那样,化学家们还没有完全掌握原子的性质。道尔顿在其著作《化学哲学新体系》中假设每一种基本物质都由一种特殊类型的原子构成,以此解释化学反应。
道尔顿提出,化学反应在原子断开或连接时会产生新的物质。他推断,任何特定元素都完全由一种原子组成,其质量与其他原子不同。氧原子的质量是氢原子的8倍,碳原子的质量是氢原子的6倍。当元素结合形成新的物质时,可通过这些相关的原子量知识来计算。
然而,有些原子量道尔顿弄错了——氧的质量是氢的16倍,碳的质量是氢的12倍。但他的理论使原子的概念变得有用,并引发了一场化学革命。在接下来的几十年里,精确地测量原子量成了化学家们的首要任务。
在考虑原子的质量时,德贝莱纳指出,某些三元素组合(他称之为三元组)显示出一种特殊的关系。例如,溴的原子量介于氯和碘的原子量之间,这三种元素的化学性质非常相似。锂、钠和钾也是三元组。
其他化学家发现了原子量和化学性质之间的联系,但直到19世纪60年代,人们才对原子量有足够的了解,并对其进行了充分的测量,从而产生了更深刻的见解。在英国,化学家约翰·纽兰兹(John Newlands)注意到,按照原子量递增的顺序排列已知元素,每八种元素的化学性质就会重复出现。1865年,他在一篇论文中将这种模式称为“八音律”(law of octaves)。但纽兰兹的模式在前几组元素之后就不太适用了,因此一位评论家建议他应该试着将元素按字母顺序排列。显然,正如门捷列夫很快意识到的那样,元素性质和原子量之间的关系有点复杂。
组织元素
1834年,门捷列夫出生于西伯利亚托博尔斯克,在众多兄弟姐妹中排行17。他兴趣广泛,但追求卓越之路并非一帆风顺。在圣彼得堡的一所师范学院接受高等教育期间,他差点死于一场严重的疾病。毕业后,他进入中学教书(这是他就读师范学院获得奖学金的要求)。在教授数学和科学的同时,他为了获取硕士学位从事着研究工作。之后,他做过家庭教师和讲师,还兼职写过一些科普文章。
当他回到圣彼得堡时,因为没有工作,所以写了一本关于有机化学的操作手册,希望能够获得一大笔现金奖励。尽管成功的希望渺茫,但他却获得了回报——1862年,门捷列夫获得奖金丰厚的杰米多夫奖。他还找到了编辑、翻译和各种化学工业顾问的工作。最终,他重返研究领域,并在1865年获得博士学位,随后成为圣彼得堡大学的教授。
不久之后,门捷列夫发现自己要教无机化学。在储备这个新领域(对他而言)的知识时,他对现有教科书感到失望,因此决定自己写书。撰写文本需要将元素进行组织,所以他一直在思考如何最合理地排列它们。

粗略草图:门捷列夫在元素周期表手写草图中,根据原子量对元素进行排列,揭示了元素的周期律,展现了元素如何在一定的间隔或周期内表现相似的性质
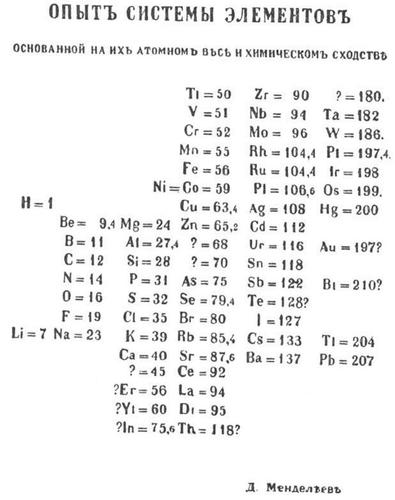
一个有序的愿景:1869年出版的门捷列夫元素周期表是一张垂直的图表,按原子量排列了63种已知元素,这种排列将性质相似的元素放在了同一水平行上。图表名称意为“基于原子量和化学特性的元素体系草图
1869年初,门捷列夫取得了重大进展。他认识到某些家族的相似元素的原子量有规律地增加,其他原子量大致相等的元素具有共同的特性。元素的原子量似乎是对它们进行分类的关键。
根据门捷列夫自己的叙述,他把已知的63种元素的性质分别写在一张卡片上,以此来组织自己的想法。然后,通过一种化学纸牌游戏找到了自己努力寻找的模式。将卡片按原子量高低排列在垂直列中,在每一行中放入性质相似的元素。就这样,门捷列夫的元素周期表诞生了。3月1日,他画好表格草图后,寄给了印刷公司,并将其收录在即将出版的教科书中。他很快撰写了一篇论文,准备提交给俄国化学会。
门捷列夫在他的论文中宣称:“按原子量大小排列的元素具有明显的周期性。根据所有这些比较,我得出了一个结论,原子量的大小决定元素的性质。”
与此同时,德国化学家劳尔·梅耶(Lothar Meyer)也在研究如何组织这些元素。他绘制了一张类似于门捷列夫元素周期表的表格,而且可能比门捷列夫做得更早。不过,梅耶在元素周期表的发表方面被重重击了一拳,首次将其发表的人是门捷列夫,更重要的是,门捷列夫利用自己的表格对未发现的元素做出了大胆预测。他在绘制表格时,注意到有几张便条卡不见了,因此必须留出空白以使已知元素准确对齐。在他的一生中,这些空白中有三个被之前未知的元素(镓、钪和锗)所填满。
门捷列夫不仅预测出这些元素的存在,而且准确、详细地描述了它们的性质。例如,发现于1875年的镓,其原子量为69.9(当时的测量结果),密度是水的6倍。门捷列夫曾预测过一种原子量为68的元素,他称之为准铝。他还预测了准硅,其原子量(72)和密度(5.5)与锗(发现于1886年,原子量和密度分别为72.3和5.469)非常接近。此外,他正确地预测了含氧和氯的锗化合物的密度。
门捷列夫的元素周期表成了神谕,这就像拼字游戏结束时揭示了宇宙的秘密。门捷列夫的预测为他奠定了化学魔法大师的传奇地位。但是今天,历史学家们争论的是,预测元素的发现是否促使人们更容易接受他的周期律。这项定律之所以得到认可,可能更多是因为它能够解释已经确立的化学关系。无论如何,门捷列夫的预测准确性无疑使人们注意到了他那张表格的优点。
到19世纪90年代,化学家们普遍认为他的元素周期律是化学知识领域的里程碑。1900年,未来的诺贝尔化学奖得主威廉·拉姆齐(William Ramsay)称其为“化学领域迄今为止最伟大的总结”。但门捷列夫做这件事的时候,并不知道它为什么会起作用。
数学地图
科学史上的许多事例中,基于新方程的重大预测都被证明是正确的。在一定程度上,数学在实验者发现之前就揭示了一些自然界的秘密,例如反物质和宇宙膨胀。在门捷列夫的例子中,对新元素的预测是在没有任何创造性数学的情况下进行的。但事实上,门捷列夫发现了一幅深奥的自然数学地图,因为他的表格反映了量子力学的含义,而量子力学又是支配原子结构的数学规则。
门捷列夫在他的教科书中指出,构成原子的物质的内部差异可能是元素周期性重复的原因。但他并没有遵循这一思路,事实上,多年来他一直在大谈特谈原子理论对他的周期表有多重要。
有人读懂了表格上的信息。1888年,德国化学家约翰内斯·维斯里辛努斯(Johannes Wislicenus)宣称,按质量排列元素性质的周期性表明原子是由规则排列的更小粒子组成的。所以从某种意义上说,门捷列夫的周期表确实预测了原子复杂的内部结构(并对此提供了证据),而当时没有人知道原子的真正面貌,甚至根本不知道它们是否存在内部结构。

1922年,物理学家尼尔斯·玻尔对元素周期表进行了修订
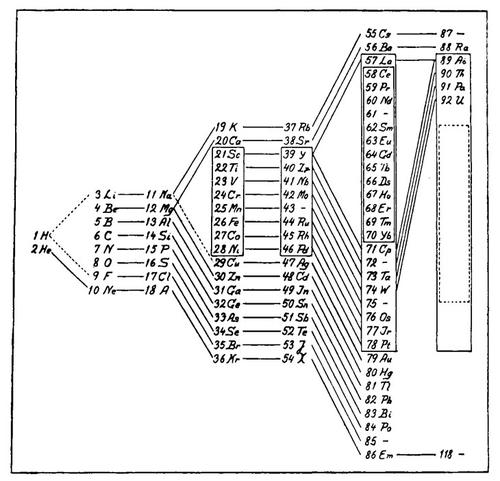
丹麦物理学家尼尔斯·玻尔创制的1922年版元素周期表改编自丹麦化学家朱利叶斯·汤姆森(Julius Thomsen)的元素周期表,其中性质相似的元素排列在同一水平行,并用线条连接。右边的空标记了一组预期出现的元素,这些元素在化学性质上类似于前一列中的稀土元素(编号为58~70)
到1907年门捷列夫去世时,科学家们已经知道原子包括不同的组成部分:带负电荷的电子和带正电荷的某种物质,从而使原子呈电中性。1911年,英国曼彻斯特大学物理学家欧内斯特·卢瑟福(Ernest Rutherford)发现了原子核。此后不久,曾与卢瑟福共事的物理学家亨利·莫斯莱(Henry Moseley)证明,原子核中正电荷的数量(即原子包含的质子数,或其“原子序数”)决定了元素周期表中元素的顺序。
原子量与莫斯莱的原子序数关系非常密切——按质量排序的元素与按数量排序的元素只有几个位置有所不同。门捷列夫曾经坚持认为这些质量是错误的,必须重新测量,而他在某些情况下的确是对的。虽然一些差异仍然存在,但莫斯莱用原子序数对元素周期表进行了修正。
大约在同一时期,丹麦物理学家尼尔斯·玻尔(Niels Bohr)发现,量子理论支配着原子核周围电子的排列,而最外层的电子决定元素的化学性质。
外层电子的类似排列会周期性地重复,这就解释了门捷列夫的元素周期表最初揭示的模式。1922年,玻尔根据电子能量的实验测量结果(以及一些来自周期定律的指导)创建了他自己的元素周期表。
玻尔的元素周期表增加了1869年之后发现的元素,但本质上与门捷列夫发现的周期性排列相同。门捷列夫在对量子理论一无所知的情况下,创建了一张反映量子物理学所规定的原子结构的周期表。
玻尔的新表既不是门捷列夫最初设计的周期表的第一个不同版本,也不是最后一个版本。如今,已经设计并发表的元素周期表版本达数百个。现代版本为水平设计,与门捷列夫最初的垂直版本形成鲜明对比,但直到第二次世界大战后才广泛流行起来,这在很大程度上归功于美国化学家格伦·西博格(Glenn Seaborg)的工作。他是科学服务学会的长期会员,该学会是《科学新闻》杂志的最初出版者。
西博格和他的合作者们合成了一些原子序数超过铀的新元素(铀是周期表中最后一个自然生成的元素)。西博格发现,需要在周期表中增加一行才能排列这些超铀元素(加上排在铀前面的三种元素),这是门捷列夫没有预见到的。西博格的周期表将这些元素所需的行添加在类似的稀土元素行下面,而稀土元素的正确位置也一直不太清楚。1997年,西博格在接受采访时说:“否认门捷列夫需要很大的勇气。”
凭借对化学的贡献,西博格赢得了以自己名字命名元素的殊荣——第106号元素钅喜(seaborgium)。这是为数不多的以一位著名科学家名字命名的元素之一。其他以著名科学家名字命名的元素还包括第101号元素钔(mandelevium),这是西博格和他的同事在1955年发现的,并以理应在元素周期表上占有一席之地的门捷列夫的名字命名。

在修订版中,美国化学家西博格将元素周期表水平放置,添加了铀之后的几种合成元素
资料来源 Science News