“走近科学”是本刊科研项目科普化报道的传统栏目,从本期开始,我们选择一批上海市获得国家及上海市科技奖励的成果进行报道。本篇报道的是2018年度自然科学奖一等奖“项目细胞属性转变的基础和应用研究”,该项目由中国科学院上海生命科学研究院惠利健团队获得。
中国有句成语叫作“覆水难收”,说的就是事件发展的不可逆性,一旦走入什么特定轨道,就再无回头重写的可能。不过,在前段时间热映的国产动画影片《哪吒之魔童降世》中,即使哪吒不幸作为魔丸身份降世,但最终还是逆天改命,实现了“我命由我不由天”。
那么,我们体内的细胞也可以改写自己的命运吗?很长时间以来,科学家都认为,一旦细胞分化完成,成熟的成体细胞到死都不会改变身份,比如,皮肤细胞永远只是皮肤细胞。可是,细胞真的不能逆天改命吗?

细胞的身份
说起改写细胞的身份,那我们首先就必须知道细胞的身份是怎么确立的。其实,身体里每个细胞都有一个共同的起源——受精卵,也正因如此,所有细胞的DNA几乎都是一样的。
受精卵就是最早的干细胞,它分裂成为胚胎干细胞(ES),如果把这些胚胎干细胞分别植入子宫,每个胚胎干细胞都可以发育成完整的胚胎,也就是说,胚胎干细胞是一种全能性的干细胞。
接下来,在胚胎细胞分裂和成熟过程中,各个细胞的命运开始分化,拥有了不同的身份,有的发育成骨骼,有的发育成肌肉,有的发育成皮肤,有的发育成神经……
那么,是什么决定了它们走向迥然不同的道路呢?科学家发现,这是由特定基因的开启或关闭决定,当转录因子结合到基因组中的特定DNA序列上,就能激活或抑制附近的特定基因,进而决定这个特定基因的走向。
这个分化发育的过程有点像一个树状过程,干细胞就是主干。不同的枝桠就是不同的分化通路。
干细胞的分化能力为临床研究带来了新的希望,科学家希望利用干细胞的全能性,培养出需要的细胞和组织,这对于再生医学来说,意味着全新的可能。如果可以实现的话,人们身上坏掉的器官和组织,都可以利用这种方法置换,就像换一个零件一样。
这个想法特别令人激动,因为只要根据身体需要,调控某些基因,使干细胞变成我们想要的细胞和组织,然后替换坏的组织和器官就行了。
然而,干细胞来源遇到了问题,因为需要从胚胎获得,这导致干细胞研究遭受很大伦理争议。
从IPS到转分化
那么,有没有回避这个争议的办法?2006年日本京都大学的山中伸弥博士做到了。其研究团队将4种基因转入小鼠的皮肤纤维细胞,诱导其转化为具有胚胎干细胞样特性的诱导多能干细胞(iPS)。
这项工作不仅将2012年的诺贝尔生理学或医学奖收入囊中,更开启了全世界研究iPS的热潮。甚至,国际上还实现了利用这种干细胞生成的成熟细胞进行临床实验的成功案例。
但是,iPS技术与胚胎干细胞一样,面临一些重大缺陷。此外,它操作周期长,一些技术上的风险人们也认识得不够清楚。
多年来,科学家们一直在寻找更安全高效的新技术,以获得可广泛适用于再生医学及疾病治疗的安全稳定的细胞。
科学家希望,可以绕过多能干细胞这个步骤,直接对成熟细胞进行重新的“编程”,让某些特定基因被激活或者抑制,从而控制它转化为新的身份,这种思路就是“直接转分化”,也就是细胞的“逆天改命”。
细胞转分化,如何实现的?
具体来说,科学家需要研究决定某种细胞命运的关键转录因子。它可以调节一连串基因的活性,进而决定原细胞变成哪种新细胞。
实际上,往往是多个因子共同决定细胞命运的。因此,科学家的工作,就是要找出针对不同细胞身份的不同的转录因子组合,才能让它们实现转分化。
在操作上,这种组合最好尽可能简单,如果转入的调节因子种类太多,难度就会非常大。
在主调节因子成功开启了细胞的一条发育通路之后,接下来的任务,是找出影响细胞完成发育过程的基因,让它变成成熟的、具有特定功能和增殖能力的细胞。
2010年,斯坦福大学的干细胞科学家马吕斯 • 沃尼格(Marius Wernig)团队将诱导细胞定向分化为神经元细胞的转录因子导入成纤维细胞,完成了成纤维细胞到神经元细胞的转化:
研究人员从控制细胞分化候选基因池(19个)筛选分析,最终找出3个适合的基因,在体外实验中,这3个因子成功地将小鼠胚胎期的成纤维细胞和成年小鼠的成纤维细胞转化为神经元细胞。经过检验,通过这种方式诱导的不同种类的神经元细胞可以表达多种神经元特异的蛋白,还可产生电位传导,发育出突触结构,释放或应答不同的神经递质。
近些年来,转分化技术成果“小井喷”,科学家已经可以利用转分化技术成功地诱导成纤维细胞转化为造血干细胞、心肌细胞和神经细胞等,那么转分化技术的临床应用曙光已现了吗?
目前,这些转分化成功的研究多停留在实验室研究阶段,实现临床应用的凤毛麟角,这也就是我们要重点介绍惠利健团队的原因。
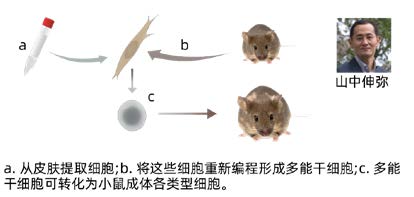
山中伸弥研究团队将4种基因转入小鼠的皮肤纤维细胞,诱导其转化为具有胚胎干细胞样特性的诱导多能干细胞
转分化与人工肝
肝病是长期困扰医学界的难题。我国是肝病大国,有超过1亿乙肝病毒携带者和100万重症肝病患者。长期以来,各种终末期肝病唯一的希望就是肝脏移植。可是,合适的肝脏十分紧缺,即使有幸得到新的肝脏,外源器官带来的免疫排斥,对移植病人来说,又是一道鬼门关。
于是,利用自身细胞转分化成肝细胞,成为再生医学研究的热点。在众多的国际研究团队中,中国团队率先完成,更关键的是,该团队率先实现了临床转化应用。
2011年,惠利健领衔的团队在《自然》上发表了一篇轰动全球的文章:通过转分化技术,研究团队将一种比较容易获得的成纤维细胞,利索地转变为另一种不易获得的肝脏细胞。
具体到技术层面,他们将在肝脏发育及功能实现中起重要作用的14种转录因子转导至获得的小鼠尾部成纤维细胞中,经过对这些转录因子形成的各种组合进行逐一的排查和筛选,最终,研究人员证实在转导Gata4、Hnf1α 和 Foxa3,抑制p19的条件下即可将成纤维细胞诱导转化为功能性肝细胞样细胞(iHep)。
这些iHep细胞呈典型肝脏细胞的上皮样形态,表达肝基因,并显示肝细胞功能,如肝糖原积累、乙酰化低密度脂蛋白的转运、药物代谢和吲哚绿的吸收等。
《细胞》(Cell)杂志的编委和评审专家高度评价此项工作的开创性意义,他们认为研究中所建立的技术体系,作为一项重大突破,对同领域的研究工作具有指导意义。
课题组不满足小鼠实验的成功,2014年,惠利健研究小组又获得研究突破——成功将人类非肝细胞直接转分化为功能肝细胞。这一成功,使国际生物人工肝装置发生飞跃性改变。
人工肝实际上是基于血液净化技术的体外支持系统,能够代替肝脏的一部分功能,促进肝衰竭患者自体肝功能恢复(当然,这并不能治愈肝病,但能够为肝移植病人得到合适肝源之前争取时间)。
生物人工肝的核心技术是用于治疗的功能肝细胞。目前国内外研发的生物人工肝主要采用猪原代肝细胞或者人肝癌细胞作为功能肝细胞来源,但在安全性和功能性方面这些细胞都有很大缺陷,阻遏了生物人工肝的临床应用。
因此获得全新的功能肝细胞是推进生物人工肝在临床应用的关键环节,而惠利健团队做到了。
2016年1月,利用该新型生物人工肝装置在南京鼓楼医院成功救治了一位罹患乙肝40年并突发急性肝衰竭的病人。
生物人工肝装置成功产业化,研究团队再出发
这么好的研究工作自然引起了产业界的关注,2016年,微知卓生物科技公司抛来了橄榄枝;紧锣密鼓,2017年,微知卓生物科技有限公司建成了首条人源性人工肝临床研发生产线,年产量可达300~500份,大约可满足200多位患者临床研究。
在接受《世界科学》杂志采访时,惠利健表示:
“在转化研究早期阶段,因为得到了中科院干细胞先导专项的大力支持,所以我们课题组可以安心搞科研。在大动物实验向临床转化阶段,出现了经费断档问题,在这个节骨眼上,上海市科委的科技创新行动计划又给予了我们大力支持。是这些帮助扶持,让我们的科研成果转化进行得如此顺利!”。
惠利健团队在成功转化生物人工肝研究成果之后,继续专注基础研究。他们和谢渭芬团队的合作研究发现,在发生慢性肝脏损伤时,肝脏里胆管细胞有转分化成肝细胞的能力,而且它的修复能力还很强。
另一方面,在体内,细胞除了转分化,也还可以去分化,比如,肝脏细胞在急性损伤条件下,它们可以去分化成为肝干细胞,然后通过肝干细胞实现再生。而惠利健团队利用肝细胞能够去分化的特点,解决了肝脏细胞体外扩增的难题,也解决了肝细胞移植和器官制造中关键的细胞来源问题。目前这个团队正在尝试人类肝细胞移植的大动物实验和体外肝脏器官制造。
如果可以通过去分化或者转分化,激发患者体内再生肝细胞,那么将会改写的不只是细胞的命运,更是患者的命运。
__________________
本文由上海市“科技创新行动计划”科普项目(19DZ 2332500)资助。