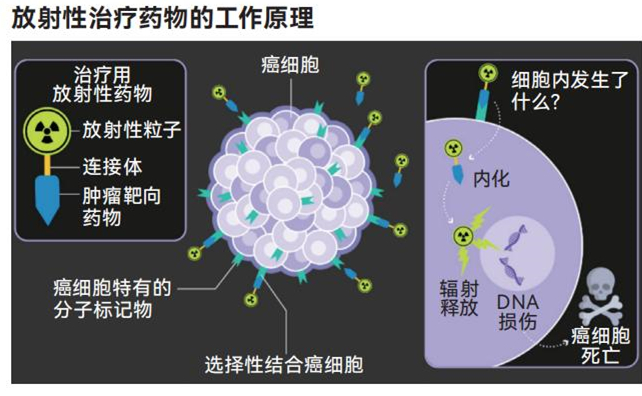
肿瘤放射性药物正开辟肿瘤学新方向,有望实现副作用更少的靶向治疗。
那是1896年1月下旬的一个星期三早晨,美国芝加哥一家小型灯泡厂里,一位名叫罗斯 · 李(Rose Lee)的中年女性接受了当时最前沿的创新医疗:X射线管被放置在她左乳房肿瘤上方,用高能粒子束穿透恶性肿块,以实现治疗。
罗斯 · 李的主治医生后来写道:“没有欢庆喝彩,X射线疗法就这样诞生了。”
自诞生以来,放射治疗已经取得了长足进步。镭和其他放射性金属的发现为给病患机体深处的肿瘤进行高剂量辐射治疗打开了大门。后来,质子治疗的引入让医生能够精确引导辐射束直达肿瘤,从而减少辐射对周围健康组织的损害。随着医学物理学、计算机技术和先进成像技术的发展,这种精确性得到进一步提高。
利用辐射杀死癌细胞的历史很悠久。上图是一张1915年的照片,图中的女性正接受“X 射线疗法”——治疗她脸上的上皮细胞癌
进入新千年后,靶向放射性药物的出现推动放疗领域达到分子精度的新水平。这些药物就像热追踪导弹一样追击癌症,通过血液循环将自己的放射性弹头直接送达肿瘤部位。
目前,只有少数放射疗法可商业化供患者使用,针对前列腺癌和源自胰腺及胃肠道激素分泌细胞的肿瘤。不过随着生物制药行业主力开始大举投入,疗法选择将越来越多。
2024年6月4日,阿斯利康公司斥资24亿美元收购了新一代放射性药物研发企业Fusion Pharmaceuticals,成为最新加入该领域的重量级企业。近几个月来,百时美施贵宝和礼来公司也进行了总价高达数十亿美元的类似交易,而瑞士制药巨头诺华公司延续着自2018年开始的收购势头,2024年5月又宣布计划支付10亿美元预付款,用以收揽一家放射性药物初创公司至麾下。
总部位于美国巴尔的摩的RAPID公司是一家致力于提供软件和成像服务以支持放射性药物开发的企业。公司创始人、约翰霍普金斯大学医学院放射物理学家乔治 · 斯古罗斯(George Sgouros)指出,人们兴趣激增,表明大家越发认识到,放射性药物提供了一种完全不同的癌症治疗方法。
然而,以不同方式治疗癌症也意味着应对一系列独特挑战,特别是这些新疗法的制造和定时分发要在放射性衰减前完成。如果想扩大疗法范围,治疗更多类型的癌症,还需要利用新型的肿瘤杀伤粒子,找到更多合适的靶点。
美国知名投行韦德布什放射性药物分析师戴维 · 尼伦加滕(David Nierengarten)表示:“这个领域有很大潜力,但还有很大进步空间。”
原子之力
过去几十年间,放射性碘一直是市场上唯一可用的放射性药物。碘进入体内后,会被甲状腺吸收,帮助摧毁颈部蝶形腺体中的癌细胞——这种治疗技术创建于1940年代,至今仍被广泛使用。
但该策略受限于靶向性,难以广泛应用到其他肿瘤类型上。
甲状腺天然倾向于从血液中吸收碘,因为这种矿物质以非放射性形式存在于许多食物里,是甲状腺合成某些激素所必需的。
其他癌症对放射性元素无法产生类似关联。因此,研究人员必须设计能识别和抓住肿瘤细胞产生的特定蛋白质的药物,这些药物随后被进一步改造为靶向载体,将放射性同位素(释放核能的不稳定原子)直接运送到肿瘤部位。
第一批进入市场的放射性药物仅被用于获取体内组织影像。此类产品使用相对温和、寿命较短的放射性同位素,能在正电子发射断层显像(PET)扫描中精准照亮癌组织,帮助医生更准确地诊断和定位恶性细胞。这为配有更强效且致命的放射性有效载荷的放射性药物铺平了道路。现在,它们的目标不仅仅是成像,还要杀死肿瘤细胞。
当然,该策略要成为常规癌症疗法,仍需时日。
来昔决南钐(Quadramet)是第一种上市的将放射性同位素与细胞靶向分子相结合的疗法,于1997年获得美国监管机构批准。它能姑息性缓解癌症引起的骨痛,但无法缩小肿瘤。很少有临床医生愿意开这种药。
21世纪初,两种治疗淋巴瘤的新药问世。这两种药物都有放射性粒子,能靶向恶性血细胞上的标记物CD20。不过这些药物虽在临床试验中效果极佳,帮助绝大多数参与者缩小了肿瘤,但在临床实践中却难以获得广泛认可。相比之下,另一种同样靶向CD20的非放射性药物利妥昔单抗(Rituximab)展现出远超前两者的竞争力,并最终导致这两种药物停产。目前这两种药物都无法供患者使用。
经历过商业挫折,人们对放射性药物的兴趣逐渐消散,相关投资也陷入停滞状态。尼尔 · 班德(Neil Bander)是专注放射性药物研发的初创企业Convergent Therapeutics的创始人兼首席科学官。他表示:“在那个年代,制药公司看到放射性药物就像见鬼一样,唯恐避之不及。”
但还有大学在做相关努力,包括纽约威尔康奈尔医学院。班德在该医学院工作了40年,从2000年开始试验用放射性标记的抗体药物治疗前列腺癌。这些药物能够结合前列腺癌细胞表面的一种受体蛋白,即前列腺特异性膜抗原(PSMA)。一旦结合,药物就会被这些细胞内化,并将放射性物质直接送达肿瘤细胞的遗传核心。班德与他人撰写了一篇关于这种疗法和其他基于PSMA疗法的文章,发表在2024年的《医学年鉴》(Annual Review of Medicine)上。
核选项
欧洲的临床医生正在开发针对另一个目标(即生长抑素受体)的放射性标记药物。生长抑素受体蛋白存在于罕见的神经内分泌系统肿瘤中,可介导激素信号,进而促进肿瘤生长。研究人员发现,载有放射性同位素的激素模拟分子会与这些受体结合并有效缩小肿瘤。
临床医生根据同情用药协议(允许重病患者接受试验性治疗)试验了不同的放射性有效载荷。他们先使用钇和铟等不稳定元素,后主要围绕镥的同位素开展工作。这种稀土金属之所以受青睐,原因在于它对肾脏更温和,半衰期更长,利于制造和运输。德国巴德贝尔卡的一家诊所曾为超过1000名患者提供为期十年的治疗,结果表明,相比于常规治疗的典型情况,放射性同位素治疗提高了病人存活率。
与此同时,几家新兴制药公司的努力为推广放射性同位素治疗建立起监管基础。法国先进加速器应用公司(AAA)曾通过随机试验探究一种镥标记药物的效用,并于2017年报告称,此疗法相较于现有的标准治疗,能够更显著地减缓肠道肿瘤的发展。这种药物被命名为镥氧奥曲肽(Lutathera),很快获得欧洲和美国监管机构的批准。
诺华公司注意到行业新动向。它过去曾涉足放射性药物领域,现在则全力以赴。在镥氧奥曲肽于欧洲获批后的几周内,诺华公司迅速达成交易,以近40亿美元的价格收购 了AAA。一年后,它又以超过20亿美元的价格收购了美国印第安纳州的一家小公司Endocyte。
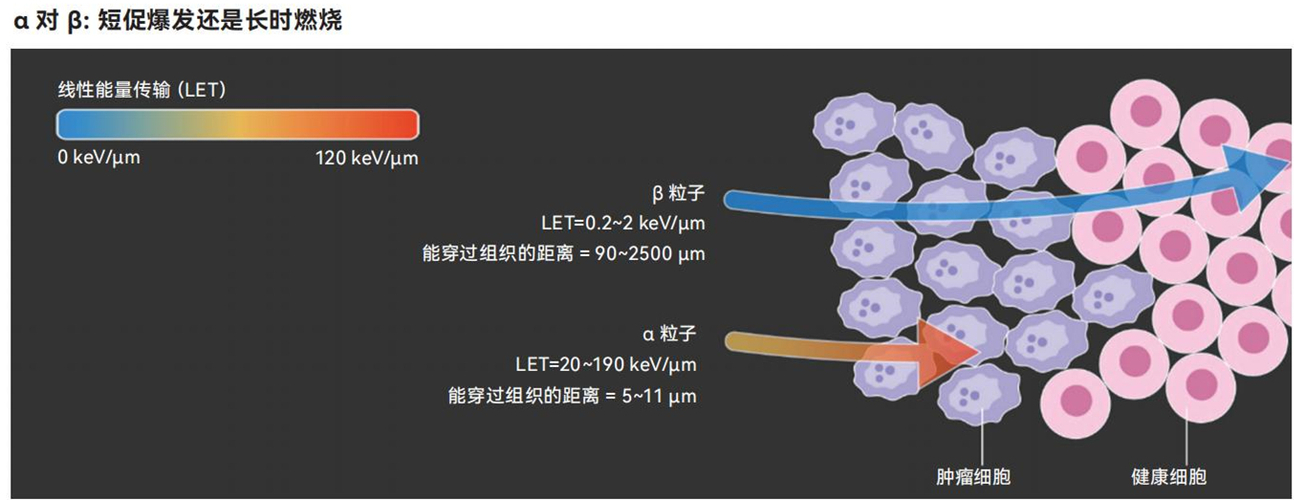
人们越发倾向于在放射性药物中使用α粒子,因为α粒子能更精确地靶向癌变组织,并具备更强的局部细胞杀伤特性
班德说:“这就像有人按下了开关,然后业界对放射性药物的兴趣突然就高涨起来。”
收购Endocyte为诺华公司带来了一种针对PSMA的药物。该药物潜力巨大,有望成为晚期前列腺癌患者的福音,同时产生可观收益。在一项随机临床试验中,临床团队将该药物与标准疗法联合使用,成功将疾病进展前的平均时间从不到四个月延长至八个月以上,还使得接受治疗者的寿命延长了几个月。
值得注意的是,镥氧奥曲肽的临床疗效也令人印象深刻。不过由于神经内分泌肿瘤很罕见,这种药的销售额就很有限。相比之下,针对前列腺癌的PSMA靶向疗法2022年以Pluvicto为品牌名获批,具有极高的商业价值,因为大约1/7的男性在一生中都会被诊断出前列腺癌。Pluvicto上市不到两年就距离10亿美元级别的“重磅炸弹”仅2000万美元之差。
β与α
Pluvicto和镥氧奥曲肽都是围绕小蛋白质序列(肽)构建的。这些肽专与癌细胞上的目标受体(如前列腺癌中的PSMA受体、神经内分泌肿瘤的生长抑素受体)结合,并通过不稳定镥的衰变传递辐射。
这些药物被输注到血液里,在体内循环,直到牢固附着于遇到的肿瘤细胞表面。镥同位素固定于目标位置后,会释放两种有助于癌症治疗的辐射。其中一种主要的辐射由β粒子组成。这是一种高能电子,能穿透肿瘤和周围细胞,攻击DNA并造成损伤,最终导致细胞死亡。
另一种产量较小的是伽马射线。它不会对组织造成太大损伤,但足以让医疗人员实时追踪药物在体内的分布情况,从而监测治疗进展并相应地调整策略。加州大学旧金山分校的核医学专家托马斯 · 霍普(Thomas Hope)表示:“你可以给药剂流向做成像,从而获得更深入的了解。”
现阶段临床试验中的许多其他疗法也使用了放射性镥和其他β发射同位素(beta-emitting isotopes),但目前研究工作和大量行业投资正逐渐转向依赖α发射同位素(alpha-emitting isotopes)的药物。
相比于β粒子,α粒子的质量和能量都更大,因而更善于通过破坏双螺旋的两条链撕裂DNA,导致高度局部化的细胞毁灭。“这就像一颗炮弹在细胞内爆炸。”约翰 · 瓦利安特(John Valliant)说道。瓦利安特是前文提到的加拿大药企Fusion Pharmaceuticals的创始人兼首席执行官;而阿斯利康公司之所以收购Fusion Pharmaceuticals,就是因为被其研发的发射α粒子的放射性药物吸引。
α粒子的另一个关键优势是其射程有限。它们往往只能穿透约50到100微米(接近人类头发的直径)的距离。β粒子与之形成鲜明对比,能在能量耗尽前穿过几毫米的组织。因此,使用α粒子的疗法可实现高度局部化的效果:它们破坏肿瘤组织,同时保护附近的健康细胞免受伤害。
第一批进入市场的发射α粒子的放射性药物中,有些可能通过PSMA来治疗前列腺癌。开发人员乐观地认为这些药物最终将取代 Pluvicto,并且正在添加额外功能以提高疗效。
例如,Convergent Therapeutics公司的班德团队正在开发一种更大型的药物。该药物基于一种连接α发射同位素的抗体,其大小和复杂性决定了它停留在人体内的时间比基于肽的同类药物长得多,后者往往会被肾脏迅速清除。这意味着该药物有更多的时间找到目标,从而杀死肿瘤细胞。此外,与肽类药物相比,针对PSMA的α发射同位素的抗体似乎对唾液腺的损害较小,因此提供了潜在的安全优势。
但澳大利亚放射性药物公司Telix Pharmaceuticals的首席执行官克里斯 · 贝伦布鲁赫(Chris Behrenbruch)表示,精确摧毁细胞内的α辐射源并非总有好处。他认为,放射性物质的选择应考虑到患者的疾病状态以及所接受的其他疗法,这些疗法正越来越多地成为癌症治疗中的标准联合用药治疗方案。
当临床医生开始探索联合使用放射性药物与其他能刺激抗肿瘤免疫反应的药物时,贝伦布鲁赫指出:对肿瘤周围组织造成一些损伤或许是可取的,原因在于损伤有助于吸引抗肿瘤T细胞。他说:“没有什么比健康组织受到辐射更能激怒你的免疫系统了。”
Telix Pharmaceuticals公司目前正探索上述理论。研究团队开展临床试验,将一种针对肾癌细胞产生的酶的镥标记抗体与一种旨在激活人体T细胞的免疫治疗药物相结合。该公司的放射性药物靶向了新目标,同时也存在造成附带损害的风险,因为胃、胰腺和胆囊的健康细胞——而不仅仅是肾脏的癌细胞——同样会产生被视作靶点的酶。贝伦布鲁赫指出,初步试验数据表明这种治疗通常是可耐受的,但还需要持续的研究来全面评估其安全性。
上述案例中的特异性挑战——怎样让疗法只针对癌细胞而不影响健康组织——并非个例。德国埃森大学医院核医学专家肯 · 赫尔曼(Ken Herrmann)为行业内大多数大型制药公司以及几家较小规模的生物技术公司提供咨询。他指出,除了PSMA和生长抑素受体之外,专门或主要由肿瘤细胞表达的蛋白质种类非常少。这种局限性使得研发可有效靶向肿瘤而又不对周围健康组织造成非必要伤害的疗法变得更加艰难。“所有人都在寻求新靶点,但哪些新靶点会成为赢家呢?我们不得而知。”
诺华公司在识别下一个突破性靶点的竞逐中处于领先地位。他们正在研发的新一代放射性标记药物针对几种具有癌症选择性的蛋白质,其中一部分药物已进入临床评估阶段,另一些则处于发现和验证的早期阶段。同时,诺华公司也在拓展生产能力,在全球各地开设专用于大规模生产放射性药物的新工厂。
放射治疗药物需以铅容器和内衬盒作特殊包装,并被迅速而准确地运送至治疗地点
不同于其他抗癌药物,放射性药物在生产过程中常出现供应链问题。百时美施贵宝公司就遇到了这种情况,由于同位素短缺,他们不得不暂时停止招募使用最近从RayzeBio公司(已被前者收购的放射性药物企业)采购的放射性药物进行晚期试验的患者。此外,即便获得了必要的同位素,放射性物质快速衰变的特点也迫使企业在特殊的物流框架下运作,需要临床医生和制造商之间的精心协调,以保证药物于严格规定的时间范围内送达医院,同时疗效理想。
企业通常有两周的时间用于生成放射性同位素,将其附着到靶向药物载体上,并送出去以供施用。这并非现成可用的产品,也不是完全按需定制,而是介于这两者之间。诺华公司负责放射治疗药物开发的吉文 · 维尔克(Jeevan Virk)表示:“一般每剂药物都是在特定时间和特定地点为特定患者制作的”。
2024年早些时候,诺华公司耗资 1 亿美元在美国印第安纳波利斯开设了一家专用制造工厂。该工厂计划每天生产数百甚至数千剂 Pluvicto。这与芝加哥灯泡厂的简陋设施大相径庭,而在几小时车程之外,罗斯 · 李成为第一位接受 X 射线治疗的癌症患者。在这些创新之地,历史正在向前扩展,将过去的发现与未来的可能联系在一起。
资料来源 Knowable Magazine