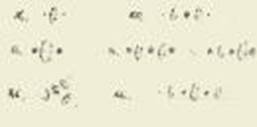丹麦物理学家、哥本哈根学派创始人波尔,因其卓越的物理学成就而青史留名。鲜为人知的是,波尔对化学一直心向往之,实际上他还两次被提名为诺贝尔化学奖。100年前的1913年,玻尔发表了三篇系列论文。通过这组文章,他试图为原子和分子化学建立一个新框架。但是这段历史却不为大多数人所知。赫尔奇·克劳的这篇文章,通过翔实的资料,为我们展示了行走在物理与化学之间的波尔一面。由于篇幅较长,我们将分两期刊发。
玻尔(Niels Bohr)的原子理论不仅解决了许多化学问题,同时也为一些物理效应方面的问题找到了解决思路。但是这位伟大的科学家的初衷是想为原子和分子化学建立一个新的框架,而这并没有成功,并且大多数化学家都不知道有这件事。
1913年夏秋之际,玻尔发表了三篇系列论文,在论文里,他提出的原子理论对当时的物理界来说是开创性的概念;时至今日,这些理论都还在高中和大学教科书本上有所出现。然而,这项理论仅仅在单电子原子方面大获成功。玻尔自认为他在物理原子和化学分子方面的新理论是十分成功的,甚至能够颠覆传统观念,掀起对物体内部构造的新论点,但历史证明,他的理论总体还是存在一些错误。然而,他的巨作“论原子构造和分子构造”,仍然能为物理界的同仁解决很多化学问题。玻尔在第一阶段工作中主要研究了氢原子,到了第二阶段,他开始大量研究一些更复杂的原子,到了第三阶段,玻尔重点研究分子结构问题。在1913年的三部曲中,玻尔着重分析了一些化学性质的注意事项和可能引发的结果,而这一点在今天的学术界也往往会被忽略。此外,他的理论有极其重要的化学意义,特别是他对元素周期表中各种元素的原子结构和元素周期表形成的说明。
物理和化学这两个姐妹科学之间一直存在的争议性关系,是一个纵贯大半个科学史的主题。时间追溯到1786年,在哲学家伊曼努尔·康德(Immanuel Kant)的后牛顿时期作品《自然科学的形而上学基础》中,他认为化学永远不可能成为像备受推崇的力学物理那样成为一门真正的科学,因为化学的内容很难用数学方法去处理,并且不遵循自然规律的必然性。后来,化学家们一直在期待出现一个“化学界的牛顿”以更高的物理原理为基础去诠释演绎化学这门科学。玻尔的理论会是万众期待的答案吗?慕尼黑的阿诺德· 索末菲(Arnold Sommerfeld)深以为然,并且认为化学正在慢慢简化为像物理一样。在英国,奥利福·罗季(Oliver Lodge)将玻尔的原子理论视为这两门科学关系史上新的篇章。“看样子,”他说,“这对化学的贡献就像牛顿对太阳系的贡献一样。”但事实并非如此。尽管之前期望良好,玻尔的原子理论还是没能基于纯粹的物理学基础来诠释化学。
玻尔和化学科学
1903年,当18岁的玻尔就读于哥本哈根大学学习物理时,他接受了在数学,天文学和化学等方面全面扎实的教育。1905年,他遇见了比他年长6岁的尼尔斯·比杰伦形(Niels Bjerrum),当时尼尔斯·比杰伦形正在教授一门无机分析化学的实验课程。比杰伦形回忆道,玻尔在化学学习方面是个非常好学但多少有点笨拙的学生,试验室因为他打坏的试验器皿而耗费了一笔不小的开支。几年后,比杰伦形开展了一项将量子理论应用到旋转和振动分子上的开创性研究。他也是第一批参考玻尔原子理论的化学家之一。1917年在丹麦化学教科书中,他使用了新的玻尔――索末菲(Bohr-Sommerfeld)原子结构模型,尤其是这个模型定义元素的方式――使用核电荷Z而不是原子重量。对于玻尔来说,他对比杰伦形的分子光谱学工作非常了解,并且在他的三部曲理论中的第三部有所体现。玻尔和比杰伦形成为了一生的挚友,不仅有着相同的科学兴趣,而且还共同享有一艘名为Chita的帆船。
在玻尔成为了哥本哈根大学的一名物理学教授安定下来之后,特别是随着1921年哥本哈根大学的理论物理协会(现在称为尼尔斯玻尔协会)成立,玻尔会定期与丹麦化学家延斯·克里斯蒂安森(Jens Christiansen) 和约翰内斯·布朗斯特德(Johannes Br·nsted)进行接触。克里斯蒂安森在玻尔的协会中工作过一段时间,玻尔在化学上的伟大天赋令他印象深刻,他将这一部分归因于对化学问题方面的天生能力,另一部分归因与玻尔与化学家之间的接触。在那些与玻尔互动的人中最重要的要数匈牙利物理化学家乔治·德赫维西(George de Hevesy),玻尔和他建立一段长久的友谊。德赫维西因为他对放射性示踪剂的研究工作而获得了1943年的诺贝尔化学奖,他接纳了玻尔关于原子结构和放射性起源的早期观点。在玻尔于1913年2月7号写给德赫维西的一封信中,玻尔概述了他尚未完成的理论中的一些化学内容,其中包括“一个关于元素周期系很有见地的理解”和关于原子和是如何结合成分子的阐释。总体上,雄心勃勃的玻尔设想“一个对我们可以称之为‘化学和物理’物性的详细理解”。
除了1922年被授予诺贝尔物理学奖之外,玻尔还两次被提名诺贝尔化学奖,分别在1920年和1929年,这两次诺贝尔奖最终都被德国化学家获得。然而,尽管玻尔对化学以及他理论中与化学相关的部分兴趣浓厚并且有着深刻的认识,但他的思维从未真正的化学化过。他提出的原子理论相对于化学来说带有更多的物理成分,而且他趋向于化学推论仅仅是因为这其中有些资源对理论物理研究的更上一层楼很有帮助。原子和分子的化学模型对于化学来说可能是有用的,但是如果它们与量子物理相冲突――这是常有的事――玻尔就会立刻推翻它们。在1920年他做的一些演讲当中(图1是玻尔在耶鲁大学做演讲),他表达了经典的简化论态度,认为化学可能起源于原子物理。就像索末菲(Sommerfeld)一样,将化学完全的数学化也是有可能的,因此根据康德的标准这个领域也可能自成一派。但这只是一门从属于物理学的更加基础性的科学,而无法与之媲美。

图1.在1923年11月6日到13日尼尔斯·玻尔在耶鲁大学所做的一场西利曼讲座上,他谈到了对应原理
混合的原子构造方法
1912年7月,在一份寄给欧内斯特·卢瑟福(Ernest Rutherford)的曼彻斯特备忘录中,玻尔总结了他关于原子和分子结构的早期观点;图2 是研究的一些草图展示。那时他并没有提及他有关光子发射和线状光谱的理论,他在7个月后才提出该理论。他讨论了多电子原子的机械稳定性,并且认为在电子系统的构造过程中,并不可能一直将所有电子限制在单个“环”内;在某一阶段会需要在外圈形成一个新的“环”。就是那样,玻尔第一次确定了最外层电子和元素化学价之间的联系,他认为这种联系对解释周期律是非常有必要的.一年多以后,他详细说明了他三部曲中第二部分的见解。
不像约瑟夫·约翰·汤姆森(J J Thomson)和其他早期的原子结构提出者,玻尔意识到多电子原子的组成部分不可能由当时的理论严格推导出来。从机械稳定性的一般通则和角动量常量值得出来的推论很好的解释了氢原子结构,但这并不适用于其他带有多电子的原子。因此玻尔采用了另一种变换方法,这种方法基于“原子形成的普遍观点……(和)相关元素属性的知识。”事实上,比起基于力学和量子理论基础的计算,化学上的归纳推理对于玻尔关于电子构型的确立更加重要。
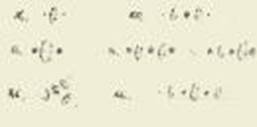
图2.尼尔斯·玻尔将原子束缚在简单的分子中的初步结构描绘在他1921年寄给欧内斯特·卢瑟福的曼彻斯特备忘录中
玻尔对化学推理的依赖,和他在原子构造上折衷的,有时投机取巧的方法,可以很显而易见的从他对锂原子的研究上来看出来。玻尔计算了两种结构的总结合能。一种是双环结构,玻尔用(2,1)表示了2个电子在内环,1个电子在外环。另一种结构可以用(3)表示,包含了三个运动在同一个环上的电子。他的计算结果分别为-218eV和-240eV,这意味着(3)结构能量性质方面更有利。这个结论与锂原子的化学性质相悖。所以玻尔放弃了他的力学计算结果,并宣称(2,1)结构才是正确的。同样地,他还发现一个物理性质稳定的内环不能承载超过7个电子,显然这个结果和已知的元素周期不相符合。因此他将7改为了8――例如指定纳的结构为(8,2,1)而不是(7,3,1)。关于最外层环上的电子数目,他甚至没有通过计算就断言:“这个环上所能带的电子数目肯定和该元素的一般原子价相等。”
玻尔用这种折衷的办法得出来的结果就是从Z=1到Z=25的电子构型和元素周期表很相似。在实现他的思考中的试验性本质时,他慎重地避免了用他的结构指定化学符号或者明确地用他们去解释化学周期表。他满足地记录了“看起来原子的构造和所观察的元素属性相吻合也不是不可能的事情。”――典型的玻尔式话语。
分子理论
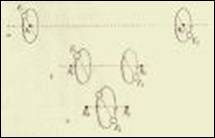
图3.尼尔斯·波尔认为,通过观察两个氢原子互相靠近的情况,可以了解氢气和氦气的结构原理
在理论三部曲的第三部分里,玻尔主要研究分子和共价键问题,他认为,分子化合物两个原子间共用一个或多个电子。这个分子构想在曼彻斯特的备忘录中有详细记录,在笔记中,他提出了氢气、氧气、臭氧、水、甲烷和乙炔的初步模型。他特别详细地研究了氢气,如图3所示,氢气包含两个原子核以及两个核外电子。我们可以用一个简单的计算证明这样的分子系统是可以稳定存在的,这个过程是这样的,H+H→H2是放热过程,每摩尔会释放251千焦的热量(假设阿伏加德罗系数是6.5 × 1023)。经过计算,得出这个反应过程中生成的热量是一个合乎常理的数据,几个月后,美国化学家欧文·朗缪尔告诉他,通过改进实验,得出的热量结果是每摩尔318千焦,玻尔更加确定自己理论的正确性。玻尔运用修正后的阿伏加德罗常数再次进行计算, 得出每摩尔释放264千焦热量这个值,这仅仅低于实验所得数据17%。可惜,朗缪尔的最终实验值是每摩尔释放351千焦热能,仍然与波尔的理论有所偏差。这个偏差的存在说明其中一定存在思考误区,但这一差异最初并未得到足够重视。
玻尔最后用自己的理论解释了分子模型问题,并于1919发表了一篇论文,但这篇论文很少有人知道,在论文中,他将研究氢气的方法延用下来,提出了H3分子存在的可能性。当时,玻尔通过一些化学和正离子实验中得出,可能存在不同寻常的类氢原子。他运用类似于氢气分子稳定性计算的方式进行计算,认为H3是可能存在的,通过这个放热过程形成:H++H2-→H3。同时,他发现H3+离子很不稳定,这一发现反驳了汤姆逊在1913年对H3+的发现及之后的结论。无论是玻尔还是其他非常关注和研究三原子氢的学者,尽管在某些实验异常情况下能发现H3+的存在,但是仍然没有令人信服的证据证明确实存在H3+。
未完待续