P因子是在黑腹果蝇(Drosophila melanogaster)中发现的一种转座子,至今已有9年左右的研究历史。转座子对基因突变和表达调控具有重要的作用,而P因子又有可能成为高等真核生物基因工程的一种安全而有效的基因载体。所以该领域引起了研究者广泛兴趣,并作了深入的研究。本文试就P因子的概念、结构、行为、起源、进化和作为真核基因载体的应用作一简述。
1. P因子的概念
与任何概念一样,P因子概念的内涵也随着研究的深入而不断地充实。最初它只是笼统地代表一种“父方因子”(Parteranlly contributing factor)。到70年代,也许更早就有一些实验室发现,当用黑腹果蝇一种品系的雌蝇与另一品系的椎蝇杂交时,子一代出现雌性卵巢劣育、雄性重组、高突变率、分离比异常和染色体重排等现象。Kidwell对此作了系统研究之后,首次提出杂种劣育(hybrid dysgenesis)一词来概括上述现象。由于杂种劣育只出现在单向杂交的子代中,即一种品系的雌蝇与另一品系的雄蝇杂交时,子代劣育,反之不然。所以把只有取其雄蝇作杂交亲本时才能导致杂种劣育的品系定名为P品系(Parteranlly contributing);相应地,把只有取其雌蝇作杂交亲本时才能导致杂种劣育的品系定名为M品系(maternally contributing)。所谓P-M系统(P-M system)就是将黑腹果蝇划分为P品系、Q品系(一种中间类型,以后还将谈到)和M品系。只有M♀×P♂的杂交子一代出现杂种劣育,而P♀×M♂、P×P和M×M这三种杂交的子代都正常。于是就把P品系所携带的导致杂种劣育的因子称为P因子。鉴于在两性生殖中,精子贡献的是核,故认为P因子存在于染色体上,相应地,M因子存在于细胞质中。
嗣后,在研究杂种劣育的遗传现象时,发现P因子分散地存在于每条染色体的多个位点上,P品系不同,分布位置也不同,提示P因子是可移动的遗传因子(mobile factor)。
1967年格林(Green)发现了果蝇白眼基因座位的一个突变等位基因,定名为可突变的白眼——猩红眼基因(WC),接着在白眼基因座位上又发现了另一些不稳定的突变型。WC可以突变成许多种不同状态,如果回复到野生型则很稳定,如成为其它突变型却是高度的不稳定。因而认为这种变异可能是转座子的作用。1982年鲁宾(Rubin)等的研究肯定了这一推论,并第一次把P因子与DNA的特定片段联系起来。他们选出5个劣育杂种(dysgenic hybrids)的白眼突变型,克隆,其白眼基因坐位的DNA,比较野生型和白眼突变基因的DNA酶切图谱,发现其中4个白眼突变是因为红眼基因中插入了500 ~ 1400 bp不同长度的DNA片段,这些插入片段的核苷酸顺序彼此都很相似,推测这些DNA片段就是P因子。原位杂交结果表明这些同源顺序在标准P品系中有30 ~ 50份拷贝,但不存在于标准M品系中,从而肯定了上述推断。进一步研究白眼果蝇的回复突变型,发现这是由于P因子的切离而不是真正的基因回复突变。这就证明P因子的确是一种转座子。
至此,我们至少可以这样来理解P因子的概念:这是黑腹果蝇P品系中有30 ~ 50份拷贝、在一定条件下可发生转座并导致杂种劣育的一种可移动因子。
2. P因子的结构
鲁宾实验室首次克隆了完整P因子。顺序分析表明它是一段长2.9 kb的DNA分子,两端有31bp的颠倒重复顺序(O'Hare & Rubin,1983)。中间有4个可编码区,在任何一个可编码区中引入移码突变都足以使转座酶的活性消失,表明这4个可编码区都参与转座酶的生成。RNA分析表明,P因子有两种转录产物。蛋白分析则表明转座酶是一条多肽链。其间的关系不甚明了。
前面已经讲过,P品系基因组中P因子有30 ~ 50份拷贝,但它们的长度大小不同,小到0.5 kb,大至完整的2.9 kb。酶切图谱分析表明短片段DNA都是完整P因子发生不同程度的缺失所造成。
3. P因子的行为和功能
P因子具有下述行为特征:一,它在P品系中,即在十细胞质环境中非常稳定,只有进入M品系所提供的细胞质环境后,它才有活性,才会频繁地转座,而这种转座活性只限于生殖细胞。这就是只有当M♀×P♂杂交时,才出现杂种劣育的原因;二,只要基因组中存在完整的P因子,能够提供转座酶,则P因子不论缺失多大都能转座。因此,当克隆在质粒里的有缺失的P因子连同2.9 kb的完整P因子一起用微量注射法转入受体细胞后,缺失型P因子也能从质粒转座进入受体细胞的染色体。
很明显,P因子插入某个基因座位后便导致该基因发生突变,而当P因子完整地切离时,又使该基因回复到突变前的状态。P因子诱导发生高频率突变的一个非常明显的标记是刚毛突变,因此有人建议以刚毛突变频率的高低来判断是否发生杂种劣育。
英格尔斯Engels研究了746条由P因子诱导发生重排的染色体,发现都是由于染色体在多个位点上发生断裂后随机地重新连接。而且,绝大多数断裂点都位于原先存在的P因子内或紧靠P因子的位置上,这样就很自然地认为由于P因子转座时形成共联体结构或同源重组造成断裂面导致重排。
已知在减数分裂时雄性果蝇染色体不会发生重组。然而M♀×P♂的杂交子代中却会产生雄性重组。
研究表明这是由于P因子诱导了交换的缘故;并且交换总是对称的,它出现在精子发生中的减数分裂前期。
杂种劣育的一个最显著的特征是子一代雌蝇卵巢劣育,解剖学上表现为卵巢残缺。M♀×P♂杂交子代雌蝇几乎百分之百是卵巢劣育。卵巢劣育是对温度依赖的表型,上述杂交只有在29℃培养时才导致卵巢劣育,在正常温度范围内(18℃ ~ 25℃)培养则不出现卵巢劣育。至于P因子导致卵巢劣育的机理,至今尚不清楚。雌果蝇有一对卵巢,卵巢劣育可以只出现在一对卵巢中的一个,即杂交子一代雌蝇的一侧卵巢正常,另一侧卵巢不育(残缺)。这表明卵巢劣育发生在卵巢形成的最初阶段。有研究表明在M♀×P♂杂交中,F1雌蝇的细胞质类型是对温度依赖的。但这同卵巢劣育之间关系仍不清楚。
4. P因子的起源
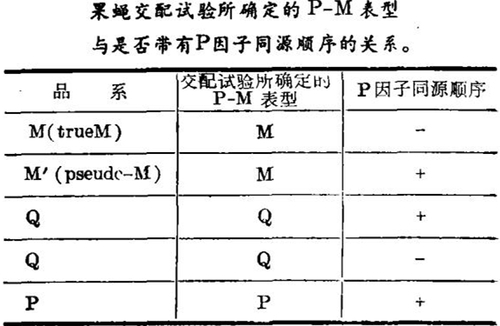
为什么同一黑腹果蝇种内,有的带有P因子有的却不带?在研究P因子的起源时很自然地:想要去了解P因子的分布。最初人们通过果蝇交配试验来鉴别野生果蝇未知群体所属的品系,方法如下:杂交A:M♀♀×U♂♂(U—待测果蝇);杂交B:U♀♀×P♂♂。29°C培养,解剖F1雌蝇(一般50只),统计卵巢劣育百分比。若杂交A的卵巢劣育大于10%,则U为P品系;若杂交B的卵巢劣育大于10%,则U为M品系;若两种杂交的卵巢劣育皆小于5%,则U为Q品系。根据这一杂交系统,对世界许多地区作了P-M系统分布的调查。结果表明美洲大陆和南非的野生群体多为P品系和Q品系,欧洲和亚洲主要是M品系,也有Q品系。当时人们认为P品系带有P因子,Q品系带有不完整的P因子,M品系则不带P因子。这样,P、Q和M品系的分布状况也就代表了P因子的分布状况。可是近年来DNA分子杂交的结果(如表)却表明情况并非如此。
从表可见,单凭分析杂交子代雌蝇的卵巢劣育百分数并不能真正反映P因子的分布。即使是已确定的M品系,却也含有P因子;而原先认为含有不完整P因子的Q品系,也有不含P因子的。因此如用P因子作为探针,以DNA分子杂交的方式直接检测黑腹果蝇各个品系中是否存在P因子的同源顺序,才能正确地了解P因子的分布。笔者用克隆的P因子HindⅢ 0.86 kb片段为探针,通过DNA分子杂交考察我国沿海七省一市十因个地区野生果蝇群体中P因子的分布,初步得出了在上海以地区采集到的果蝇群体中多带有P因子,而上海以南地区采集的果蝇群体中则很少有P因子出现的结论。这对研究我国果蝇群体中P因子的来源与传播途径,以及为全球性的P因子分布调查提供中国的资料,都是很有意义的。目前的研究表明,P因子同源顺序不仅存在于黑腹果蝇中,还广泛地存在于与黑腹果蝇同一亚属的其他种群,如obscura种群、willistoni种群和saltans种群。但使人感到意外的是,与黑腹果蝇同属一个种群、也即亲缘关系更近的几个亚种群却不含P因子同源顺序。因此就P因子的起源问题,只从P因子在果蝇不同种群中的水平分布规律来研究显然是不够的,还应从进化的角度进行探索。
5. P因子的进化
P因子对果蝇的进化有什么影响?凯亚逊(Kiyasn)等的研究表明在P、M品系混合的群体中,尽管选择压力不利于劣育的子代,但P因子仍然能够存在并增殖自身,这似乎表明P因子存在与否对果蝇并无重大影响。因为尽管P因子的转座行为会导致子代劣育、高突变率、染色体畸变和雄性重组,进而降低杂种子代的生活力;但这只限于特定的杂交组合所产生的子代,而且突变也会增加可能更适应于环境的变异个体。因此在群体水平上,还很难说P因子对果蝇进化有重大影响。
6. P因子的载体功能
鉴于P因子长为2.9 kb,是迄今为止发现的高等真核生物的一种转座子。人们很自然会想到用它作为高等生物特别是哺乳类或人类基因工程的安全载体的可能性。鲁宾(Rubin)和史帕拉林(Spradling)首先开辟了这方面的研究。他们建立了一个以P因子为载体的果蝇红眼基因克隆,称为ryl。利用微注射法,将ryl与完整P因子(借以提供转座酶)注入属于M品系的白眼果蝇胚胎,得到了稳定遗传的红眼果蝇。研究还表明红眼基因可以进入基因组中的多个位点,有几份拷贝这显然比借助同源重组导入外源基因的效率高多了。研究者现已成功地以P因子为载体,在果蝇中转入了11种基因。它们是:红眼基因、白眼基因、肌动蛋白基因、幼虫血清蛋白基因、卵黄蛋白基因、多巴脱羧酶基因、绒毛膜蛋白基因、醇脱氢酶基因、热震蛋白基因(heat shock gene)hsp70和另外三种细菌基因。1984年,贝仁南(Brennan)把P因子转入黑腹果蝇的一个远缘种——Drosophila hawaüensis也获成功。这一切似都表明P因子可望作为基因转化的载体。但有一个问题大大限制了P因子的应用。这就是在果蝇中,P因子的活性只限于生殖细胞,在体细胞中没有活性。拉希(Lashi等,1986)的研究表明,P因子转座活性的组织特意性是在mRNA的剪切加工阶段进行调控的。其依据有以下三点:第一,P因子的启动子在任何细胞中都是活动的,因为在成虫头部也可找到P因子的转录产物,说明P因子转座活性的组织特异性不是由启动子控制的;第二,RNA分析表明,在0—12小时的胚胎细胞中可找到第一、二个内含子,却找不到第三个内含子;第三,如果在完整P因子的第三个内含子两端引入突变,使第三个内含子在转录后不能剪切,也就不能产生转座酶活性。从而推断P因子转座活性只限于生殖细胞,是由于在生殖细胞内能切除第三个内含子,而在体细胞内则不能。因此,如果使果蝇的体细胞以及哺乳动物细胞也能精确地切除第三个内含子,则P因子就有希望成为高等生物的基因载体而得到广泛的应用。
参考文献篇(略)