环状RNA分子
在研究分离的细胞核内Pre-rRNA拼接反应的同时,我们还探索以后拼接现象;在分离的四膜虫核中切除的IVS RNA转变成一个环状RNA分子。经蛋白酶和各种变性剂处理后,环状形态择以幸存意味着它是一个共价闭合的RNA环链。当Paula Grabow-Ski(当时我的一位研究生)鉴定环化反应特征时发现,在简单的MgCl2缓冲溶液里,它的出现伴随着RNA在很大程度上的脱蛋白作用。当时,我把她的无蛋白环化作用的原始观察结果看成是一种线性BNA不完全变性的人工赝象而给忽略了。然而,当证实这些实验是能够重复的时候,我开始致力于缓解认识过程中的矛盾,即研究拼接和环化两种不同反应的两位学者Zuag和Grabowski都发现,在无附加蛋白质的条件下,反应中存在着催化活性。无论怎么说,两个令人费解的实验结果要比只有—个莫名其妙的事实更令我欣慰。当我发现,经历了自拼接反应的质粒转录产物产生了发生环化的IVS RNA时,这两种现象便被联系在一起。环化的IVS RNA不是通过线性分子两个末端衔接起来的,而是线性的IVS3'端羟基攻击它5'端附近区域的一个磷原子,在环化过程中切除一小段寡核苷酸(图2)。于是,通过转酯酰基就产生像RNA拼接反应那样的环化反应。
RNA是如何行使催化功能的?
乍看上去,RNA似乎不适宜用作催化剂,因为具有4个非常相似的碱基,在构成一个专一性底物束缚区的能力方面RNA好像会大大受到限制。蛋白质则与之形成鲜明对照,20种氨基酸可以构成各种大小不同的分子和形状,它们可以具备亲水和疏水性。从助催化化学过程来看,RNA在近中性pH范围内缺少可解离的官能团,而蛋白质含组氨酸和半胱氨酸(其pKa落在6 ~ 8内)。那么,四膜虫的IVS怎样才能催化转酯酰基反应呢?
首次窥探它的催化机理来自对在反应中鸟苷需求现象的细致研究。Brenda Bass检查了每个可以利用的鸟苷同系物,结果发现它们的活性各异。一些同系物在鸟嘌呤的7或8号位置上或在核糖的5'位置上携有大量可替换组分,它们与鸟苷的活性相同。这表明,这些位置与IVS RNA不产生相互作用。另一些衍生物虽具有全部活性,但仅在高浓度时如此;或者作为鸟苷反应的竞争性抑制剂的底物,它们没有活性。根据这些鸟苷同系物的Km或Ki 值,我们便能够计算出鸟苷各功能团的自由能。所有这些数据表明,IVS含有一个鸟苷适宜的束缚部位。最近Michel等人的出色工作已在IVS内确证了这一部位。
鸟苷结合部位的存在解释了鸟苷需求的高度专一性现象。除此之外,通过使与5'拼接位置的磷原子有关的亲核物质定向,G部位在加速反应速率方面做出了主要贡献。RNA的催化作用马上就柳暗花明了;一个专一性的酶——底物复合物的形式导致熵减和参与反应基团的定向作用是蛋白酶催化作用的重要特征。
在转酰基过程的第一步,另一反应物,5'拼接位置上的磷原子也以某种方式处于束缚的相互作用之中,正如Davies等人首次推测的及Michel等人提出的几个反应模式中所描述的那样,IVS内5'端外显子联结部位的碱基与5'端外显子最末尾的少许核苷酸配对。这种配对的相互作用使鸟苷的渗入位置具有了专一性,同时也把5'端外显子置于拼接反应的第二步一一外显子连接——的适宜部位。
在使参与反应的各基团仅处于一定部位方面,IVS扮演了主角。在鸟苷缺失条件下,拼接位点的磷酸二酯键发生专一性水解,产生5'磷3'羟末端。自拼接反应的产物与之相同,但KNA的随机碱裂解产物则与之相反。这种位点专一性水解反应表明,IVS的催化中心能够激活拼接位点上的磷原子(或许激活亲核物质,这样它一定能激活OH-和鸟苷分子上的羟基)。虽然激活反应的结构基础仍未明了,可是合理的假设应包括磷原子5个配位过度态的结构和Mg2+的专一性配位结构。此外,RNA催化剂应该基本上吻合蛋白酶的催化方略,或反之亦然,这样才具有普适意义。
无独有偶的四膜虫IVS
虽然有的放矢地确定了四膜虫IVS拼接的性质,但是我们也渴望了解在其他生物体内何时(或许是否)会发现有关的插入序列。拼接部位附近核苷酸序列的差异似乎使四膜虫的rRNA拼接不可能与核的tRNA或mRNA拼接发生联系。在一未曾料及的方面发现了有关的插入序列:酵母线粒体DNA。没有想到这一点是因为,被认为是由共生原核生物衍生而来的线粒体通常不含有与真核生物相似的基因或基因表达方式。此外,在进化上酵母与四膜虫相距甚远。
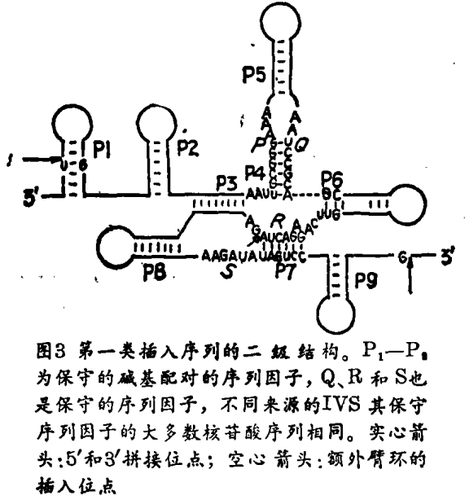
1982年有些研究小组确定了几个短小的序列因子,它们存在于一类真菌线粒体的插入序列中。此外,Michel和Davies各自的实验室都做过推断,这些保守序列区域相互作用构成了一组共同的碱基配对短区,以便把这些插入序列折叠成基本相同的二级结构(图3)。Michel把来自细胞核的rRNA IVS称为第Ⅰ类内含子,以示与第Ⅱ类内含子的区别。后者是具有不同结构的线粒体内含子。
四膜虫rRNA的IVS包含有线粒体第一类内含子保守序列因子的和二级结构的特征。此外,通过各种核酸酶降解折叠的RNA,就切割位点来计算它们的最低自由能值。根据这种原理独立地构造出一个大同小异的四膜虫IVS的二级结构。
以前两个完全无关的设想汇聚在一起,其重要性有以下几点:第一,根据拼接原理,四膜虫内含子的存在是独一无二的观念现在看来已不能成立;通过该类内含子不同成员拼接反应的比较和对照,我们有可能扩展对其作用机理的认识。其次,现已经建立了一个四膜虫IVS二级结构的可信模型,因此人们能着手探索结构与功能之间的各种关系。第三,四膜虫rRNA和真菌线粒体的内含子之间的相似性可以揭示它们的起源疑案;也许它们是可转移因子,既能进入核DNA也能侧身于线粒体DNA中。
等待第二例证的出现
如果RNA催化剂对于生物学来说具有任何普遍意义,则会有一些附加例证。1983年秋天、我写了一篇文章,做了如下推测:
有几种酶,如RNase P,1,4 – α - 葡聚糖分支酶和马铃薯O - 联苯酚氧化醇,它们都具有对于酶促活性所必需的RNA组分。核糖体肽基转移酶活性也需要一个RNA - 蛋白质复合物。因此,有待于揭示RNA是否直接参与构建了其中任何一个核糖核蛋白酶活性部位的问题。
当论文于1984年发表时,对RNase P的推测已时过境迁了,因为在那之前,Guerrier-Takada等人已宣布,RNA组分是那种核糖核蛋白酶的催化亚单位。紧接其后,1984年早些时候他们又有一篇报道,以重组DNA为模板体外转录合成的大肠杆菌RNase P的RNA组分也具有内在的催化活性;至此,排除了催化作用是由于蛋白质参与的可能性。此外,有实验证明、枯草芽孢杆菌RNase P的RNA亚单位在体外同样能行使酶的功能。RNase P的发现令我们激动不已。它不仅提供了RNA分子降低专一性生化反应所需活化能的第二个例证,而且也首次证明,RNA分子在催化反应中其本身不发生任何改变。RNA的催化作用超越了分子内催化作用的限界。
次年,又出现了一些第;类插入序列发生自拼接反应的报道。Garriga和Lambowitz发现,脉孢菌线粒体编码的细胞色素b前体mRNA的第Ⅰ类IVS在体外发生了自拼接反应。Vander Horst和Tabak确定了几个酵母线粒体第;类自拼接RNA片段的性质。最出人意料的是,在T4噬菌体的3种mRNA分子中发现了自拼接的第一类IVS。在所有这些报道中,自拼接反应毫无例外地按照四膜虫核rRNA IVS鸟苷渗入途径的方式进行。
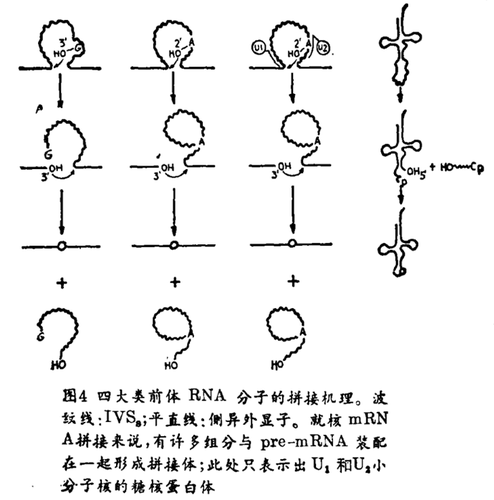
线粒体第Ⅱ类插入序列有着与第;类插入序列木同的保守序列和二级结构。Peebles等人和Vander Veen等人都发现,含有第Ⅱ类IVS的pre-mRNA可以在体外发生自拼接反应。该反应不需鸟苷,是通过形成分叉“套索”RNA结构发生的。
看起来第Ⅱ类RNA拼接反应的化学过程与核pre-mRNA的相同,后者不产生自拼接反应_相反,核mRNA的拼接需要具有蛋白质大复合物的底物与小分子核的核糖核蛋白体,两者经过适当装配而形成拼接体,这些拼接机理的相似性促使人们推测,核mRNA的拼接也是由RNA催化的,而且,在很大程度上是以mRNA的形式来完成催化过程的(图4)
酶学家的愤慨
虽然我们对RNA自拼接现象的阐释令众人惊诧不已,但很快便为科学界所认同。相反,用“催化作用”和“类酶”两个述语描述该现象却激起一些学者日益高涨的强烈反响。
强调RNA自拼接与生物催化作用之间的关系或许是我们对表1给出W催化剂定义内容更完善理解的原因。首先,生物催化剂可以使反应速率加速度达到108 ~ 1013数量级,从而使反应在对生命系统有利的瞬时范围内进行。自拼接反应显然符合这一标准;尽管只对由RNA催化的位点专一性水解反应做了定量分析,然而,甚至连这一相对缓慢的支反应速率也要比估计的没有催化的反应速率高1010倍。其次,在自拼接反应中,生物催化剂的高度专一性是显而易见的;IVS RNA在反应的第一步只选择GTP作为攻击目标,在pre-rRNA的6,000个核苷酸中也只能甄拣两处作为其拼接位点。另一方面,IVS RNA显然不能以与其开始参与反应完全相同的形式再生;自拼接的目的毕竟是为了把pre-rRNA转变成相互联结的外显子,同时切除IVS。虽然酶学家们的确阐述过分子内的催化作用,但我们认为这一述语尤适于描述自拼接反应。
览罢我们论文的三位酶学家对此却难以置信。这三位仲裁者以书面形式阐述了一些富有创见的观念,他们对实验数据虽颇感兴趣,但指摘我们对酶的认识过于天真。例如:
酶是真正的催化剂:它们虽然加快反应速率,但反应完成后本身不发生改变。于今之例,核酶在一步反应中行使功能,而且本身也改头换优。所以,它不再像真酶那样能够循环使用。这些作者对此一清二楚,但在进行二者的比较时对这一关键特征似乎置若同闻。
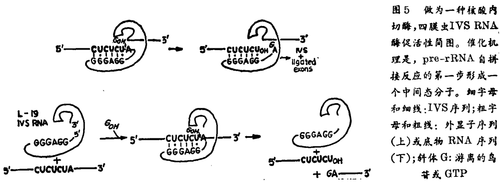
自拼接反应与催化反应之间的差别到底有多大?至今与6年前大同小异,议论纷纷,众说不一。为把这一“马拉松”式争论的问题搞个水落石出,我们决心通过实验测定自拼接的RNA能否转变成一个具多重转换功能的催化剂。Zuag把自拼接的IVS做了稍事修改,去除了它前头的19个核苷酸。结果产生的L-19 IVS RNA符合生物催化剂的全部3个标准(表1)。
四膜虫缩短形式的IVS具备多重酶促活性。根据所提供的不同底物,这些RNA酶能够催化核苷基转移反应,磷转移反应和水解反应;核苷基转移能导致的内源核苷酸裂解,或者聚合反应的发生。
举图5中的反应为例来考察这种反应。一种丢失两个拼接位点的IVS RNA按照类似于其正常形态5'端外显子的序列CUCU来催化其他RNA分子的裂解。反应产生一个RNA自拼接反应第一步的中间分子过度态,其中RNA的断裂伴随着鸟苷共价联结至3'裂解产物的5'端上。因为IVS RNA经反应后没有发生改变,所以它能束缚并催化大量的底物RNA分子。含有CCCUCU识别序列的一个寡核苷酸底物,其裂解的Kcat/Km值为108M-1min-1,恰恰是在蛋白酶催化加速反应的数量级内。
用物理方法从自拼接RNA的催化中心分离其内部底物,从而把它转变成一个RNA酶的方法已普获成功在植物感染源(类病毒或一些病毒卫星RNA分子)中发现的“锤状”和“发荚”型两种核酶,经历自身断裂可以产生2',3' - 环化磷酸末端。二者均转变成RNA酶。在一个分子间过度反应中,第Ⅱ类IVS能裂解含5'拼接位点或待联结外显子的RNA,虽然在这些实验中并未揭示出多重转换功能。tRNA的分子间导向裂解反应甚至能够转变成一个酶促系统。一个具有结构的RNA. 分子的部分片段能行自组装,再生一个活性单元,因此似乎具备了RNA二聚体的一般性质。此外,如果历经反应的该分子片段通过像少数碱基配对这样的极弱相互作用而结合到该分子的其他部位上,它将会迅速分解而足以完成多重转换功能。
生命起源的新奇设想
RNA自拼接现象及RNase P中RNA组分的酶促活性的发现再次掀起了生命起源中RNA扮演主角的早期种种推测浪潮。今天,细胞的生存依赖于核酸与蛋白质复杂的相互作用,前者是生命信息的载体,后者为复制和表达生命信息的催化剂。可以肯定,第一个出现的自繁殖生化系统必然需要信息分子和催化分子。于是我们陷于两难境地,二者之中孰为先?核酸还是蛋白质?信息还是功能?以往人们偏爱的是核酸与蛋白质共进化假说。现在,RNA既能做催化剂又可以携带信息,这一事实使另一解释似乎更为合理;最早出现的自繁殖系统很可能仅由RNA自身组成。
也许是巧合或可能因其祖先存在的缘故,四膜虫IVS RNA酶催化的反应之一是一个核苷酸的转移反应,它基本上与RNA复制酶所催化的反应相似。根据四膜虫IVS RNA催化中心的某些性质推断可以勾勒出RNA自拼接反应的特征模式。RNA酶与L-19 IVS RNA不同,后者利用外部而非内部模板,从具保留活性的该RNA催化中心的其他序列中分离出模板区段的工作最近由Doudna和Szostak完成。
既然我们已经认识了具催化作用的RNA分子,那么回顾早期对具催化潜能RNA的一些推测便饶有趣味。以下论述则为一典范:
…在进化系统中,具有折叠结构的RNA被偏爱蛋白质的大自然抛弃。核酸分子虽然可以完成原始细胞中的许多酶促过程,但由蛋白质来履行催化功能则比它要有效得多。…核酸分子中的4种碱基都只具有一种结构类型,尽管许多修饰碱基的存在是进化增殖的征兆,它们把构成不同核酸结构的可能性增大了许多。然而,碱基的利用无法与20种氨基酸产生的巨大灵活性比拟,后者可以有三或四种不同的结构类型。
—种理解是,如果核酸可能具备任何一种酶促活性,它们就不会是理想的催化剂。过去我曾有过与此相似的念头,但是,当我们定量分析了四膜虫核酶催化中心固有的反应速率加速度和专一性之后,对这种解释的偏爱也就逐渐烟消云散了。
在我看来,关于RNA催化剂有限能力的第二种结论至今仍是正确的。在全部经完善实验证实的例证中,RNA催化剂或核糖核蛋白酶的底物是RNA或DNA,或者是与核糖体上蛋白质合成密切相关的氨酰tRNA。RNA能够形成至少一个氨基酸的专一性结合部位,而且有证据表明,末端蛋白与脊髓灰质炎病毒RNA的共价联结反应至少是部分RNA催化完成的,这足以使RNA作为催化剂的事实更加光彩夺目。即:使如此,RNA好像不可能与由氨基酸侧链形成的大量底物结合部位一见高低。目前,RNA催化剂的种类仍在迅速增长。然而,如果列出更完备的所有生物催化剂的名录册,它将包括更多的蛋白质和较少的RNA,这似乎是不言而喻的。
[Angew. Chem. Int. Ed. Engl,1990,29:759—768]