来自细菌体的毒素是这套编辑体系的王牌。
CRISPR–Cas9基因编辑对生命科学领域的贡献有目共睹,不过还在蓬勃发展中的它依然有不少难点尚未攻克,“线粒体DNA(mtDNA)编辑”就是其中一个重大难点。
很多科研人员试图打破此局面。最近有捷报传来:有人跳出了CRISPR–Cas9的传统框架,借助一种独特的细菌酶实现线粒体中DNA的编辑,2020年7月8日研究成果刊载在《自然》(Nature)杂志上。
当然,很多人会有两个疑问:其一,我们为什么非要去编辑线粒体里那些少得可怜的DNA?其二,为什么线粒体基因要比细胞核里的基因难编辑得多?
何为碱基编辑
针对第一个问题,需要指出,mtDNA量虽少,但突变起来仍极具杀伤力。mtDNA在发生突变后,很可能引发某些母系遗传的特定疾病,往往会对神经系统和肌肉造成损伤(线粒体也容易因此丧失制造ATP的能力)。
第二个问题里的难点在于线粒体的保护屏障。目前人类可以借助CRISPR-Cas9对几乎每一个实验生物体的基因组进行调整——但这类操作要成功,有个重要环节不能少:研究者需要用一串特定的RNA链将Cas9酶引导至他们希望编辑的那个DNA区域。
Cas9酶很重要,负责目标区域的DNA双链解旋,令其成为可编辑的两条单链(局部而非整体解旋)。在操作细胞核DNA时,这一切都没问题;但当面对线粒体时,包覆在外的双层膜会把Cas9酶挡在外面。所以问题的核心就是重要人员进不去线粒体。
目前有一些科学家希望基于一种超高精准度的基因编辑系统——人称碱基编辑,解决线粒体基因编辑难题。
在详述如何让编辑工具进入线粒体内部之前,我们先介绍一下这个碱基编辑技术。顾名思义,操作者要对基因组里的单个碱基进行更改,如把胞嘧啶变成胸腺嘧啶。相比于一段一段地更改基因序列的常规基因编辑,精准操控每一个碱基的碱基编辑看起来已经把CRISPR的概念推到了极致。
2018年底,哈佛大学华裔科学家刘如谦收到一封电子邮件。信中来自华盛顿大学的微生物学家约瑟夫•穆格(Joseph Mougous)和同事在西雅图做实验时,发现一种由洋葱伯克氏菌(Burkholderia cenocepacia)产生的毒素具有催化作用,可以将胞嘧啶(简称C)转化为尿嘧啶(简称U)。
在DNA中不常见的U有着与胸腺嘧啶(简称T)相似的行为,所以如果转化得到了U,在某种程度上就可以当作是得到了T。简单一句话:来自洋葱伯克氏菌的毒素可以有效地将基因组序列中的C转化为T。
顺着与穆格差不多的思路,刘如谦等人借助类似的酶实现了碱基编辑。该酶是胞苷脱氨酶的一种,而胞苷脱氨酶也是一种细菌毒素。
弃Cas9,用DddA
以上这些都只是在理论上建构出了碱基编辑的体系,但要在现实中完成线粒体内的碱基编辑就很难了。穆格和刘如谦的酶都存在缺陷:通常只能对解开了螺旋的DNA单链进行碱基更改。这自然引出了前文提到的Cas9酶难题:要想解旋DNA,就得带上Cas9酶;可带上了Cas9酶,就进不去线粒体。所以他们需要另觅他法。
不久后,穆格这边有了好消息。他们发现了一种名为DddA的酶(胞苷脱氨酶的一种,双链结构)可以直接作用于双链DNA,无须依靠Cas9酶解旋。DddA开展工作时,能让双链DNA始终完好如初,润物细无声地完成“篡改”。
刘如谦和穆格一致认为,舍去Cas9酶,让DddA单枪匹马地杀向线粒体,就可以避开其外部膜的阻挡直捣基因组。最后的结果也确实如他们所愿。
不过在实际调用DddA的过程中,也存在不少难点。其中最主要的问题在于胞苷脱氨酶的本质是毒素,对哺乳动物的细胞有毒:DddA会把目力所及的全部胞嘧啶(C)都变成胸腺嘧啶(T),脆弱的生命体经不起这么狂躁的大换血。
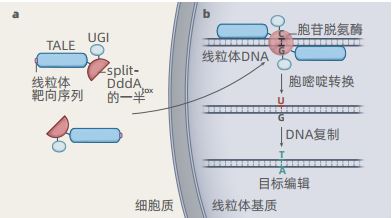
要让DddA为基因编辑所用,就要先“驯服”它。研究团队将它分解成了两部分(名为split-DddAtox):彼此分离时,则均处于无活性状态,对碱基不构成威胁;合体后,DddA就可以大展拳脚。另外,他们给两个split-DddAtox都连上了TALE蛋白,进而成为TALE–split-DddAtox。
在一起进入线粒体之后,TALE蛋白会连接上目标DNA片段,接着两个split-DddAtox也可以顺势合体,然后把C们转化成T们。
另一个关键环节是带路的向导。TALE-split-DddAtox需要有人领着它穿过内外两层的线粒体膜,然后找到mtDNA。刘如谦等人给TALE-split-DddAtox标记了一段氨基酸序列,作为线粒体靶向信号,帮助前者顺利抵达最终目的地。
换言之,他们用氨基酸序列代替以往的RNA,充当向导一角。实际上,有研究者认为,常规的CRISPR–Cas9 之所以没法搞定线粒体的DNA,除了Cas9会被挡在外面,RNA向导不受线粒体欢迎可能也是原因之一。
还有一个问题来自于这个假T碱基。前面我们说过,酶实际上是把C变成了U;又因为U具有与T相同的碱基配对特性,所以我们才把它当成T来看待。本质属于RNA的U在成为DNA链的一分子之后,会遭遇麻烦:尿嘧啶DNA糖苷酶(uracil-DNA glycosylase)总想把U干掉,再换上C。
鉴于此,研究团队给TALE-split-DddAtox又加了一层保险:尿嘧啶糖基化酶抑制剂(UGI)。不仅保护U免受干扰,还将胞嘧啶的碱基编辑效率提高了8倍。
有望矫正49%的有害mtDNA突变
综上,我们得到了一套超凡的线粒体基因编辑装备,研究团队称其为DdCBE。它是这样工作的:TALE-split-DddAtox跟着一段氨基酸序列,通过线粒体的双层膜,抵达mtDNA处。接着,TALE蛋白锁定并连接mtDNA上的目标区段。与此同时,两个split-DddAtox合二为一成为DddA,开始启动更改碱基的程序。
DdCBE及其正要进入的线粒体区域的示意图
脱靶效应,即非预期位点的DNA修饰,是CRISPR-Cas9基因编辑的一个常见问题。在分析比对了编辑后的细胞与对照组细胞后,他们发现前者的细胞核中并未出现预期以外的DNA修饰。
研究团队在论文里报告指出,这一套编辑体系有望矫正49%的已知有害mtDNA突变。
当然,刘如谦认为这项工作距离临床应用还差很远。尽管他们现阶段的脱靶情况不明显,但更多针对不同细胞类型的尝试必不可少。
资料来源 Nature