2020年诺贝尔科学奖的得主证明了黑洞的真实存在,创造了基因编辑这项改造生命的神奇方法,发现、鉴定并解析了丙型肝炎病毒。
对于那些取得重大成就的科学家来说,十月的第一周内会出现紧张时刻,因为他们或许会接到来自瑞典斯德哥尔摩的电话。那些宣布诺贝尔科学奖花落谁家的机构——颁发生理学或医学奖的卡罗林斯卡医学院与颁发物理学和化学奖的瑞典皇家科学院——通常需要一两个小时甚至更久来完成奖项公布以及介绍获奖者非凡成就的流程,而他们选定的颁奖时间也略引微辞,因为他们拨打电话的时分,正值北美某些地区科学家的睡梦阶段。不过相比于斩获科学领域的最高荣誉,损失些睡眠当然无足轻重。
遥望黑洞
英国所处的时区带给了他们的新科诺奖得主以很大的方便。牛津大学的罗杰·彭罗斯(Roger Penrose)爵士家中的电话响铃时,他正在洗澡。这位89岁高龄的数学物理学家与来自加州大学洛杉矶分校的安德莉亚·吉兹(Andrea Ghez)和伯克利分校的莱茵哈德·根策尔(Reinhard Genzel)分享了大奖。彭罗斯对黑洞进行了理论解释,其余两位则发现银河系中心的超大质量黑洞。
2020 年诺贝尔物理学奖得主
众所周知,黑洞的密度是如此之大,以至于包括光在内的所有物质都难逃其巨大的引力。黑洞的中心名唤奇点,被认为是一个密度无穷大的点,在那里,已知的物理定律不再适用。这些预测来自爱因斯坦于一个世纪前提出的广义相对论(它实际上是一个关于引力塑造宇宙的结构和内容的理论),而一些科学家经过早期的研究,认为黑洞只可能来源于完美对称的恒星或气体云的坍缩,但这种情况又不符合现实——爱因斯坦自己也怀疑它们是否真实存在。
因此黑洞理论自提出后,始终扑朔迷离,直至1965年,当时尚未被授予爵位的彭罗斯博士解析出了真实物质在坍缩中形成新物质的过程。他提出了一个名为“俘获面”的数学概念,并以此证明,即使是不对称的巨大恒星和尘雾(dust clouds)也可以形成黑洞。这项工作为天文学家寻找黑洞提供了理论依据。
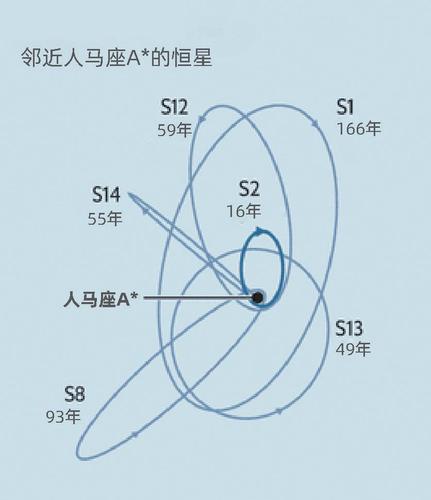
根据定义,直接观察黑洞是不可能实现的。物理学家们通过观测分析其引力对相邻恒星运动的影响来建立关于黑洞的认知。吉兹博士和根策尔博士通过这种方式证明了人马座A*——位于银河系中心的明亮的无线电波源——实际上是一个超大质量的黑洞,星系里包括太阳在内的所有恒星都围绕它运行。
吉兹博士和她的团队在夏威夷通过凯克天文台望远镜(主反射镜宽达10米)进行了观察。根策尔博士的团队则在智利阿塔卡马沙漠的高山上开展观测,他们所用的一系列望远镜主反射镜宽8米。上述望远镜都足以穿透云层窥视银河系的中心。
两个研究团队在过去的30年里各自独立工作,追踪了银河系中心大约30颗最耀眼的恒星(如上图所示)。其中一颗名为S2的恒星需要16年才能绕行人马座A*一圈,二者最接近时的距离为17光时。通过这些观测,天文学家们拼凑出了一张人马座A*的照片——它是一个质量约为太阳400万倍的黑洞,被压缩在一个太阳系大小的空间区域中。
2019年4月,黑洞图像首次发布——并非人马座A*,而是距离地球5 300万光年,质量约为太阳65亿倍的M87星系中心的黑洞。该图像通过事件视界望远镜(简称EHT)拍摄并处理得到。EHT借助甚长基线干涉技术(简称VLBI)结合分布于世界各地的8个射电望远镜,构成了一个口径等效于地球直径的虚拟望远镜;8个“分镜”联合观测同一目标源并记录下数据,其分辨率远高于任何单个设备所能达到的水平。随着技术进步,或许有一天事件视界望远镜也能提供人马座A*周围区域更全面的图像。
修改生命
一如往常,化学奖颁给了一项也适合拿医学奖的研究——基因编辑。获奖者是来自德国马克斯·普朗克病原体科学研究所的伊曼纽尔·卡彭蒂耶(Emmanuelle Charpentier)和加州大学伯克利分校的詹妮弗·杜德纳(Jennifer Doudna)。
2020 年诺贝尔化学奖得主
CRISPR源自一种细菌防御机制:细菌会从病毒入侵者那里剪下一小段DNA序列,并将其复制到自身基因组中,从而创建出一个“剪贴簿”;如果同样的病毒再次出现,细菌就可以依据剪贴簿识别出它们。两位获奖者将这套机制开创性地应用到了生命体基因的修改上,她们打造的基因编辑工具已经被用于设计抗病作物以及新型癌症疗法,或许还有望终结遗传疾病。
如果基因组可以被看作是某个生物的生命之书,那么CRISPR技术便是能在这本书里识别、选择、删除和替换任何特定单词序列的文本编辑器。编辑者先设计出可与目标DNA序列匹配的向导RNA,接着让它与Cas9酶一起奔赴目的地,到位后的Cas9酶能剪开DNA螺旋,之后,具体的编辑工作便可以展开了。
2011年,在细菌体内发现了某种神秘RNA片段的卡彭蒂耶博士策划了一场与掌握了DNA剪切技法的杜德纳博士的会面。她们两人的合作进展迅速,硕果累累,为此后该技术在医学领域的应用奠定了基础。
不过基因编辑技术一直因伦理问题而饱受争议。2018年的“基因编辑婴儿”事件将这一技术推上了舆论的风口浪尖。当时还是南方科技大学副教授的贺建奎通过CRISPR技术编辑了一对双胞胎女孩的胚胎。编辑思路是通过使胚胎内编码某种蛋白质的基因失效,以诱导出机体对HIV的免疫(此蛋白质是HIV进入细胞的基础)。全球学术界对这项编辑人类胚胎的研究感到震惊和愤怒,并指出该实验在技术上存在明显缺陷,给实验对象带来了长期的健康风险,其出发点和必要性更是令人质疑。而贺建奎本人于2019年年末,因实施中国明令禁止的以生殖为目的的人类胚胎基因编辑活动,构成非法行医罪,被判处有期徒刑三年。
技术的专利归属以及它带来的利益归属也是一个复杂的问题。多年来,加州大学和麻省理工学院-哈佛大学博德研究所一直就基因编辑技术归属权的问题争执不下。瑞典皇家科学院把诺奖授予杜德纳和卡彭蒂耶,实际上已经表明了他们在归属争议上的态度。
解密丙肝
生理学或医学奖颁给了一项老派的医学研究——丙型肝炎病毒的发现、鉴定与解析。
肝炎有两种主要形式:一种是由甲型肝炎病毒(HAV)引起的急性疾病,病原体通过受污染的水或食物传播;另一种则由乙型肝炎病毒(HBV)或丙型肝炎病毒(HCV)导致。HBV和HCV主要通过血液传播,侵入宿主肝脏,严重感染者可能有生命危险,它们通常引发慢性疾病,可能会发展为肝硬化和肝癌。据世界卫生组织估计,全球有7 000多万人感染丙型肝炎,每年有40万名患者死亡。肝炎已经成为全球健康问题之一,而血源性肝炎是全世界肝硬化和肝癌的主要原因。
过去,丙肝病毒给输血工作带来了不小风险,因为那时人们无法判断某一批血液内是否存在HCV;而现在的情况全然不同,这在很大程度上要归功于2020年的获奖者——哈维·奥尔特(Harvey Alter)、迈克尔·霍顿(Michael Houghton)和查尔斯·赖斯(Charles Rice)的工作。
2020 年诺贝尔生理学或医学奖得主
奥尔特博士最早确证了丙肝病毒的存在。20世纪60年代,他的同事巴鲁克·布伦伯格(Baruch Blumberg)发现了乙型肝炎病毒,并因此于1976年获得了诺贝尔奖,之后更是研制出了乙肝疫苗。1973年,甲型肝炎病毒也在电镜下进入人类视野。
然而,人们虽已能够筛查出血液中的HAV和HBV,但输血引发肝炎的情况仍然存在。当时在美国国立卫生研究院工作的奥尔特与同事研究了接受输血的患者的肝炎发生情况,结果发现有近80%的肝炎病例既非乙肝又不属甲肝——这意味着有第三种肝炎病毒以血液等体液为传播途径,隐匿在人群中无声地传播,成为影响输血乃至人类健康的潜在风险。
1978年,奥尔特等人发现患者的血液可以将病原体传递给黑猩猩,使其患上肝炎。他们将其命名为“非甲,非乙”肝炎。1989年,霍顿博士在Chiron公司利用分子生物学克隆技术分离出了HCV的核酸片段。(Chiron是当时一家位于加州的生物技术公司,后被瑞士制药巨头诺华公司收购。)
霍顿等人从被感染黑猩猩的血液中获得核酸,并提取到DNA片段,其中大部分来自黑猩猩自身基因组。但他们推测有一小部分可能源于某种未知的肝炎病毒,并将其与感染人群产生的抗体进行了对比。经过全面搜查,霍顿和同事们最后确定了来自某种新型RNA病毒的阳性克隆就是他们寻找的目标,并将其命名为丙型肝炎病毒。
鉴别出丙型肝炎病毒非常关键。但新的谜团又摆在了科学家的面前:丙肝真的是仅由HCV这一种病毒引起的吗?为了回答这个问题,科学家不得不通过克隆的病毒研究这种HCV能否复制并致病。
华盛顿大学的赖斯博士和同事发现丙肝病毒基因组末端的一个未知区域(突变能力极强)可能对病毒复制至关重要。他们推测这些突变可能会阻碍病毒复制。借助基因工程技术,赖斯等人获得了未失活丙型肝炎病毒的变异体(这种变异体包含在病毒基因组发现的那个新区域),并将这种病毒注射到黑猩猩的肝脏中。之后,研究人员在它们血液中检测到病毒,并观察到它们出现了与慢性病患者相似的病理变化。这些成果有力证明了丙型肝炎病毒就是引发当时那个难以解释的血源性肝炎的唯一元凶。
三位新晋诺奖得主在丙肝病毒方面的工作可以说是里程碑式的医学成就。因为他们的发现,我们现在可以对HCV做高度敏感性的血液检测,从而基本排除了发生输血后肝炎的风险;也因为他们的发现,针对丙型肝炎的抗病毒药物的研发工作进展神速。
资料来源 The Economist