作为一种临床诊断技术,磁共振成像为人体内部疾病诊断提供了无与伦比的灵活性。
1977年,雷蒙德 • 达马迪安(Raymond Damadian)、迈克尔 • 戈德史密斯(Michael Goldsmith)和劳伦斯 • 明科夫(Lawrence Minkoff)观察到癌变组织和健康组织会产生不同的核磁共振(nuclear magnetic resonance , NMR)信号,受到这一现象的启发,他们对人体进行了首次磁共振(magnetic resonance imaging, MRI)扫描。早期的临床MRI扫描耗时几个小时,并且空间分辨率很低,但是对于辨别健康组织和病变组织已不可或缺。问世40年,MRI已成为大小医院和诊所的必备诊断工具,并且已应用于图像引导的干预和手术、放射治疗、聚焦超声等。同时,技术进步推动了MRI扫描仪性能的发展,提高了扫描速度和成像的空间分辨率。
在MRI技术发展的前沿,研究工作聚焦于快速、定量成像。除了解剖结构外,临床诊断对功能信息的需求日益增长,如心肌收缩、脑活动、肿瘤的化学浓度、进出组织的血流等信息。新的MRI技术还必须保持患者的舒适性和安全性。众所周知,MRI可以使患者免于电离辐射,但并非毫无危害。
MRI工作原理
把生物组织置于磁场中时,具有磁矩的原子核就会磁化。然后施加与原子核的共振频率(又称“拉莫尔频率”)一致的射频脉冲,使原子核的排列方向与外部磁场不一致,而绕着磁场进动。进动的核反过来感应出拉莫尔频率的振荡磁场,这些振荡是通过在附近线圈产生电动势的法拉第感应探测到。
实际上,许多原子核必须彼此同相进动才能产生可检测的信号。进动核之间随着时间产生的相位相干性损失称为“T2弛豫”。在外部磁场的作用下,原子核的排列方向最终回到其平衡状态,这个过程称为“T1弛豫”。早期的NMR实验表明,各种组织具有不同的T1和T2弛豫时间。对于某些疾病,包括癌症,T1和T2任一时间的变化都可以用来辨别病变组织和健康组织。当病变组织与周围健康组织对X射线的吸收相似的情况下,就难以使用X射线造影或X射线计算机断层扫描(CT)进行检测,这时NMR的这一特征就非常有用。
在NMR测量中,可以选择施加射频脉冲和读出来自组织的射频信号的时间,以便由最短T1弛豫时间的组织产生最强信号。以这种方式选择时间的测量称为“T1加权测量”。或者,也可以选择脉冲序列时序,使最强信号来自具有最长T2弛豫时间的组织,这就是T2加权结果。
在组织中,氢核是数量最丰富的可磁化核。它的旋磁比为42.56 MHz / T,因此对于1.5 T和3 T 的MRI扫描仪,其运转的拉莫尔频率分别约为64 MHz和128 MHz。目前,范围介于0.2 T到7 T之间的磁体用于临床扫描,在研究环境中则可以进行高达10.5 T的人体扫描。
空间编码
使用来自组织的NMR信号进行临床诊断,需要将信号在三维空间进行定位才能成像,MRI扫描仪中的三组电磁梯度线圈完成了该任务。每个电磁梯度线圈分别沿三个正交轴产生线性变化的磁场,并且可以根据所施加的电流来打开和关闭每个梯度,以产生不同的磁场强度。梯度场叠加在主磁场(通常为1.5 T或3 T)上,从而产生随空间位置变化的拉莫尔频率。如果在一段时间应用了某一梯度然后关闭,则所有信号都具有相同的频率,但是信号在梯度打开期间累积的相对相位会发生变化,因为信号的相位会根据在梯度轴上的位置而变化。
频率编码(当应用梯度场时采集NMR信号)在一个空间维度上产生随空间位置变化的共振频率。相位编码是沿一个轴施加梯度场一段时间,然后在采集NMR信号之前消除梯度场。在MRI中,沿着相互垂直的两个轴分别进行频率编码和相位编码,从而在二维空间对信号进行定位。
梯度还可以对组织的断层扫描切层进行选择性成像。通过在切层平面上施加正交磁场梯度,可以改变原子核的共振频率,以便仅将感兴趣切层中的共振频率与用于激发组织的入射射频磁脉冲的频率匹配。许多临床MRI使用该方法。当依次进行面内频率和相位编码以及数据读出时,只有那些在所需位置且在所选切层厚度内的核才会产生信号。
早期的MRI使用各种技术在空间上排列信号以产生图像。但是,保罗 • 劳特布尔(Paul Lauterbur)和彼得 • 曼斯菲尔德(Peter Mansfield)开发的空间编码方法已成为当今临床MRI的标准,他们在2003年获得诺贝尔生理学或医学奖。磁共振扫描通常是涉及切层选择性激发的迭代过程,然后进行相位编码、频率编码和信号检测,如此这般重复数百次,才产生一张组织的切层图像。每次,临床医生使用不同的相位编码梯度强度,采集每个周期内组织发出的射频波形,然后将其存储在称为“k空间”的矩阵的一行中,该矩阵以波数或空间频率命名。
梯度空间编码具有将来自组织的信号变化分解为空间频率的傅立叶级数的效果。所采集的射频波形表示信号强度的空间频率,并且k空间数据的2D傅立叶逆变换可以产生组织的二维图像。使用快速傅立叶变换技术,可以快速高效进行MRI图像重建,并且在扫描完成后几乎立即会在屏幕上显示数十乃至数百张图像。
在MRI扫描中,射频发射器、接收器和梯度线圈的激发次数和相对时间形成脉冲序列。该序列是确定所采集信号量和编码在图像中的NMR信息类型(例如对比度加权)的配方。

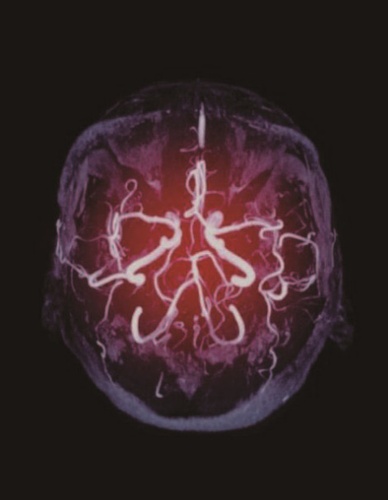
图1 T1加权(左)和T2加权(右)的大脑MRI
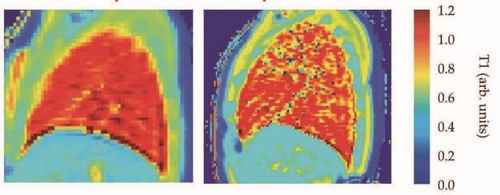
图2 健康志愿者(左)和囊性纤维化(CF)患者(右)的肺部定量T1 MRI
由训练有素的放射科医生对加权图像进行定性评估是有效的诊断工具(示例参见图1),但是为了改善诊断,医生越来越关注组织参数的定量测量。水扩散率和化学浓度可以定量测量。但是,T1和T2加权图像中的信号强度通常是相对的,不能表示成像组织中T1或T2弛豫时间的绝对定量测量。这样的测量是可能的,并且进行该测量的有效技术是研究的热门领域。图2显示了正常和囊性纤维化患病肺组织的定量T1测量值的差异。由于信号水平本来就很低,因此很难使用定性MRI对肺组织进行成像,但是定量T1图可清晰显示疾病。
T1是指使组织中的原子核在磁场中恢复到其平衡排列状态所需的时间,而T2是指原子核失去其相位相干性所需的时间。可以选择射频脉冲的时间,使MRI信号来自具有最短T1时间或最长T2时间的组织。这些不同的脉冲时间形成的图像说明:在同一组织中,如何调节MRI以产生不同的信号强度。充满液体的心室(箭头)在T1加权图像上比大脑组织暗,在T2加权图像上比大脑组织亮。
CF患者肺部的T1值较低,表明流向瘢痕肺组织的血流减少。研究人员希望使用这些T1的测量值来监测疾病进展和治疗效果。
造影增强
在X射线成像中,放射科医生可以使用造影剂(例如钡和碘)填充血管、肠道等难以看见的结构。在血液中流动的造影剂会极大减弱辐射,并使血管本身的成像以及组织中血液输送位置的确定变得非常容易。
在MRI中,主要的造影剂是钆,它能与各种分子结合以防止与人体发生毒性相互作用。游离的Gd3+离子与Ca2+ 代谢竞争。顺磁性的钆核形成强大的局部磁场,并大大缩短附近氢核的T1弛豫时间。结果,如图3所示,液体或组织中的钆造影剂增加了T1加权MRI的局部亮度。
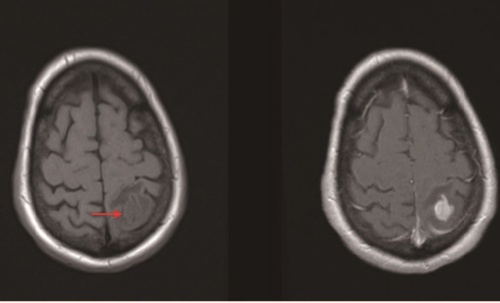
图3 没有(左)和有(右)钆造影剂的大脑的T1加权图像
肿瘤(箭头)在没有造影剂的情况下只是轻微可见。肿瘤中形成的新血管导致大量吸入造影剂,使得肿瘤在造影增强的图像中更加明显可见。
几种商业的钆类造影剂常常用于所有身体部位疾病的MRI检查中,两个主要的安全问题是螯合物的稳定性和造影剂在组织中的残留。经过很长一段时间后,大多数螯合物最终会分解并释放出游离的Gd3+离子。如果此过程的持续时间比造影剂从体内清除的时间长得多,则不用考虑安全问题。但是,如果造影剂在组织中保留的时间足以使螯合物分解,则毒性确实会成为问题。最近的研究表明,某些组织保留钆类造影剂的时间,可能比人们以前怀疑的时间要长得多。
快速成像
在MRI中,获取图像需要时间,每个图像通常需要2-5分钟。采集扫描数据时,患者经常必须以不自然的姿势躺着不动。某些扫描受到患者非自愿运动(心跳或肠道蠕动)的影响,为了捕获那些运动结构的清晰图像,快速扫描至关重要。医生可以指导患者控制呼吸和吞咽,但是患者能确实屏住呼吸或保持静止的时间有限。
为了缩短扫描时间,可以牺牲很多图像质量参数,但是这样做可能会限制医生做出自信诊断的能力。缩短扫描时间还会降低空间分辨率,生成颗粒状有斑点的图像。所谓的“并行成像技术”提高扫描速度的方法是:使用置于感兴趣的组织周围不同位置的射频接收器线圈的相控阵列。为了缩短扫描时间,采集的数据点少于空间分辨率扫描视野(field of view , FOV)通常所需的数据点。
在一类并行MRI技术中,放射科医生保持空间分辨率,但对数据进行欠采样以节省时间,这一过程产生的视野较小。他可能会合并一组较小的视野以产生较大的视野,在这种情况下,阵列中的每个线圈都需要校准。这些灵敏度编码(SENSE)方法为空间编码提供了新功能:组织在多个接收器线圈中产生的相对信号、补充频率和相位编码的信息。在另一类并行MRI技术中,在扫描过程中省略一些k空间数据以节省时间,在重建之前进行合成。
并行成像可加快采集实现良好空间分辨率所需的所有样本的过程,压缩感知则可以进一步加快扫描速度。该技术完全省去部分采样以节省扫描时间,数据用离散余弦和小波变换来处理,该方法广泛应用于数字摄影和视频的图像压缩。这些数据变换会生成所需空间分辨率的MR图像,但是从通常需要的部分测量数据中生成MR图像。实质上,较小的数据集包含了 MR图像的压缩版本;在图像重建时,该压缩版本使用这些数据变换进行解压。
通过将并行成像与压缩感知相结合,无需患者屏住呼吸即可进行高质量的肝脏或肺部扫描。现在扫描跳动心脏的图像可以比以前更快、质量更高。
乳腺MRI
近来,由于政府和专业医疗机构对筛查各种女性群体的乳腺癌的建议存在分歧,用于乳腺癌筛查的乳腺 X 射线摄影已引起争议。MRI长期以来一直用于完善乳腺癌的诊断,在高风险人群(乳房密实或有乳腺癌家族史的女性中),MRI是一种成功的筛查手段。
MRI通常可以在更早可治疗的阶段检测出癌症,这些癌起初很小,但具有侵袭性、快速增长且更容易转移。乳腺 X 射线摄影最适合对相比周围组织致密,包含钙化或使周围组织变形的肿瘤进行成像。这些大的结构变化不太可能在早期癌症中显现出来,并且一些证据表明,侵袭性癌症甚至可能在扩散之前未发展出组织变化。使用注射的钆造影剂,MRI可以突出早期癌症的微观组织变化,例如T2的变化、水扩散率的变化或血液流向某些位置。
乳腺MRI的高灵敏度将为所有需要筛查的患者带来福音,但由于成本和时间的限制,广泛的筛查从未实现过。进行乳腺MRI筛查的诊所通常借用诊断问题求解工作中的方案。这意味着花费20–40分钟扫描患者,就可以获取具有几种不同对比度加权的图像,可以获得造影剂注入组织后的图像,最佳确定病变的位置、大小、类型和预后。
这些扫描产生了庞大而复杂的数据集。放射科医生从每个图像系列中辨别出待诊断的病变是恶性还是良性,并评估其侵袭性。在一个小时的时间里,乳腺放射科医生通常可以解读数十张乳腺 X 射线摄影照片,却只能进行少量MRI检查。
研究人员一直在努力克服乳腺MRI的这些局限性,让更广泛的人群接受乳腺MRI筛查。要实现乳腺MRI筛查的大规模应用,就要在重新设计成像方案上取得突破,要着眼于检测灵敏度和速度,同时避免表征肿瘤通常所需的额外扫描。
在快速筛查乳腺MRI时,同时对双乳进行单次扫描;注入钆造影剂,然后重复相同的扫描。从第二张图像中减去第一张图像,理想情况下,这样就将第二张扫描图像中含有造影剂位置之外的所有组织从视图中去掉。使用所谓的“最大强度投影技术”(maximum intensity projection , MIP)将成像组织的各个切层融合成立体图像。这种融合使放射科医生可以查看伪3D切层中的所有造影剂流信息,而无需滚动查看单个切层的图像(参见图4和本文标题页上的图像)。因此,在进行3分钟的MRI扫描后,放射科医生可以在几秒钟内轻松检测出吸收新血流的肿瘤。
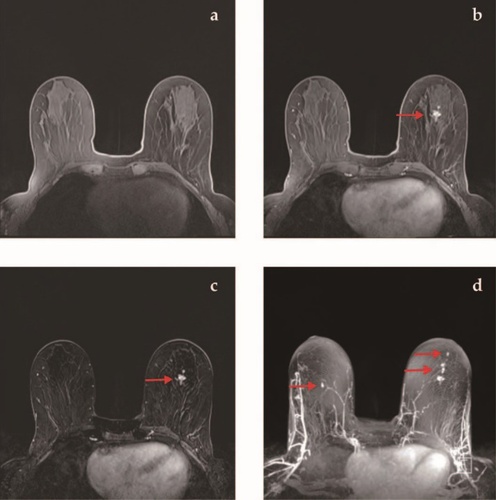
图4 快速筛查乳腺MRI
a. 在没有造影剂的T1加权图像中,看不到明显异常。
b. 将造影剂注入组织后,这张T1加权图像显示了容易看到的大病变(箭头)。
c. 图b减去图a后的图像改善了肿瘤的可见度和致密腺体组织的亮度。
d.所有相减后的切层(例如图c)的所谓最大强度投影显示了其他小的病变(箭头),包括对侧乳腺中的病变。放射科医生通过查看这种类型的一张图像,可以比逐一查看数十张切层图像更快检测到所有可疑病变。
磁共振指纹
磁共振指纹(magnetic resonance fingerprinting , MRF)是最近的一项进步,它采用了截然不同的方法来快速获取和处理信号数据。平时,MRI扫描通常仅用于检测和定位可能的疾病,而最终的诊断则取决于活检和组织病理学分析。放射科医生借助更强大的工具来表征组织,可以直接从MRI扫描中进行明确的诊断,从而能减少不必要的侵入性活检。这样做既可以节省时间和成本,还可以避免病人的痛苦和可能的并发症。
MRF技术在概念上类似于执法机构用来识别人的指纹技术。人指尖上的脊纹不包含关于个人的有趣或有用细节。但是,它是独一无二的,可以与数据库中的人员信息进行匹配,获得一套更丰富的人员识别信息。
MRF的操作方式如下:合成一个脉冲序列,其参数诸如脉冲之间的重复时间和施加到组织的射频功率等伪随机变化。(在常规MRI中,在生成和读取空间编码信号时,保持这些参数恒定非常重要。)给定组织的T1和T2弛豫时间,计算机模拟组织根据脉冲序列理论上产生的信号。然后用NMR布洛赫方程计算组织的响应,该方程描述了组织的磁化强度随时间的变化。
根据数值各异的众多T1和T2组合,创建一个信号模型的响应库。响应可能不代表真实的身体组织,但每个响应都在数学上代表T1和T2值的唯一组合的物理响应。MRF扫描使用合成MRF脉冲序列扫描患者(通过空间编码生成图像),记录实际MRF信号并将其与响应库中的信号进行比较。对于每个像素,确定记录的MRF信号与库中的响应之间的最佳匹配,并将库匹配的T1和T2值分配给该像素。
该方法使得临床医生从单次扫描中就能完全确定T1和T2值。组织响应与响应库信号的匹配过程对噪声相对不敏感。因此,非常快速的MRF采集可以可靠提供稳定的定量结果,而无需更长的扫描时间即可实现高信噪比。
从MRF库中提取每个体素的T1和T2值后,这些值可以显示为定量图。(图5显示了一个示例。)此外,可以计算每个体素对常规MRI脉冲序列的响应,因此MRF数据可用于合成常规的T1或T2加权图像,而无需花费额外的扫描时间来获得加权图像。

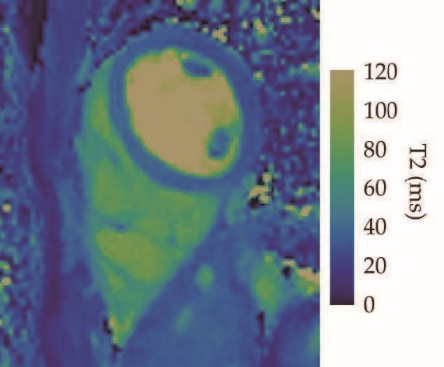

图5 磁共振指纹
在这张人的心脏图像中,MRF技术提供了T1、T2和质子密度的定量图。三张图像都来自同一次扫描,而常规MRI需要至少三次单独的扫描才能采集同样的信息。目前正在进行临床MRF研究,来衡量疾病和损伤对这三个参数的影响。
使用组织的定量图像,临床医生就有可能在常规加权图像上,补充他们对解剖学和病理学表现的定性评估。加上其他研究,他们就可能使用MRF直接和明确确定具体的疾病特征。该过程将简化根据定性表现和定量测量结果鉴定疾病或判断其严重程度的任务。
放射治疗
在治疗癌症和其他疾病时,图像引导放射治疗(Image-guided radiation therapy , IGRT)越来越依赖MRI,IGRT的两个关键环节是治疗计划和治疗过程的在线图像引导。治疗计划利用治疗前扫描的图像来确定放射束的位置,施以有针对性的剂量,进而破坏病变。在在线图像引导中,现代治疗仪利用在治疗期间拍摄的图像来修正靶向,并考虑到患者的运动以及肿瘤形状和位置的变化。
为了在保护健康组织的同时,向肿瘤施以大量而精确的辐射,放射治疗需要有关组织环境的详细信息。在这方面,CT很有用,因为它的图像是光子衰减图。临床医生通过扫描校准体模来测量扫描仪的响应,并使用患者的CT图像来模拟治疗将在何处沉积能量。然后可以模拟和优化治疗方法,以破坏肿瘤并避免对周围组织的损害。
CT图像是确定辐射剂量在治疗区域沉积情况的良好模型,但它们通常无法清晰显示肿瘤本身。然而,当放射肿瘤学家在确定如何靶向治疗时,肿瘤的可见度至关重要。MRI克服了这一难题:有很多对比度加权选项可以控制组织显示的明暗程度,几乎总是有方法可以将肿瘤与周围的软组织区分开。
遗憾的是,没有将MRI图像翻译成辐射衰减图的直接方法。NMR信号产生于原子核的磁性行为,而磁性行为与控制X射线吸收和散射的轨道电子行为之间的关联性很差。因此,MRI图像虽然能最好显示靶点病变,但要用它对辐射剂量分布进行精确建模却非常困难。
放射肿瘤学家通过兼用CT和MRI扫描患者来寻求两全其美。尽管图像融合技术利用刚性结构(如骨头)对齐多个图像,但是,把在MRI图像上确定的靶点投影到CT图像集上来制定放射治疗计划时,两次扫描中患者姿势或呼吸运动之间的细微差异可能会产生误差。在放射治疗中,即使是几毫米的未对准都可能会严重伤害健康组织,或使部分侵袭性肿瘤得不到治疗。
为了解决这个问题,医生和科学家正转向机器学习技术,从多个MRI图像集中提取信息,不用X射线图像就能确定组织的辐射衰减。这些算法中的许多算法都可以根据MRI数据重建“伪CT”图像(光子衰减图)。该方法通过一次扫描即可提供肿瘤可见度和辐射剂量分布,不会因将患者重新放在另一台扫描仪上而带来失误。
在制定治疗计划期间难以使用X射线成像看到的肿瘤,也难以在实时治疗期间进行监测。放射治疗的趋势是在每个治疗阶段对肿瘤施以更高、更集中的辐射剂量。这样做减少了出现误差的空间余量,更加重视管理运动结构的技术。在治疗过程中对靶点进行实时成像和跟踪是一种强大的方法,而MRI具有显著的成像优势。
在放射治疗期间对患者进行MRI也带来了基本挑战。直线加速器是现代放射疗法的常用工具,但磁场会干扰其运行,实际上,强磁场可以完全切断电子束。为了研制第一台MRI引导的商用放射治疗仪,工程师转向放射治疗的早期支柱——钴-60远程治疗仪。磁场的存在不会影响钴-60中的γ射线产生,仪器设计人员能够集中精力解决其他问题,例如集成成像、治疗设备以及定制机械元件在磁体内部的功能。
将系统安装到诊所和医院后,放射肿瘤学家就可以使用在治疗室获得的MRI扫描来治疗患者,而医学物理学家专注的问题则是在强磁场中测量和校准治疗束,以及了解剂量分布变化。特别是,当治疗束被吸收或在组织中发生散射时,会释放高能电子,它们通常被附近的组织吸收,在治疗计划中要考虑这种结果。在磁场中,这些电子的路径会发生偏转,并且必须在治疗计划中对偏转进行建模,以确定准确的辐射剂量。
MRI引导的钴-60疗法为MRI引导的放射治疗打开了大门,但是许多使用直线加速器进行的治疗无法在钴-60系统上进行。对开发集成式MR引导直线加速器的追求,催生了世界各地研究中心的创新系统,并且商业系统现已投放市场。
物理学家已经能够在治疗室中产生用于实时MRI的强大而均匀的磁场,同时消除对附加的直线加速器的磁场干扰。尽管在放射治疗过程中如何优化MRI扫描以达到最佳治疗效果,还有很多知识要学习,但是,该技术在身体各个部位和各种疾病类型的放射治疗和放射外科手术中具有广泛的应用。
资料来源 Physics Today
_____________________
本文作者戴夫 • 乔丹(Dave Jordan)是美国俄亥俄州克利夫兰市大学医院的首席医学物理学家和凯斯西储大学的放射学副教授。