植物组织培养(PTC)—词,习惯上可广义地归类为任何植物的一部分,无论是单个细胞,一块组织或某个器官,在无菌试管内的培养。尽管Street认为这个词仅用于植物器官切片(外殖体)的增殖而产生的组织。从植物上切下的组织切片的生长,源于自然界中植物组织的创伤反应,原因是局部生长素水平的增加,静止期细胞迅速分裂并产生无细胞结构的组织团块,称为愈伤组织。组织培养是基于“全能性”这个概念,意思是每个植物细胞都有控制细胞分裂和生长的基因,能生长并形成完整的新植株。
组织培养的历史
施莱登(Schleiden)和许旺(Schwann)在1938 ~ 1939年建立了细胞的“全能性”概念,阐明了活的细胞是一个独立的单位,在从生物体分离时如果能提供与
在生物体中一样的物质条件、它具有逐步增殖的能力。最早将这个理论用试验加以证明的是伏金(Voching)在1878年将植物分割成小碎片并使之保持生长。PTC的田园化开始于怀特(White)(1934年)用实验证明去根的番茄能在试管中生长。
最初的研究着重于从不同的植物中分离组织,并首先用于研究细胞新陈代谢的实验。罗坦(Routien)和尼克尔(Nickell)(1956年)得到了PTC的第一个专利,并指出这种技术对于生产食用植物的巨大价值。巴纳(Byrne)和柯克(Kock)(1962年)研究了通过浸没培养植物组织细胞生产食物的可能性。从那时以后,发展了多种可食用植物用于组织培养。但这样丰富的生物资源来源作为一种潜在的食物来源尚未得到更多的注意。
PTC更进一步的研究集中于在试管内繁殖观赏植物,以及高价值产物的生物合成,例如药用植物。由于可耕地减少,而世界人口以2%的年增长率增加,这就需要更多的生物资源并发展新的生产方法。PTC由于有提高植物性食品生产率的潜在能力,而可能提供一种新的生产方法。
组织培养方法
无菌培养植物的来源有五种主要类型:(1)较大植物的幼苗(植株培养);(2)分离型或幼胚芽(胚芽培养);(3)分离的植物器官(器官培养);(4)由植物切片(外殖体)增殖而产生的组织(组织或细胞培养);(5)分离的细胞或非常小的能在所生长的液体培养基中保朽离散状的聚集体(细胞或悬浮培养)。
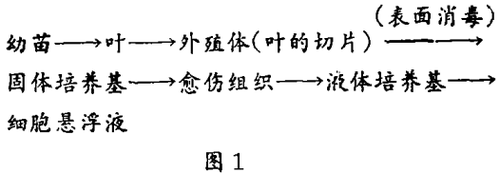
普通的组织培养的简明过程见图1。它开始于幼苗,因为幼嫩的组织最有希望进行培养。叶是经过选择的植物器官,但用于正式开始组织培养的愈伤组织可来自于任何植物器官或细胞类型。合适的营养混合物、生长因子、环境条件,例如光、温度和湿度能使器官碎片的活细胞分离并形成愈伤组织,然后无限期地在液体培养基中再次培养,或转移到振荡后的液体培养基(无琼脂)中形成悬浮培养。
合成食品成分
植物组织培养技术当前和将来可能的应用可分为两个方面;合成食品成分或生产食品。
当前,更多的研究着眼于植物细胞和组织培养的
合成能力,以及在固态和液态培养中产生的大量混合物(代谢副产物)的利用。见表1。尽管这些物质中的许多种是食品的重要成分,但应用PTC而使它们进入商品化生产尚未进行广泛的研究。据尼克尔(Nickell)(1980年)认为,这是由于一般情况下食品生产的成本相对较低,事实上,在许多培养中所期望的化合物并没有达到有意义的数量。
另一方面,由植物产生的代谢副产物的多样性,引进的植物品种的驯化困难和当前向天然食物成分转化的趋向、促使植物生物合成能力的开发。通过PTC生产食物成分已有实例,尤其是色素、调味品、甜味剂等,其它还有抗微生物剂、酶、乳化剂、香料和维生素等。
生产食品
除间断性的研究外,很少在实际工作中应用植物组织培养来生产食品,范西尔(Vasil)和希尔德伯兰特(Hildebrandt)(1960年)发现生长在人工培养基中的大部分植物细胞组织具有惬意的味道,并完全可口。特别是苣荬菜细胞,它的组织具有鲜绿色,多汁而鲜嫩,并且还与自然生长的苣荬菜一样有淡淡的芳香味。他们证明人工培养细胞将为蔬菜食物和必需维生素及矿物质提供一个新的来源。
试管繁殖:PTC大规模地广泛应用于农业生产、要求快速的试管繁殖。试管繁殖也用于引入木薯和桃子新品种、生产无病毒的草莓植株和增加椰枣、椰子、柑桔、玉米和大豆的产量、试管繁殖能较大幅度地提高从种籽得到植物产品或常规繁育蔬菜的速度,穆拉西吉(Murashige)(1979)指出,自从植物能在无菌的并且可调节的环境中生长,减少了受污染的机会,并且不受外界因素的影响,例如:季节的变化。
以无性繁殖方式进行的组织培养的应用是基于这样一个设想:当植物组织从母体上切割下来并置于培养基中,它保持着完整的遗传性能。但在任何从细胞培养生长出的新生植株中,某座无性系品种中经常出现表现型的变化,在细胞悬浮培养中,新生植株的遗传变化被认为是起因于工艺本身,或由于培养基成分的诱变。这种变化的潜能可用于筛选植物的不同成分或特性。已经知道:(1)组织培养方法可发展特定的品种,(2)组织培养提供有效的(或独特的)方法用于作物改良,(3)品质的改变必须在组织培养中表达,并且发展有效的选择系统来鉴别所期望的变异,同时(4)变异的细胞系必须有再生植株的能力,在精选出的变种中表现出来,并在随后的繁殖时可遗传下去。
改善机能特性:植物改良的一个可能范围是改变食用谷物的机能特性,例如:色泽、香味、成分、风味等,希望能改变色素沉积的胡萝卜细胞系的精选品已有研究,但再生的植株不能表达出期望的品质和完全正常的色素沉积。许多研究是不久才开始的,旨在改善番茄的某些性质,包括色泽和水分含量。
其它在农艺学上重要的品质,例如:耐盐性、耐除莠剂性、对温度变化及淹涝的应变力,都已在细胞的基础上得到了解,因此,对这些新特征的选择能直接在细胞水平上进行。
改善营养品质:改善单位食品的营养品质也用组织培养工艺来进行。最近已可使某种水稻产生的粗蛋白比其它品种高10%,并增加赖氨酸的含量。因此,正如希尔德伯兰特(1966)认识到,PTC开辟了获得单细胞克隆以期望得到具有合乎人们意愿的品质,包括风味、色泽和高营养价值的食物新领域。
减少营养限制因子
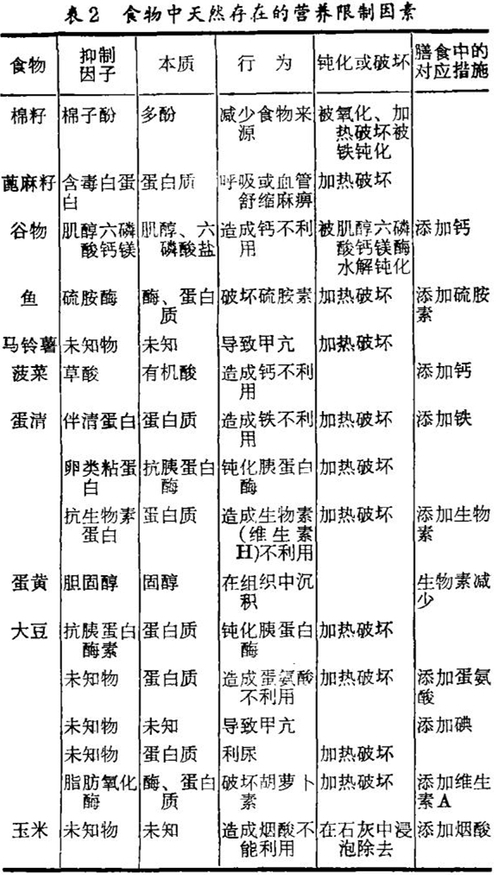
营养限制因子定义为妨碍从外界到人类和动物体细胞的营养转换的不利因素。它们作用明确并施加它们的影响来增加必需营养素的丧失,减少必需营养物的吸收,降低食物消化率或减少食物的摄入。大多数种类的植物还含有少量的天然毒物,长期摄入这些化合物对健康可能形成潜在威胁。因而减少植物性食品中的营养限制因子,可增加植物中营养素的利用率,并因此而改善膳食的质量。
传统的减少方法:表2列举了食物中的一查营养限制因子和消除或减少的方法。植物产品中的许多有害成分可被加热破坏,然而,其它的在某一时期已被抵消了的营养限制因子,可能会重新恢复影响膳食中的营养。
PTC工艺:无性细胞的易变型,即从细胞培养再生的植株的遗传可靠性,为通过在细胞水平选择合适的突变型来改良作物,提供一个可供选择的方法。大多数从细胞种群中挑选出来的变异细胞系,其异质性会自然地逐步显现出来、诱变处理不能显著地增加无性细胞的变异率。有关这种自然变异的机制仍然是推测的。它可单纯地由培养基的成分引起或同在完整的植物细胞中本已存在的突变频率相同。这种遗传变异能被用来产生新的基因型,例如:营养限制因子低的品种,在农业和食品生产中应用。
减少草酸:草酸是天然存在于植物中的有害物质,能与必需营养素钙结合成不溶性盐而阻止吸收。还能阻碍铁和锌(一定程度上)的吸收。草酸盐能导致骨中矿物质的丧失,尤其当膳食中缺乏钙或维生素D时。并且,全部背结石中三分之二的主要成分是草酸盐。
苋在美洲曾是一种重要的传统作物,现在仅在墨西哥、美洲中部和南部、非洲和亚洲有少量种植,但最近美国国家科学院(NAS)认为这是一种具有潜在经济价值而未充分利用的热带植物。
通常苋籽粉用于面包、小甜饼和蛋白杏仁精中,并已开始用在早餐麦片中。用做蔬菜的苋叶平均含有30%粗蛋白、420 ppm维生素C、278 ppm铁、250 ppm β-胡萝卜素和2.1%的钙。但也含有较高的营养限制因子,平均(以干重计)含有0.4%硝酸盐和7.2%草酸盐。
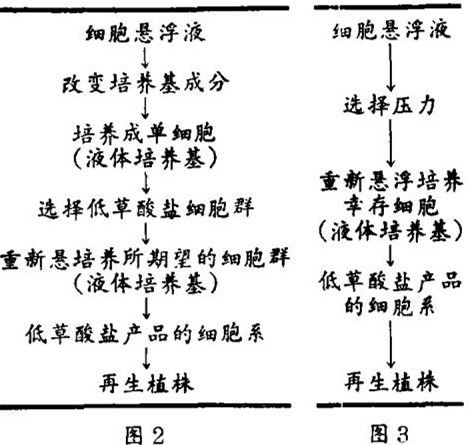
我们期望降低苋的草酸(草酸盐)含量。利用自然的或在组织培养时可能在细胞中出轭的变异,来选择具有所希望品质的变异细胞系。制备苋(A. gungcticus)细胞悬浮液(图2),并培养直至细胞含量至少在109/ml以上,增加自发突变型产生的可能性。有生长活性的悬浮液随后就接受选择压力,例如,添加植物毒性物质(图3),阻碍野生型细胞的生长,并选择幸存的突变型,以改变代谢能力。尤其是这种化合物,必须对含草酸高的细胞具有毒性、而低草酸盐的突变型具有抵抗力。目前已有几种理论机制可用于试验这种选择毒性物质。
在食品中应用的前景
在植物组织培养中,变异细胞形成后的机理需要进一步研究,以便能建立稳定的细胞系并维持下去。各种微生物、植物细胞在培养中都有变异的倾向,导致出现所期望的变异,同样也有有害的基因变异。所选用的方法必须能设计控制变化性,消除不希望出现的变异,并允许选择出来的细胞系能持续培养下去。
培养出的细胞在工业上有助于替代目前常用的整体植株栽培,但必须改善工艺条件,以便在等于或低于田园生产成本的条件下,使细胞培养得到恒定高产的终产物。美国国家咨询委员会(NRC)预言,变异选择用于组织培养的有价值的潜在能力,将在10 ~ 15年内对改良作物作出重大的贡献,它的某些应用也可能在5 ~ 10年内实现。特别是PTC成功地用于减少草酸盐的水平,看来有希望减少植物食品中的其它营养限制因子,而它们的减少则增加了日常膳食中必需营养素的生物利用率,并全面改善食品的供应状况。
[Food Technology,1984年2月]