目前,对在细胞内和细胞周围起作用的各种物理力的研究进展神速,并在分子生物学世界中引发了一浪盖过一浪的冲击波。
近来,科学家们已经收集了大量资料,证明各种物理力是如何控制心血管系统的发育和重建的。来自于血流的各种作用力可以控制血管的扩张或收缩,尤其是剪切应力(shear stress)、一种由血流产生的摩擦力――其变动范围可以从人体休息时的1帕升高到重体力劳动时的10帕――可以启动细胞内部的生物化学应答,从而影响这些变化。

生物力学:犹如全速前进的生物学旗舰
2005年,研究人员鉴定了一种名为PECAM1的跨膜蛋白,它位于细胞与细胞之间的粘连物上、在内皮细胞之间起到连接作用。PECAM1可以通过快速激活Src激酶家族,从而对剪切应力进行应答。这种激酶表现出可以启动下游信号通路,其中包括那些与细胞基底膜上的整合素有关的通路。弗吉尼亚州立大学的细胞生物学家马丁·施瓦茨说:”当其复活的时候,除了对环境变化的快速应答能力,很少有什么更重要的了。并且,当其成为快速作用的指标时,那些由各种物理力诱导的信号在细胞内及其周围起作用,被人们称之为“生物力学信号”。
伊利诺伊大学厄本那―香槟分校的生物工程师王宁(Ning Wang)说:“如果你对这种力学信号进行观察的话,它的传导速度大约是每秒30米,那是非常快的。”这种速度比大多数私人高速快艇还要快,在生物信号传导种类中仅次于电脉冲(例如神经脉冲)。与之相比,小分子化学药的扩散速度仅为每秒2微米。
在2008年的研究中,人们发现,实际上当两种信号类型在细胞中进行“龟兔赛跑”的时候,力学信号可以把化学信号这只兔子抛在后面。比如激活细胞质膜中的远点蛋白质用时不到1秒,这比力学信号的劲敌――生长因子起码要快40倍。王宁博士补充说,力学信号是如此之快,“超出了我们的观察仪器的能力”。这意味着目前的成像技术远不能捕捉到由力学压力在毫微秒之内引发的第一批细胞学变化。
多个世纪以来,科学家们已经仔细研究了人体内的分子作用机理,但是很少或者几乎没有注意到这些生物学反应发生的物理环境。但是,人们越来越认识到,各种物理力在生理学(环境)中是普遍存在的,它们在一系列身体器官例如骨骼、血液、肾脏和耳朵中发挥着作用,作用速度之快令人惊讶,已经使许多人考虑这样的可能性:在细胞的生命活动中,力学信号传导可能和化学通讯一样重要。
加州大学伯克利分校的生物力学工程师穆罕默德·穆福拉德(Mohammad Mofrad)说:“生物学家们一直忽视了生物学中的力学问题,(但是)生物力学正在变得越来越为人们所接受。而且,人们正在认识到它在发育、疾病以及细胞水平和组织功能中的作用。”
“生物力学正在被人们认可,认识到它在发育、疾病以及细胞水平和组织功能中的作用。”
内生波澜:各种在细胞内部起作用的力学作用力
一直以来,人们更为重视化学活性基团的研究,似乎细胞并不能够将各种物理力传递到这些化学基团的深度,研究人员大多将他们的研究局限于可以应答于各种物理力的分子或者结构,或者应答于质膜的力学传感器。
在细胞的生命活动中,力学信号传导可能和化学通讯一样重要。但是在上世纪90年代后期,进一步的实验研究揭示了这样的事实:细胞内部实际上是一种高度结构化的环境,由一个各种纤维的网络组成。这些纤维从细胞的一边连接到另一边,可以通过不同的途径将力传递到另一边,从而形成一种细胞结构。打个形象的比喻:就如同一艘船形成的波浪可以传播到远处一样,甚至可以到达风平浪静的海岸线。科学家们现在认识到了这些细胞内冲撞的潜能,可以诱导整个细胞内的分子变化;而且,对力学传感分子的研究,比如对细胞核内的几种蛋白质的研究,已经在大范围内产生了戏剧性的升温。
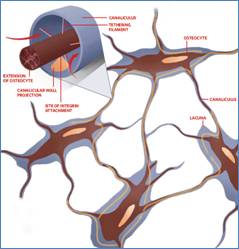
力学信号如何在骨细胞中扩增
在细胞间质体液流过称之为"陷窝-骨小管网络"的各种腔室和管道组成的网络时,它对连接骨细胞和骨小管壁的纤维起到一种拉动作用。然后,这些作用在纤维上的拉力就可以将这些力学作用力扩增和传递到骨细胞上。骨小管壁的突出部分,与骨细胞接触于一个整合素蛋白上,也可能参与了力学信号的扩增和传递。
哈佛大学威斯生物学灵感工程研究所所长、细胞生物学家唐纳德·因格贝尔(Donald Ingber)预测:这种探索很可能要持续一段时间,“试图发现力学传感器的本原就是人们疯狂的所在”,科学家们现在认识到了,“整个细胞就是一种所谓的力学传感器。”
大多数人认为,其中一个关键的分子是细胞骨架,它由一系列的微丝组成,包括坚硬的肌动朊纤维和活跃的肌球蛋白马达,它们都是肌肉的主要组成元件。一种称为“非肌肉内的肌球蛋白”的激活可以导致细胞骨架的收缩,与胳膊肌肉在提起重物时的表现非常相似。
对细胞骨架在细胞内作用(分子转运、细胞运动和分裂)以外的作用的第一次研究始于1997年,因格贝尔对细胞牵拉后观察细胞内发生的事件――使用一个小型的玻璃微量吸管来包裹各种配基。因格贝尔和他的同事们小心地探查了一种称为整合素的表面蛋白质,它的作用是保卫细胞不受胞外基质的戕害。当他们迅速地取出微量吸管之后,立即观察到一个细胞的变化:细胞骨架上的各种元件扭转90度,细胞核扭曲变形,核仁(一种位于细胞核的小而致密的结构,主要功能是核糖体拼接)则沿着外加力的方向依附排列。
因格贝尔回忆说:“人们发现在细胞内,它拥有不可思议的结构水平,不仅在细胞质内、还是在细胞核内。”
作为哈佛大学公共卫生学院因格贝尔实验室的博士后,王宁和他的合作者们组合了一种相似的技术,运用荧光成像技术,将这些作用力在细胞内部是如何通道化的过程视觉化。通过提高这些技术的分辨率和进一步精细化,王宁博士开始将这些作用力在细胞内的运动路径绘成图谱。2005年,他所绘制的图谱证明了在细胞表面的整合素和细胞核之间的物理连接的客观存在,并证明了在细胞骨架元件的拉张下,这些外部作用力呈现一种非随机的路径。
这些力学通路的终点似乎是一种力学敏感蛋白质,可以通过应答于有关作用力而改变外形,因而暴露出其新的结合区域、或改变该蛋白质的功能。例如,在线粒体中,各种力学作用力可以激发氧自由基的释放、激活信号转导分子,从而引发炎症反应和动脉粥样硬化。
同样地,核膜上的各种蛋白质可能通过一种称为LINC(核骨架和细胞骨架的连接子)的特异性的结构,使力学信号进入细胞核,从而将肌动朊细胞骨架与那些对细胞核组织结构和基因功能重要的相关蛋白质进行物理连接。为了确定这些力学作用力是否影响基因表达,2008年,科学家们开始研发越来越普及的荧光共振能量转移技术(FRET),它是通过一个荧光分子激发另一个荧光分子以释放能量,从而产生一种可见的能量转移、对活细胞中的酶活性进行示踪研究。王宁说:通过组合FRET技术和那些应用各种物理力来对细胞膜蛋白质进行鉴定的技术,科学家们可以在视觉化状态下研究整个力学化学转导通路。
王宁解释说:“目前,力学转导领域最大的问题是,细胞核内的基因是否可以被作用于细胞表面的各种力的直接激活。”当人们尝试将细胞骨架的物理图谱展开,以支持这方面的可能性时,还缺乏证明的数据。他说,这些新技术的组合将试图回答各种力学作用力是如何影响细胞的生命活动的。
“试图发现力学传感器到底是什么,正是这个问题令人疯狂之所在。科学家们现在认识到了:整个细胞本身就是一个力学传感器。”
一个初步的创意:发育中的力学作用力
在发育生物学领域中,细胞骨架在生物力学中的作用实际上是来自于它自己(的结构)。随着胚胎的发育,这些细胞本身就是作用力的产生器,通过关键时候的收缩,细胞骨架可以启动许多关键的发育步骤,从内陷和原肠胚形成到增殖和分化,以及总体的细胞组织化。
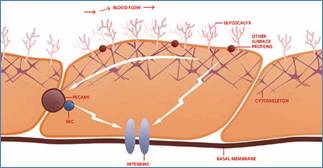
内皮细胞中的各种物理力
血液流过脉管系统时,对血管中的内皮细胞产生了一种剪切压力。这种作用力是通过细胞骨架传导到细胞与细胞间的粘着物的。在那里,一种名为PECAM1D的跨膜蛋白对其产生应答。这种应答的产生是通过激活一些下游的信号通路,这些通路包括那些与细胞基底膜上的Src激酶家族和整合素。
所谓物理力在发育中有作用的认识并不是一种新的发现。早在20世纪初期,当爱因斯坦第一次建立了粘滞性的分子基础时,科学家们认识到分子是由一些各自不同的粒子组成的,苏格兰邓迪大学的生物学家兼数学家达西·汤普森(DArcy Thompson)提出力学张力在器官形态发生中是一个主要的作用因素。现在,将近一个世纪以后,生物学家们终于开始同意这些观点了。
宾州大学的生物工程师克里斯托弗·陈(Christopher Chen)说:“在那个时代,汤普森还不能对各种力进行测量,并且遗传学占据了生物学的主流,这些想法被人们束之高阁。”直到2003年,法国居里研究所的伊曼纽尔·法奇(Emmanuel Farge)才对果蝇胚胎进行挤压研究,模拟早期发育时的受压经历,并激活在消化系统形成中的关键基因“拧曲子(twist)”基因。这些结果引起了人们对汤普森的胚胎内的压力可以刺激发育和生长的理论的重视,激发了发育生物学家们开始考虑力学效应。陈博士说:“现在,我们正处于这样的阶段,人们需要证明和看到这样的事实,各种力学作用力不仅在胚胎成形中有作用,而且还与人体分化程序有联系。”
细胞骨架是此过程中的一个关键分子,这再次引起了人们的重视。例如,在果蝇和蛙类中,非肌肉的肌球蛋白收缩肌动朊纤维,以产生成功的原肠胚形成所需的压力;而原肠胚形成是发育过程中第一个重要的形态改变事件。在果蝇的卵室发育过程中,肌球蛋白同样可以影响增殖过程,即在增加肌球蛋白活性的同时也增加了细胞分裂。
细胞骨架的收缩能力还表现出可以控制干细胞分化的作用。2006年,宾州大学的丹尼斯·狄斯彻(Dennis Discher)发现:细胞在培养基中生长所需的底物张力,对决定细胞将形成组织的类型十分重要。在模拟脑组织的软基质中生长的细胞,易于发育成神经中枢细胞;而在粘性基质中生长的细胞,则易于发育成为肌肉细胞前体,在硬基质中会产生骨细胞。在这些情况中,似乎粘性基质可以增加非肌肉性的肌球蛋白表达,在肌动朊细胞骨架中产生更大的张力并影响分化事件(改变或者抑制肌球蛋白的收缩度也可以影响分化事件)。
2009年10月,王宁通过简单地针刺细胞表面,使小鼠胚胎干细胞(mES)发生了诱导性改变。稍后不久,在对细胞表面整合素施加一个微小的外力后,每个细胞开始在底物中扩散,这是形态发生和胚芽层形成中的一个关键步骤。
陈说,要培养特定的细胞类型以用于临床,关键在于对细胞在生物体内的命运的更全面的认识;而对物理环境在此过程中起到的作用的认识,已经“对扩展对力学重要性的认识起到巨大的影响。”穆福拉德补充说:“这方面的证据越来越多,力学已成为人们认识生物学的一个制高点。”
资料来源 The Scientist
责任编辑 则 鸣