基因编辑技术已经在一些罕见的情况下进行试验,更多的人体临床试验即将启动。

自从CRISPR-Cas9基因编辑技术问世以来,它就激发了人们对其或夸张或谨慎的预测:例如,我们也许很快就能让远古时代的野兽复活,或者创造出经过设计的婴儿。虽然此类应用可能永远都没有机会问世,但基因编辑技术已经在遗传学研究领域掀起了一场革命,它使得科学家能够在实验室中轻松操纵模式生物。此外,许多生物医学科学家将该系统视作修复活跃在无数遗传疾病中的问题DNA的一种方法。
奋战在基于CRISPR技术的治疗方法研发前沿的科学家和企业已经从相对温和的目标入手,瞄准了罕见的单基因疾病,主要目标是移植经过修饰的细胞,而不是在体内设置一个基因编辑递送系统。但如果监管机构能够批准,这类疗法可以作为CRISPR在医学上更广泛使用的“风向标”。
克利夫兰诊所的医学遗传学家戴维·弗兰纳里(David Flannery)表示:“到目前为止,基因疗法一直包括试图将基因(新拷贝)植入人体细胞中,而这一直很困难。”相反,CRISPR提供了一种对细胞中已经存在的基因进行微调的方法。
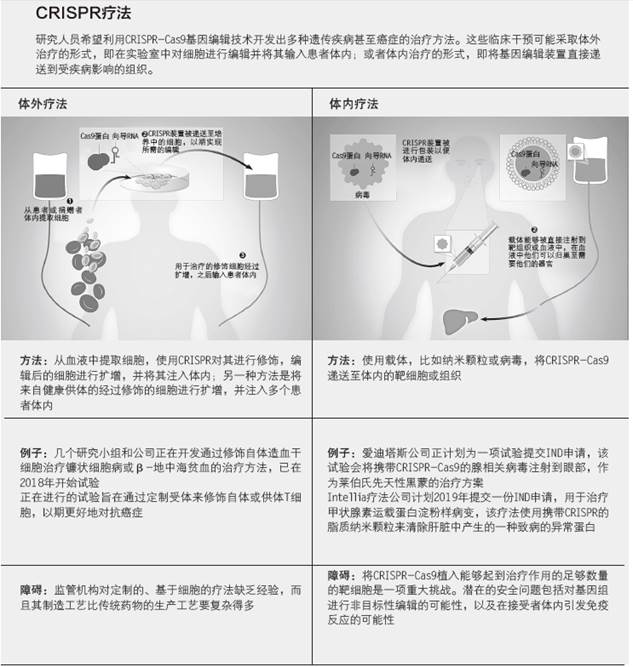
CRISPR体外疗法
2017年,随着诺华公司Kymriah疗法获批,美国食品药品管理局(FDA)首次批准了一种包含转基因细胞的治疗方法――这是一种癌症免疫疗法。将患者自身的T细胞从血液中提取出来,然后用一种插入了嵌合抗原受体(CAR)基因的病毒进行处理。生成的CAR-T细胞随后被扩增并重新输回体内。目前正在开发中的基于CRISPR技术的体外疗法也采用了类似的方法。
宾夕法尼亚大学肿瘤学家爱德华·斯塔德特摩尔(EdwardStadtmauer)启动了一期临床试验来测试一种疗法,该疗法将符合条件的癌症患者血液中的T细胞过滤出来,然后使用CRISPR技术敲除细胞现有的3个T细胞受体(TCRα,TCRβ,PD-1)并且以慢病毒为载体向细胞中插入NY-ESO-1(一种出现于某些癌症细胞表面的蛋白)的受体。经过修饰的细胞被扩增过几周,且患者接受了简短的化疗后,研究人员会将这些细胞回输至患者体内,斯塔德特摩尔说道。他目前正在为此次临床试验招募患者。
总部位于瑞士的CRISPR疗法公司也正在筹备基于CRISPR的癌症免疫疗法。该公司已宣布,计划在2018年年底前向FDA提交一份该类疗法相关的临床试验性新药(IND)申请。在宾夕法尼亚大学进行的试验中,该疗法是基于敲除T细胞受体,并添加一种CAR用于寻找癌症相关表面蛋白――在本案例中,该蛋白为CD19。与宾夕法尼亚大学采用的方法不同的是,该公司计划使用来自健康捐赠者的细胞,并移除其主要组织相容性复合体1。该公司研究人员希望,这种修饰能够使该疗法在不触发免疫反应的情况下,应用于多名患者。
用于自体CAR-T疗法的患者细胞被多次暴露于抗原和炎症信号中。其结果就是,他们“经常被折腾得体无完肤,筋疲力尽,当遇到抗原时,他们往往无法扩增,”该公司研发部门主管托尼·霍(TonyHo)解释道,“使用我们的技术,可以打造出……一种通用的现成的治疗方法。”该疗法使用了健康人的细胞来避免这种缺陷。
除了癌症,CRISPR疗法公司旨在利用体外CRISPR编辑治疗β-地中海贫血和镰状细胞性贫血等血液疾病。他们的想法是从患者的血液中提取造血干细胞,并对其进行编辑,使其能够生成胎儿血红蛋白,以此作为变通方案来解决这两种疾病中存在的有缺陷的成人血红蛋白的问题。公司已向欧洲监管机构申请许可,以便为β-地中海贫血启动1/2期临床试验,并计划2018年晚些时候对其首个患者进行治疗,但其准备在美国进行的针对镰状细胞性贫血的类似治疗计划5月份时却被搁置,因为FDA在对IND进行审查时要求该公司回答附加问题。
斯坦福大学的医学研究员马修·波提乌斯(Matthew Porteus)和他的团队一直致力于修复造血干细胞中的主效突变位点,这是治疗镰状细胞性贫血的一种更为直接的方法。因为这种疾病是由单核苷酸突变引起的,“纸上谈兵说起来就很轻松,‘如果我们能把它恢复到不会引起疾病的状态,我们就能够治愈这种疾病了。’”他说道。
在实验室中,研究小组利用了CRISPR和同源介导的修复(HDR)技术,该技术在修复CRISPR的双链断裂时,为细胞提供一些DNA作为模板。此技术用以修复患者60%到80%的突变细胞,波提乌斯预计这一比例用于缓解疾病症状的治疗将绰绰有余。下一步则是将这些经过编辑的细胞回输到患者体内,让他们自然地进入骨髓,并开始产生健康的红细胞。波提乌斯估计关于这种疗法的临床试验可能会在2019年年中启动。最终,他希望不仅能够治疗镰状细胞性贫血,也能治愈其他血液遗传疾病,包括β-地中海贫血。“如果我们成功了,我相信我们将拥有可以应用于数百种其他疾病的平台,甚至不需要太多改变。”他说道。
加州大学伯克利分校的基因组编辑研究员雅各布·科恩(JacobCorn)也在使用HDR技术治疗镰状细胞疾病,同时也着眼于围绕造血干细胞的其他相关疾病。他将他的团队的方法比喻成对病人的基因组进行精确的“手术”,该“手术”根据每个人的突变进行定制编辑。科恩是一家基因编辑生物技术公司“聚焦疗法”的联合创始人,同时也从其他几家公司获得酬金或拥有股份。他希望最早能在2019年启动关于镰状细胞病的临床试验。
“每天都能得到很多振奋人心的结果。”科恩说,“尽管目前还没有类似治疗方法进入市场,但我乐观地认为,就算花上10年时间,我们也要看到广泛应用的治疗性基因编辑。”
CRISPR原位疗法
位于马萨诸塞州坎布里奇市的Intellia疗法公司针对癌症和镰状细胞疾病的体外疗法已进入临床前准备阶段,但实际上其最先进的项目是体内疗法。利用脂质纳米颗粒将CRISPR机制递送给甲状腺素运载蛋白淀粉样变性患者的肝细胞,研究人员希望此举能够使发生了突变的编码甲状腺素运载蛋白的等位基因失效。这种蛋白质在人体中并没什么重要作用,但它的一种异常版本却可以在外周循环系统中形成沉淀,导致四肢感觉丧失;有时则在自主神经系统中形成沉淀,这种情况则会引发生理功能障碍。Intellia公司高级副总裁汤姆·巴恩斯(TomBarnes)说:“通常情况下,甲状腺素运载蛋白在人体中没什么重要作用,所以与其让你患上这种致命的淀粉样变性,那么还不如完全清除这种蛋白质。”这种治疗方法旨在同时敲除这两种拷贝,一次性治疗在小鼠身上显示出了持续的疗效,公司计划在2019年晚些时候提交IND申请。
向体内注射CRISPR的潜在陷阱是存在引发免疫反应的风险。位于马萨诸塞州坎布里奇市的爱迪塔斯医药公司成立于5年前,其合伙人包括博德研究所的张锋和哈佛大学的乔治·丘奇(GeorgeChurch),研究者们希望在治疗遗传性眼疾时,将CRISPR直接递送至眼部和其他拥有免疫豁免特性且不太可能因治疗产生炎症反应的器官来避免这样的问题。
筹备中的最成熟的疗法,其治疗对象是莱伯氏先天性黑蒙中的一种,这种遗传性疾病会导致视力丧失或失明。在爱迪塔斯公司瞄准的这种疾病亚型中,内含子的一个点突变会导致CEP290转录本的拼接异常。该疗法旨在通过非同源性末端接合(NHEJ)――一种不涉及模板的DNA修复过程――来剪除突变。2018年5月,在美国基因与细胞治疗学会会议上,一位来自爱迪塔斯公司的研究员展示了该疗法在猕猴中的实验结果,结果显示该疗法耐受性良好,并成功编辑了CEP290基因。该公司宣布计划很快提交IND申请。“我们相信,如果我们修复了CEP290蛋白,我们也将恢复‘眼部光感受器的功能’,从而显著改善这些视力严重受损(如果不是失明的话)的患者的视力。”首席科学家查理·奥尔布赖特(Charlie Albright)解释说。
爱迪塔斯公司还将从莱伯氏先天性黑蒙治疗方案的研发过程中吸取的经验应用到其他遗传性眼科疾病的治疗中,比如亚瑟综合征2a,以及致盲性单纯疱疹病毒I型感染,奥尔布赖特说道。
CRISPR疗法面临重重考验
无论体内疗法还是体外疗法在进入临床的道路上都面临着重重考验。在体内进行基因编辑时,递送是一个棘手的挑战。巴恩斯告诉《科学家》杂志:“CRISPR的伟大之处在于,当它位于细胞核内时,它的工作原理就像宣传的那样。”“挑战在于你需要围绕它构建相关平台。”巴恩斯说,用患者自身经过改造的细胞制成的治疗药物非常复杂,生产工艺复杂,相比其他药物,其注册审批流程不甚明确。
除了这些挑战之外,新的研究不断发现CRISPR体内和体外疗法潜在的有害副作用。例如,2018年6月,两篇论文发现:在某些类型的细胞中,CRISPR有可能通过p53通路导致细胞死亡,因此,在编辑过程中存活下来的细胞很可能携带p53突变――一种可能会致癌的缺陷。7月,研究人员报告说,由CRISPR诱发的剪切可能会在基因组的远端产生意想不到的影响。关于这两个案例的新闻均导致了致力于开发CRISPR疗法的公司股价下跌。
致力于开发CRISPR疗法的研究人员告诉《科学家》杂志,他们早就意识到了这种危险,同时正在采取措施减轻这种危险。然而,考虑到Cas9能够导致双链DNA断裂,“总有出问题的可能性,”6月份其中一篇研究论文的共同作者、剑桥大学的尤西·泰帕雷(JussiTaipale)说,“因此,在医疗效益和治疗风险之间取得平衡至关重要。”
资料来源 The Scientist
责任编辑 彦隐