利用CRISPR和其他工具,科学家正在对DNA甲基化、组蛋白标记和其他基因表达调节剂进行修饰,
以了解它们是如何影响到健康与疾病的。
在美国加州拉霍亚索尔克研究所胡安·贝尔蒙特(Juan Carlos Izpisua Belmonte)实验室里,科学家对疾病相关基因进行微调后,罹患肾病、肌萎缩或糖尿病的突变小鼠的健康状况均有所改善。然而,贝尔蒙特和他的同事们并没有编辑这些基因本身。相反,他们靶向表观基因组,对位于染色质上的化学和蛋白质标签进行修饰,从而影响了基因表达。
科学家正在开发分子工具来编辑这些表观遗传标记,揭示它们是如何影响基因组非编码区域并控制基因表达的。更好地理解表观基因组如何行使其功能,才会给从癌症到胆固醇升高等带来新的、更安全的疾病治疗方法。杜克大学生物医学工程师查尔斯·格斯巴赫(Charles Gersbach)表示:“表观基因组编辑真的不同于基因组编辑,通过它你可以做很多非常酷的事情。”
尽管基因组编辑具有革命性的前景,但它也有一些弊端。例如,它改变了细胞的基础DNA序列,可能会产生意料之外的效果,导致癌症或其他疾病。表观遗传编辑不会改变DNA序列,这就使其作为一种疗法更为安全。此外,基因组编辑依赖于DNA修复通路,该通路会以一种不可预知的方式将新的碱基插入到遗传密码中。表观基因组编辑并不切割DNA,也不需要缝合碱基来对其进行修复,这使得工具的使用在细胞类型上更加一致,格斯巴赫说。
然而,设计表观基因组编辑器也有自己的挑战。其一,就是表观遗传标记物组蛋白的生化多样性——组蛋白尾端有着甲基、乙酰基以及其他功能组,DNA上的甲基原子团本身就有至少6种不同的形式,而每年发现的更多类型的标志物使得设计出刚好合适的靶向每个单独的标记而不引发副作用的编辑器变得更加困难。加州理工学院遗传工程学家迈克尔·埃洛维茨(Michael Elowitz)表示,由于对表观遗传调控背后的分子机制尚不十分清楚,精确靶向位于基因组特定位点的表观遗传标记物仍然十分困难,“目前,尽管我们有着丰富的分子学知识储备,但是系统背后的基本逻辑还是难以理解。”
在这里,开发出表观基因组编辑工具的研究人员为《科学家》杂志介绍了他们的工作。
表观遗传开关
研究员 安吉洛·隆巴多(Angelo Lombardo),遗传学家,圣拉斐尔特利松基因治疗研究所
项目 沉默基因世代表达
问题 20年来,研究人员一直在使用RNA干扰技术来抑制信使RNA后转录,ZFNs或TALENs这些人工核酸酶通过靶向双链断裂来扰乱DNA序列,从而下调或关闭特定基因的表达。但这些方法只能部分敲除靶基因,或者无法敲除靶基因的所有等位基因。有时候它们根本没有击中正确的基因。
解决方案 真核细胞天生就会使用表观遗传来抑制基因表达。该过程的一个便于理解的机制涉及在胚胎植入子宫前,其干细胞中所谓的内源性逆转录病毒(源于远古逆转录病毒感染的基因组碎片)的关闭。为了关闭剩余的病毒元件,细胞用到了两种特殊的蛋白质家族,包含锌指蛋白的Krüppel相关盒子(KRAB-ZFP)和DNA从头甲基转移酶(DNMT)。前者与病毒序列相结合,并将甲基和乙酰基从组蛋白标记物中移除。后者添加甲基原子团,锁定未来细胞世代的基因抑制。
隆巴多和他的同事利用这一机制,从这两个蛋白质家族(他们选用了KRAB-ZFP/KAP1和DNMT3A)中分别选取一种蛋白质进行改造,以关闭分化的人类细胞(如T细胞)中的基因,而不是干细胞中的基因。研究人员将这两种蛋白质与DNA序列配对,这些序列会引导它们对三个特定基因的表观遗传标记施展神通,从而有效地关闭这些基因。由于每种蛋白质靶向的表观遗传标记略有不同,因此这两种蛋白质将以不同的方式编辑表观基因组。其中一种蛋白质迅速、稳健且可逆地抑制了基因的表达,而这种抑制作用经过几轮细胞分裂后即可消除。另一种蛋白质也关闭了这三个基因,这种抑制作用持续了很长时间,只有在经历几百代的细胞世代后才会消失。一年后,在细胞持续分裂的情况下,这些抑制标记仍是稳定的,这一事实确实令人印象深刻,格斯巴赫说道。他并未参与这项研究。
疾病的发现
研究员 查尔斯·格斯巴赫,生物医学工程师,杜克大学
项目 利用经过修饰的基因编辑工具绘制癌症的非编码DNA图谱
问题 人类基因组中数百万个区域并不编码蛋白质。其中一些非编码区域携带有与白血病、乳腺癌和其他复杂疾病相关的序列变异,但这些基因组片段如何对基因表达进行调控尚不清楚。研究人员已经利用CRISPR-Cas9基因组编辑对某些基因和调控元件进行干预,以探索它们对健康的影响,但这种技术并不适用于所有的基因变体,也不能正确地修饰控制它们的调控元件。格斯巴赫指出,更重要的是这项技术只能关闭而不能打开基因,而且它仍然依赖于在遗传密码中插入或删除DNA。
解决方案 格斯巴赫和他的同事设计出了一种基于CRISPR-Cas9的表观基因组编辑器,在该编辑器中,Cas9发生突变不再切割DNA,而是与修饰表观基因组的蛋白质片段相融合。这些蛋白质片段定位于非编码DNA区域,这些区域被称为启动子或增强子,并招募表观遗传元件来诱导或抑制DNA转录。
研究小组在人类细胞中使用编辑器来阻断启动b﹣球蛋白基因座和HER2基因座上基因转录的非编码区域。
b﹣球蛋白基因座与白血病有关,而HER2基因座似乎会在乳腺癌中发挥作用。在癌细胞和胚胎肾细胞中完成的实验结果证实,之前已知的调控区域确实能够控制这些基因位点上的基因表达。用向导RNA靶向所有候选基因调控元件,然后对比它们在表达高水平或低水平HER2的细胞基因组中不同位点的丰度,也揭示了之前未被识别的调控HER2表达的非编码区域。使用编辑器打开这些非编码区域显示出了一个更令人惊讶的结果:非编码区域的激活是具有某些细胞类型特异性的,如癌细胞或来自特定器官的细胞,因此,也是具有特定疾病特异性的。“我们基本上是利用表观基因组编辑的方法来探索并绘制非编码基因组图谱的。”格斯巴赫说道。
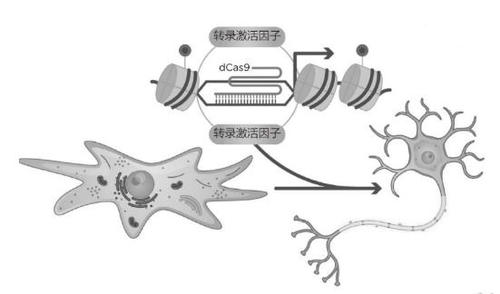
身份转换:利用CRISPR-Cas9修饰的表观遗传标记物,研究人员将特定基因上调,使成纤维细胞转化为神经元
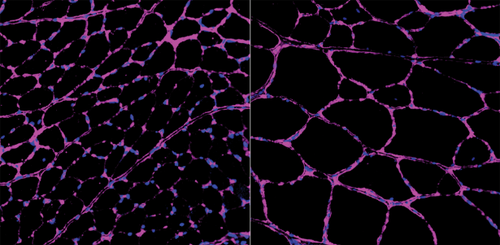
肌肉构建器:与未接受治疗的小鼠(左)相比,经过基因工程改造患有肌肉萎缩症的小鼠,其体内基于Cas9的表观遗传基因激活增加了肌肉质量和胫骨前肌纤维的大小(右)
治疗性编辑
研究员 胡安·贝尔蒙特,细胞生物学家,索尔克生物研究所
项目 靶向基因表达以治疗疾病
问题 对CRISPR-Cas9系统进行修饰以靶向特定的甲基化标记和组蛋白修饰而不切割DNA的尝试,已经在细胞培养中取得了相对成功,但将该项工作转化到活体动物身上具有挑战性。部分原因是因为CRISPR-Cas9系统过于庞大,无法进入细胞核,而表观遗传标记的编辑就是在细胞核中进行的。
解决方案 贝尔蒙特和他的团队着手创造了一个更小的表观遗传编辑器。他们有一个激进的想法:为什么不把编辑器一分为二呢?一部分由一个腺相关病毒携带,将包含Cas9酶;另一部分由第二个腺相关病毒携带,将转运向导RNA和基因开关。这两部分将共同作用来上调或下调基因的表达。
研究小组使用该工具在活体小鼠体内上调了三种基因——治疗肾病的Klotho基因、治疗肌肉萎缩症的Utrophin基因和为糖尿病生产胰岛素的Pdx1基因。上调这些基因可以补偿疾病相关的基因突变,改善小鼠模型中这些疾病的症状。研究人员还利用该工具表达了某些长链非编码RNA以及富含鸟嘌呤和胞嘧啶的基因,这些基因很难被测序,揭示了它们的生物学功能。贝尔蒙特说:“我们的论文证明了用表观遗传学方法治疗疾病是可能的。”
控制胆固醇
研究员 查尔斯·格斯巴赫,生物医学工程师,杜克大学
项目 阻抑基因表达以降低胆固醇
问题 PCSK9基因编码了一种可以调节,并且有时还可以阻止血液中LDL(坏的)胆固醇的清除的蛋白质。一种抑制该蛋白以促进LDL清除的抗体药物已经被批准用于治疗家族性高胆固醇血症。家族性高胆固醇血症是一种遗传性疾病,该病患者体内的PCSK9蛋白无法清除血液中的LDL。其他正在开发的治疗方法旨在利用人工合成寡核苷酸或基因编辑来抑制该基因的表达。由于人们对PCSK9及其与胆固醇的关系做了大量的研究,因此科学家们对它的表达知之甚多。这一基础有助于建立一个可调节它的表观基因组编辑器,格斯巴赫说道。通过使用基于CRISPR-Cas9系统的标准工具,格斯巴赫和他的同事能够轻而易举地通过靶向培养细胞中的特定表观遗传标记来关闭Pcsk9。但是,正如贝尔蒙特的团队所经历过的那样,让这个工具在动物模型中起作用更加困难。
解决方案 当使用CRISPR-Cas9系统时,研究人员通常会从诸如酿脓链球菌等物种中提取细菌免疫系统。但是表观遗传编辑工具并不总是适合标准的腺相关病毒递送系统。因此,研究小组使用了来自金黄色葡萄球菌的Cas9系统;基因编辑软件由一组比酿脓链球菌小1 000个碱基的基因编码而成,并且更适合与向导RNA及其他分子一起在递送系统中修饰基因表达。
正如贝尔蒙特的研究小组所做的那样,格斯巴赫和他的同事们创造了两套递送系统,将表观基因组编辑器运送到活的小鼠细胞基因组中的正确区域。其中一个系统携带来自于金黄色葡萄球菌的非DNA切割版Cas9以及能够编辑表观遗传标记的蛋白质片段,另一个系统则包含靶向Pcsk9基因的向导RNA。当研究小组将该双管齐下的系统注射到成年小鼠体内并对其肝细胞进行检测时,小鼠的LDL胆固醇水平低于接受安慰剂治疗的小鼠。格斯巴赫说,与寡核苷酸或基因编辑相比,这种方法的一个潜在好处就是,它不涉及诸如切割DNA或引入外源肽等步骤,而这些步骤可能会降低效率或激发不必要的免疫反应。