科学家如今正试图拼凑出SARS-CoV-2起源之处、运行机制以及未来前景——而最迫切的问题仍属COVID-19的来源之谜。

1912年,德国的兽医们曾为一个出现发热及严重腹部水肿的猫病例大伤脑筋,如今,这被认为是首个报道了冠状病毒杀伤力的案例。当时的兽医们并不知情,冠状病毒还会引发鸡传染性支气管炎和猪传染性胃肠炎,而小于两周龄的仔猪会因感染后者而几乎全部丧命。
这些病原体之间的瓜葛直到20世纪60年代才显露出来。当时,英国与美国的研究者们分离出了两种具有王冠样结构、能让人类患上普通感冒的病毒。科学家们很快意识到,在患病动物中鉴别出的病毒具有相同的刚毛结构,即病毒的表面插满了尖锐的蛋白突起。在电子显微镜下,这些病毒看上去就像是日冕,因此研究人员在1968年为整个病毒家族起名为冠状病毒。
这是一个十足活跃的杀手家族:犬冠状病毒可以伤害猫,而猫冠状病毒可以侵袭猪的肠道。研究人员过去认为冠状病毒只会在人类中引起轻微的症状,直到2003年严重急性呼吸综合征(SARS)的暴发才展现出这些十项全能的病毒可以多么轻易地置人于死地。
如今,新型冠状病毒肺炎(COVID-19)大流行造成的死亡人数激增,而对于引发此次大流行、被命名为SARS-CoV-2的新型冠状病毒(下文简称新冠病毒),研究人员正艰难地尝试着尽可能多地揭示其背后的生物学机制。这位杀手的档案正逐渐浮出水面,而科学家们也逐渐认识到,新冠病毒已经进化出了一系列适应能力来,从而让自身变得比人类迄今为止遇到的所有冠状病毒都要更为致命。
与其他的近亲不同,新冠病毒能够很轻易地在多个位点攻击人体细胞,其中又以肺部细胞与咽喉细胞为主要目标。一旦进入了人体,这些病毒就可以对各种危险的细胞分子军火库加以利用。遗传学证据显示,新冠病毒可能在大自然中已经藏身了有数十年之久。
但是,还有许多关键信息尚不为人所知,其中包括新冠病毒如何让人致死,是否会进化得更为致命(或者更不致命),以及对冠状病毒家族的下一轮流行病暴发又有什么样的启示。
“一定会有更多的病毒出现,要么已经出现了,要么即将出现。”在英国爱丁堡大学研究病毒进化的分子演化学家安德鲁 • 兰伯特(Andrew Rambaut)教授如是说。
劣迹斑斑的家族史
在所有会攻击人类的病毒中,冠状病毒是个大块头。而与那些利用RNA进行复制、引发近年来大多数新出现疾病的病毒相比,具有125纳米直径的冠状病毒的体积也相对较大。但真正让冠状病毒脱颖而出的是它们的基因组。冠状病毒是所有RNA病毒中具有最大基因组的病毒,有30 000个碱基对。其基因组体量是HIV和丙肝病毒的三倍多,是流感病毒的两倍多。
冠状病毒也是少数具有基因组校对机制的RNA病毒之一,这一机制能够让病毒的能力免受层层累积的基因突变的削弱。这或许就是为什么常见的抗病毒药物,如可以抑制丙型肝炎等病毒的利巴韦林无法遏制SARS-CoV-2的原因。这些药物能通过诱导突变来弱化病毒,但在冠状病毒中,校对子可以清理掉那些突变。
突变对病毒来说也有有利的一面。流感病毒突变的频率高达冠状病毒的三倍,这一速度使得流感病毒可以更快地进化并能躲开疫苗。但是冠状病毒有一个赋予自身致命活力的特殊技巧,那就是它们频繁地重组,与其他冠状病毒交换自己RNA上的片段。通常,相似的病毒之间交换相似的部件毫无意义,但如果两个亲缘性较远的冠状病毒出现在同一个细胞中,那么重组所带来的将是可怕的新版本病毒:能够感染新类型的细胞,并且能够转移到其他物种身上,兰伯特介绍道。
重组经常发生在蝙蝠体内,已经发现由蝙蝠携带的病毒里有61种可以感染人类,而有些种类的蝙蝠最多可以同时寄宿12种病毒。在绝大多数情况下,这些病毒并不会伤害蝙蝠,而关于为什么蝙蝠的免疫系统可以应付得了这么多入侵者,目前也是有一些理论的。2020年2月发表的一篇论文就探讨了被病毒感染了的蝙蝠细胞会快速释放出信号分子,让自身可以接纳而不消灭这些入侵病毒。
对首个冠状病毒诞生时间的推测跨度很大,远至3亿年前,近至10 000年前。科学家们已经知晓的有几十种冠状病毒株,其中有7种会感染人类。在4种引起普通感冒的冠状病毒里,有2种(OC43和HKU1)来自啮齿动物,而另外2种(229E 和NL63)来自蝙蝠。3种会引发重症的冠状病毒——引发SARS的SARS-CoV病毒、引起中东呼吸综合征(MERS)的 MERS-CoV病毒以及SARS-CoV-2病毒——全都来自蝙蝠。但科学家们认为通常应该存在中间宿主——一只被蝙蝠传染并将病毒传给人类的动物。以SARS为例,其中间宿主就被认为是果子狸,一种在中国活禽市场出售的野生动物。
SARS-CoV-2的起源依然悬而未决(详见“杀手家族”)。该病毒与一种在中国云南山洞中发现的蝙蝠体内找到的病毒有96%相同的遗传物质,这也是其蝙蝠起源论的有力证据,研究人员如是介绍。但这里有一个极为关键的不同点,就在于冠状病毒刺突蛋白(又称S蛋白)有一个名为受体结合域的结构单元,这是冠状病毒能够成功侵入人体细胞的关键。SARS-CoV-2病毒结合域特别高效,但云南蝙蝠病毒似乎并不感染人类,这就让SARS-CoV-2与云南蝙蝠病毒具有了重要的差别。
让事情变得更为复杂的是,在一种名叫穿山甲的鳞状食蚁兽身上发现的冠状病毒具有与人冠状病毒几乎一模一样的受体结合域,但病毒的其他部分却仅有90%的遗传相似性,所以也有研究者怀疑穿山甲并不是中间宿主。突变和重组同时起了作用的事实让绘制冠状病毒谱系图变得十分棘手。
从过去几个月里发表的研究结果来看,尽管这些结果有待同行审查,但结论都指出SARS-CoV-2——或者是其高度相似的祖先——可能已经在某些动物体内潜伏了几十年。根据一篇2020年3月在线发表的研究论文,进化出SARS-CoV-2的冠状病毒分支在140多年前就与如今在穿山甲中发现的、亲缘性近的病毒分支分开进化了。接着,在过去40到70年间,SARS-CoV-2的祖先又与蝙蝠冠状病毒进化分离,而后者逐渐失去了自己祖先曾具有的高效的受体结合域,而如今的SARS-CoV-2仍保有这一结构。4月21日发表的另一个研究运用了不同的溯源方法,而得到的结论高度相似。
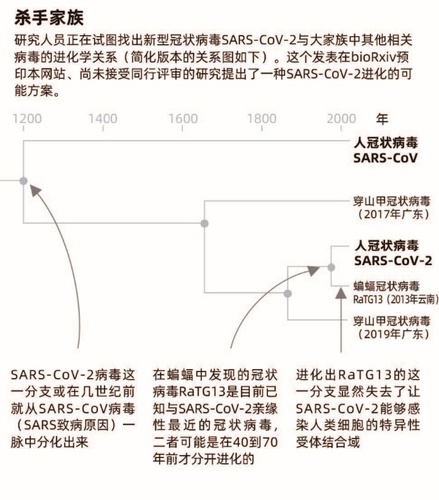
这一研究的共同作者、美国加州大学伯克利分校的进化生物学家拉斯穆斯 • 尼尔森(Rasmus Nielsen)说,这些研究结果都意味着漫长的病毒家族史,里面既有由蝙蝠携带的多种冠状病毒分支,又有可能由穿山甲携带的、具有与SARS-CoV-2同样致命的受体结合域的冠状病毒,而其中的某些病毒也许具有类似的可以引发全球性大流行病的能力。他还强调:“我们有必要继续进行监测,并对人畜共患传染病传播引发新病毒株的出现提高警惕。”
向病毒敞开的两扇大门
尽管已知的人冠状病毒可以感染多种类型的人体细胞,它们主要引起的还是呼吸系统感染。区别在于,4种引起普通感冒的冠状病毒可以很轻易地攻破上呼吸道,而MERS-CoV和SARS-CoV则不容易在那儿占据优势,它们更容易成功入侵的是肺部细胞。
不幸的是,SARS-CoV-2二者兼得且非常高效,这让SARS-CoV-2在人体内有了两个落脚之处,芝加哥大学病理学家肖书渊教授如是介绍。他表示,10个来自身边人咳嗽的病毒颗粒足以让你的咽喉细胞被病毒感染,但是咽喉处的毛发样纤毛细胞会发挥自身作用,将这些入侵者清理出去。如果身边人距离你更近,并且朝你咳出了100个病毒颗粒,那么病毒就可能一路直下抵达肺部。
这些能力的差异或许解释了为什么COVID-19的患者有如此不同的经历。新冠病毒可以从咽喉或者鼻子开始入侵,导致咳嗽以及影响味觉和嗅觉,然后就止步于此;也能够一路向下抵达肺部然后造成器官衰竭。而病毒如何到达肺部,是从一个细胞跳到另一个细胞还是蜂拥而至席卷全身,现在仍不为人知,来自美国爱荷华大学的免疫学家、专门研究冠状病毒的斯坦利 • 珀尔曼(Stanley Perlman)教授如是说。
德国慕尼黑施瓦宾诊所的传染病医生克莱门斯-马丁 • 温特纳(Clemens-Martin Wendtner)则表示,让病毒能够潜入肺部可能是免疫系统的问题。大多数感染者会产生中和抗体,这种抗体是免疫系统针对病毒定制生产的,可以与病毒结合并阻止其进入细胞。但有的人似乎不能产生中和抗体。这也许就是为什么有的感染者在出现轻微感染症状的一周后就痊愈,而其他感染者却被迟发性肺病击倒。但病毒也可以绕过咽喉细胞,直接进入肺部。一般肺炎都会先出现咳嗽和低烧等这些轻微症状,但新冠患者可能会在未出现这些症状的情况下罹患肺炎。能够感染这两个位点意味着SARS-CoV-2把普通感冒冠状病毒的传染性与MERS-CoV及SARS-CoV的致死性结合在了一起,温特纳医生说,这是该冠状病毒株所具备的不幸且危险的特征组合。
新冠病毒能够感染并在上呼吸道积极繁殖可谓是意料之外,毕竟它的遗传学近亲SARS-CoV并不具备这样的能力。温特纳医生的研究团队从9名新冠患者的咽喉提取了病毒样本,并在实验室中进行了培养,然后他们发表了相关的研究成果。结果显示,咽喉部位的新冠病毒繁殖与传播都非常活跃。这一现象解释了这些遗传学近亲在病毒传播方面存在的关键区别。SARS-CoV-2能够在感染症状尚未显现出来时就从咽喉部分脱壳进入到唾液之中,而通过唾液就可以很容易地在人与人之间进行传播。SARS-CoV在这一方面明显就没有那么高效,通常都是在症状已经全面显现时才开始进入到病毒脱壳期,因此也让其变得容易人为控制。
这些差异导致了人们在理解SARS-CoV-2的致死性时出现了一些困惑。有的专家与媒体报道称,SARS-CoV-2不如SARS-CoV致命,原因在于因新冠丧命的人数只占感染人数的1%,而因SARS-CoV丧命的人数占比约是这一数据的10倍。但珀尔曼表示,这样理解新冠病毒是错误的。SARS-CoV-2更容易感染人群,但大多数感染并不会到达肺部,“一旦病毒抵达肺部,那么新冠病毒可能也是同样的致命”。
新冠病毒抵达肺部之后会如何行事尽管不全为人所知,在某些方面也还是与呼吸道病毒相类似。与SARS-CoV和流感一样,新冠病毒会影响和破坏肺泡,这是肺用来向血液运输氧气的小囊泡结构。随着这些小囊泡和血管之间的细胞屏障被病毒破坏,来自血管的组织液会渗入其中,从而阻碍氧气进入血液。包括白细胞在内的其他细胞会进一步堵塞这个通气道。部分患者体内产生的强烈免疫反应会把这些清除干净,但免疫系统的过度反应将会加剧组织的损伤。肖书渊教授介绍说,如果炎症和组织损伤太严重,患者的肺部将再也不能复原,结果就是患者要么死亡,要么康复后肺部伤痕累累,“从病理学角度来看,我们没见到太多的独特性”。
与SARS-CoV、MERS-CoV和动物冠状病毒一样,这种损害不会止步于肺部。SARS-CoV-2感染可能会引发被称为“细胞因子风暴”的过度免疫反应,这会导致多个器官衰竭和死亡。病毒还能感染肠道、心脏、血液、精子(MERS-CoV也可以)和眼睛,并且有可能还会感染大脑。广州医科大学广州呼吸健康研究院因抗击SARS和COVID-19而广获赞誉,而来自该研究院的肺科专家关伟杰副研究员表示,在COVID-19患者身上能观察到肾脏、肝脏和脾脏的损伤,这说明病毒由血液携带,并能感染大量器官或组织。他还提到,哪里需要血液供给,病毒就可能感染到哪里。
尽管病毒的遗传物质出现在多种人体组织中,但最终造成伤害的到底是病毒还是细胞因子风暴,这一点依然不明确。温特纳医生还提到:“我们中心正在进行尸体解剖,这将会获取到更多的数据。”
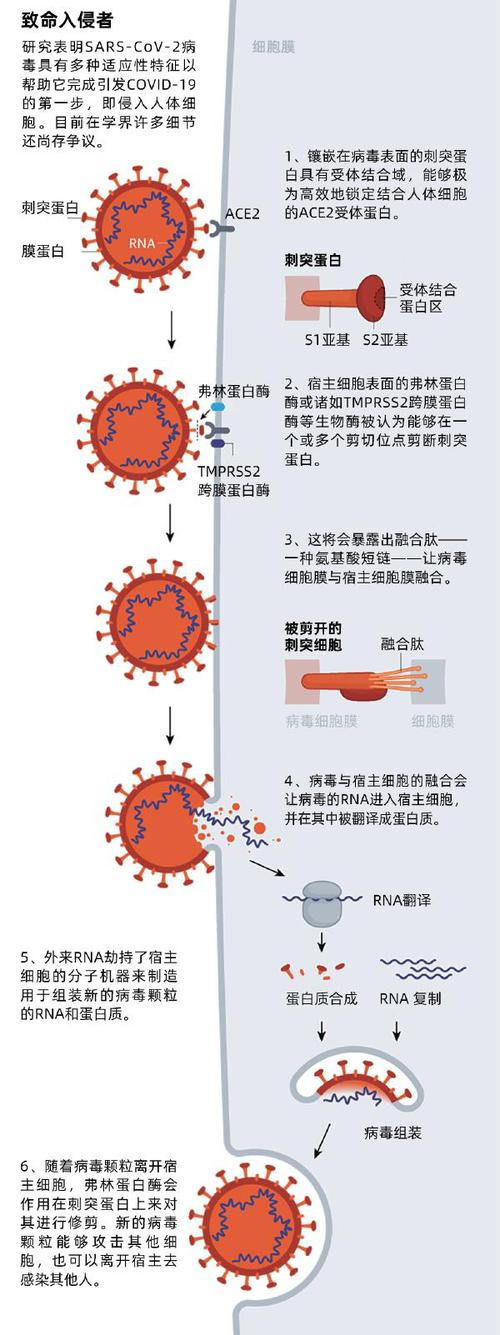
不管是感染咽喉还是肺部,SARS-CoV-2都是利用自己的刺突蛋白突破宿主细胞的保护性细胞膜(见“致命入侵者”)。首先,蛋白质的受体结合域会锁定结合宿主细胞表面的一种名为ACE2的受体。ACE2在流经全身各个脏器的动静脉血管内壁上均有表达,在肺泡和小肠内壁细胞分布尤为密集。
尽管确切的分子机制目前仍属未知,研究证据显示在病毒攻击了宿主细胞后,宿主细胞会在专门的“剪切位点”处剪开刺突蛋白,并暴露融合肽——这是一种氨基酸短链,可以帮助撬开宿主细胞膜,从而让病毒细胞膜能够与之融合。一旦入侵者的遗传物质进入到了宿主细胞,病毒就会强占宿主细胞的分子机器来制造新的病毒颗粒。在此之后,制造出来的病毒后代将离开宿主细胞并去感染其他的人或细胞。
高效位点强力破壁
SARS-CoV-2为了能强行进入细胞而有着专门的装备。SARS-CoV和SARS-CoV-2都能与ACE2结合,但SARS-CoV-2的受体结合域与ACE2结合度特别高,是SARS-CoV结合能力的10到20倍。温特纳说SARS-CoV-2能如此轻易地感染上呼吸道,以至于人们猜测可能存在第二种受体能够让病毒用来发动攻击。
更麻烦的是,SARS-CoV-2似乎能够利用宿主细胞的弗林蛋白酶来剪切自己的刺突蛋白。研究者表示,这让人十分担忧,因为弗林蛋白酶在呼吸道中分布量多,且遍布人体,其他让人闻风丧胆的病毒(包括HIV、流感、登革热和埃博拉)就曾利用弗林蛋白酶来攻入细胞内部。相比之下,SARS-CoV利用的剪切酶就不是那么常见,剪切效率也没有那么高。
科学家们认为病毒对弗林蛋白酶的利用能够解释为什么SARS-CoV-2能如此迅速地从一个细胞跳到另一个细胞、从一个人传到另一个人,甚至可能从动物传到人身上去。美国杜兰大学的病毒学家罗伯特 • 加里(Robert Garry)推测,弗林蛋白酶的卷入让SARS-CoV-2入侵深入肺部的机会比SARS-CoV高了100到1 000倍。“当我看到SARS-CoV-2有弗林蛋白酶酶切位点后,那个晚上我都无法安眠。”加里如是说。
这一特殊的酶切位点的遗传指令到底来自何方,这仍旧是个谜。尽管这可能是病毒通过重组获取到的,但这种特定的组合此前从未在任何一个物种所感染的任何一种冠状病毒里被发现。锁定其来源或许就是谜题里那个能找出“哪个动物是让新冠病毒传染到人类的垫脚石”的最后一片拼图。
游戏尾声
一些研究人员期望着,随着时间推移,病毒为了停留在人体中而发生的一系列适应性突变能够削弱病毒。按此逻辑,病毒会变得不那么致命,并具有更强的传染性。但至今研究人员都未发现病毒被有所削弱的迹象,这大概是因为病毒高效的遗传修复机制。“新冠病毒的基因组非常稳定,我并未看出病毒突变可以引发任何致病性的改变。”中山大学医学院院长、新冠病毒研究者郭德银如是说道。
兰伯特也怀疑病毒是否会随着时间推移变得越来越温和从而饶过它的宿主。“事实并非如此。”他说。只要还能成功感染、繁殖并传给下一个宿主,那么病毒是否会伤害宿主就并不是那么重要。
但其他人认为还有可能有更好的出路,那就是人们能因此获得抗体,这样至少可以获得部分保护,世界卫生组织SARS研究与流行病学部门负责人克劳斯 • 斯托尔(Klaus Stöhr)介绍说。他还提到,免疫力并非万能,二次感染的患者依然会出现一些轻微症状,就是那种普通感冒常出现的症状,也会出现罕见的重症病例。但是病毒的校对机制意味着病毒并不会很快突变,而被感染过的人将会保有由免疫反应所带来的有力保护。
“最有可能出现的局面是,病毒将会在相对短暂的时间内继续传播并感染世界绝大多数人口,”斯托尔意指会在1到2年内发生,“这之后,病毒将可能会接近永远地在人群中继续传播下去。”就像是另外四种温和的人冠状病毒一样,SARS-CoV-2会持续不断地在人群中打转,并主要引起轻度上呼吸道感染。出于这个原因,他补充道,疫苗并非必须之品。
之前的一些研究结果支持这一观点。其中一个结果表明,当人接种了普通感冒冠状病毒229E的疫苗后,他们体内的抗体水平在两周后到达峰值,而在一年之后,抗体水平也只是略微提高。注射疫苗并不能在一年之后让人免受感染,但如果后来被接种人再被感染,那么几乎不会再有什么症状,并且病毒脱壳期也会更短。
OC43冠状病毒为研判此次全球性大流行病的未来发展趋势提供了一个模型。OC43也会引起人类普通感冒,但比利时鲁汶大学的遗传学研究提出,OC43也许在过去曾是致命杀手。研究表明,OC43在1890年前后从牛传给了人,而此前则是从小鼠传给了牛。科学家们提出OC43是1889至1890年间造成逾百万人丧命的全球大流行病的罪魁祸首,而在此前这一大暴发一直被归咎于流感。今天,OC43仍旧在人群中广泛传播,可能正是人群对OC43病毒的持续暴露让绝大多数人对它具有了免疫力。
就算是这一过程能让OC43变得不那么致命,相似的事情是否会发生在SARS-CoV-2上,这在现在还并不确定。一项在猴子身上进行的研究表明,猴子会在感染后保留SARS-CoV-2的抗体,但是研究人员仅仅只报道了感染后首个28天内的情况,所以这一免疫力能持续多久并不明确。抗SARS-CoV-2的抗体浓度也会在感染后的2到3年内显著下降。这些降低浓度后的抗体是否足以预防感染或降低感染严重程度,这一点也还未得到验证。猫、牛、狗以及鸡似乎并不能对能感染它们且有时致命的冠状病毒产生免疫力,这让兽医们在这么多年里一直在艰难地寻找着有效的疫苗。先不提人是否能长期保有对SARS-CoV-2的免疫力这些问题,一些国家正在推行给新冠康复者发放“免疫护照”这一想法,以让这些幸存者能够“既不惧会传染他人,亦不怕再被他人传染”地走出家门。
许多科学家现在仍对被“驯服”后的冠状病毒是否曾像SARS-CoV-2一样具有杀伤力持保留意见。人们更倾向于认为“其他冠状病毒曾经毒性很强,如今已经都变得很温和了”。珀尔曼称,这是对当下形势的一种乐观看法,但我们并没有任何证据的支持。
资料来源 Nature
____________________
本文作者大卫 • 奇拉诺斯基(David Cyranoski)是《自然》杂志驻亚太地区记者。