在过去,人们一直针对免疫系统来治疗乳腺癌,但是20世纪90年代该方法被弃用。然而,乳腺癌疫苗的初现端倪使这一治疗策略重新回到人们的视野。
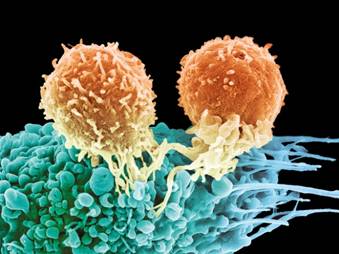
T细胞是白细胞的一种,其通过识别并攻击癌细胞来进行免疫应答,这一过程在免疫治疗中被强化
伊丽莎白·米坦道夫(Elizabeth Mittendorf)是休斯顿安德森癌症中心的肿瘤外科医生。当她在位于马里兰州贝塞斯达的沃特·里德国立军事医疗中心轮科期间,遇到了一个病人。虽然这是14年前的事情,但她至今记忆犹新。那时候这位女性乳腺癌患者已成功治疗乳腺癌超过了15年,但此时疾病复发。“于是我开始思考乳腺癌复发的原因到底是什么,”米坦道夫回忆道,“在我看来,免疫系统是疾病复发的原因所在。”
从那以后,米坦道夫利用她职业生涯的大部分时间进行乳腺癌免疫治疗的研究,而这个领域当时方兴未艾。免疫治疗药物通过提高人体免疫应答来抵抗恶性肿瘤的侵袭。不过针对乳腺癌的免疫治疗如今尚未获得证实,而且许多未知因素仍然存在。但不可否认,这是一个令人激动的时刻。从去年八月起,全世界有超过40项乳腺癌免疫治疗的临床试验正在进行,其中的两项正处于第三期,即获得注册审批前的最后阶段。乳腺癌患者已从这一有效的治疗方法中获益,此外在美国,新近确诊的病例中五年生存率达到90%。但是作为NeuVax疫苗三期试验首席研究者,米坦道夫提到,那些可以增强免疫系统抵抗恶性肿瘤的药物也可能一并防止复发的出现。
“我们希望,有朝一日免疫治疗能够攻克乳腺癌。”西雅图华盛顿大学医学院肿瘤学家玛丽·迪斯(Mary Disis)说,“免疫系统能对癌细胞抗原产生记忆,并搜捕、杀灭身体各个部位(包括骨和脑)的转移癌细胞。我们要做的就是去阐明如何在免疫系统耗竭之前维持其应答水平。”
免疫治疗之历史沿革
“免疫治疗”这一概念的提出应追溯到一个多世纪前。威廉·科利(William Coley)是一位骨外科医生,他在位于纽约的一家医院(后更名为“纪念斯隆-凯特琳癌症中心”)工作。19世纪末,他曾将灭活的细菌疫苗注入病人体内来刺激机体防御系统。到了20世纪90年代,医生开始用大剂量白细胞介素2(IL-2)和干扰素γ(IFNγ)来治疗癌症患者。这两种物质是T细胞(抗感染白细胞)分泌的炎性细胞因子。一些癌症患者在细胞因子的帮助下延长了数十年的寿命。但由于大剂量的细胞因子会诱发全身性的炎症反应,其副作用甚至是致命的,包括血管渗漏和肾脏损害。
乳腺癌疫苗的试验仍在继续,但是也许将这种疫苗与其他治疗相结合才会有最好的疗效
1996年,该领域终于取得了重大突破。安德森癌症中心免疫学家詹姆斯·艾利森(James Allison)和他的同事称,可以通过开放分子关卡来增强抗肿瘤免疫,否则分子关卡会抑制免疫应答。通常,人体依赖这些关卡来调控炎症的发生发展并减少自身免疫疾病所带来的风险。但是当这些关卡发挥上述重要作用时,他们也会干扰机体免疫系统对不断生长的肿瘤的破坏。艾利森的研究表明,对CTLA-4(位于T细胞表面)这一分子关卡进行阻滞可以提高免疫系统对癌症的应答水平,同时该方法带来的副作用比IL-2和IFNγ要少。
2011年,美国食品药品管理局(FDA)批准了CTLA-4抑制剂ipilimumab的上市,用来治疗晚期黑色素瘤。在3期试验中,接受该药物治疗的黑色素瘤患者比未接受此疗法的患者平均多存活4个月。一些超级反应患者至今仍存活。
当艾利森将CTLA-4作为治疗靶点时,其他的研究人员将探索的重点放在T细胞表面的另外一种免疫关卡:程序性细胞死亡蛋白-1(PD-1)。PD-1与癌细胞上的受体结合组成一种复合物,称为PD-1/PD-L1,并“隐藏”肿瘤细胞免于免疫系统的监视。防止这种复合物的生成被认为有利于癌症的治疗。2014年12月,PD-1抑制剂nivolumab获得了FDA的批准,成为最新的免疫关卡治疗药物,其特别用于转移性肺癌的治疗。欧洲于次年4月批准该药物上市。
起初,人们普遍质疑关卡抑制剂对乳腺癌是否有疗效,因为该方法仅针对那些被肿瘤靶向性白细胞(称为肿瘤浸润性白细胞,TIL)侵犯的肿瘤组织。由于黑色素瘤和肺部肿瘤含有许多TIL,因此它们是很容易捕捉的靶点,然而相较而言,乳腺癌总是包含相对少量的TIL。“所以原先的观点是,乳腺癌不会像前两种肿瘤那样对免疫治疗这么敏感,”位于马里兰州巴尔的摩市的约翰霍普金斯大学医学院肿瘤学家蕾莎·艾门斯(Leisha Emens)说,“而且由于乳腺癌已经存在有效的药物进行治疗,它不像黑色素瘤和肺癌那样存在尚未满足医疗需求这样的问题。”
随着关卡抑制剂的上市,人们的态度也明显有所转变。“整个医学界都开始关注关卡抑制剂对所有癌症治疗的潜在地位。”癌症研究所首席执行官兼科研主管吉尔·奥唐纳·托梅(Jill O'Donnell-Tormey)说,“这就是你发现如今的临床研究都集中在乳腺癌的原因。”
基于疫苗的试验
在癌症研究所监管下,共有超过40项的乳腺癌免疫治疗的临床试验正在进行,其中大约2/3都涉及到疫苗。乳腺癌疫苗存在多种形式,例如NeuVax来自于细胞表面蛋白HER2,这种蛋白在一些乳腺肿瘤组织中大量分布,并且是药物赫赛汀的靶点。疫苗也可产自癌细胞DNA或整个癌细胞。在一些情况下,这些疫苗可在实验室内将病人自身的白细胞暴露于肿瘤抗原中,继而“量身定制”出所需疫苗。
不论它们的来源是什么,癌症疫苗都是为了刺激一种特定的抗肿瘤免疫,特别是1型免疫而设计的。1型免疫应答的完成依赖于CD4+T辅助细胞。这种细胞分泌高度致炎细胞因子,例如IFNγ和肿瘤坏死因子-α(TNF-α)。反过来,这些细胞因子又活化了CD8+T细胞,这种细胞继而攻击并杀灭癌细胞。
但是疫苗并不能像单纯的乳腺癌治疗那么有效。例如,在NeuVax的1、2两期,接受治疗的女性患者中有89.7%获得了5年无病生存,相比较而言,未接受疫苗的女性患者这一数据也达到了80.2%――这一结果令人失望。然而,米坦道夫认为,NeuVax可以将5年20%的复发率减半,“这是一个令人印象极其深刻且能给患者带来福音的数字。”
一项名为PRESENT研究的三期试验,计划随机抽取700名患有早期乳腺癌并且低至中水平表达HER基因的女性。这些参与者中一些人接受NeuVax疫苗,其他人接受一种免疫系统刺激物(粒细胞-巨噬细胞集落刺激因子)的治疗。根据米坦道夫的说法,如果该临床试验达到三年无病生存率的结点,FDA将考虑批准这种疫苗的上市――结果有望于2018年公布。
然而,越来越多的研究人员认为今后乳腺癌的免疫治疗将依赖于疫苗与分子关卡抑制剂的联合使用。这样,疫苗将能够刺激T细胞在乳腺进行应答,从而分子关卡抑制剂的效应可以放大并维持在这一水平。有关NeuVax疫苗与分子关卡抑制剂的联合应用的讨论仍在继续。米坦道夫表示,“我认为这将会是一个有效的治疗策略。”
对治疗靶点的打击
同时,该领域正在探索如何将乳腺癌患者与恰当的免疫治疗相匹配。根据柏林夏洛蒂大学医院病理学研究所医生卡斯滕·登克特(Carsten Denkert)的说法,雌激素受体阳性乳腺癌(最常见的乳腺癌)女性患者发展到哪种程度适合免疫治疗仍然存疑。许多雌激素受体阳性肿瘤生长缓慢并且对现有的激素治疗(例如tamoxifen和aromatase)敏感,而上述肿瘤已占据新近确诊的雌激素受体阳性肿瘤的80%。
米坦道夫指出那些由于现有治疗无效而死于雌激素受体阳性癌症的女患者人数超过了诊断为更具侵袭性乳腺癌的患者人数。“机遇和挑战,”她说,“是让雌激素阳性乳腺癌患者成为免疫治疗(例如联合治疗)的更好的受益者。”
克里斯托弗·黑利(Christopher Heery)是马里兰州贝塞斯塔市美国国家癌症研究所肿瘤免疫与生物医学实验室的临床试验小组主任。他表示大多数的免疫治疗试验关注的是高度侵袭性三阴性肿瘤。因为这些肿瘤缺乏雌激素、孕酮和HER2受体,而这些受体又是现有的癌症药物的作用位点,故这种肿瘤更需要免疫治疗的关注。德布·崔帕蒂(Debu Tripathy)是安德森癌症中心乳腺肿瘤科主任,他指出,癌细胞载有越多的突变抗原,它们在免疫系统看来就具有更显著的“非己性”。他补充道,由于三阴性肿瘤比其他类型的乳腺癌表达更多的突变抗原,它们很有可能是免疫治疗的绝佳选择。
研究人员希望能够确定一些生物标记,可以预测哪些乳腺癌的女性患者能够对免疫治疗产生最佳的反应,但是可靠的目标分子仍是个未知数。乳腺癌中的分子关卡阻断剂主要限于抑制PD-L1的药物。MPDL3280A就是其中的一个例子。该药物是一种基因工程改造后的单克隆抗体,由位于瑞士巴塞尔的罗氏公司生产,目前正处于三阴性乳腺癌的一期临床试验。另一种PD-L1抑制剂pembrolizumab由美国新泽西州肯尼尔沃斯市默克公司生产,目前进入二期临床试验阶段,研发目的与前者相同。起初人们认为治疗效果的优化与PD-L1的高表达有关,以至于临床试验已经将PD-L1阴性的女性乳腺癌患者排除在外。但是PD-L1的表达是动态的,它不仅在不同的人之间有差异,而且在同一个人体内随着时间的推移表达量也在不断变化。细胞上调或下调PD-L1的表达是对炎症过度产生的正常反应――上调其表达来减缓炎症反应,而在炎症反应消退时下调PD-L1表达。
如上所述,我们知道PD-L1水平的变化可能取决于样本提取的时机,所以研究人员一直在为PD-L1的低表达是否会影响试验参与者的招募而争论不休。“一些人会说,‘你需要高表达的PD-L1来检验分子关卡抑制剂的功效。’而其他人却说,‘PD-L1的表达量不会影响到我们的研究。’”迪斯说,“而事实是PD-L1并不是一个重要的生物标记。”希瑟·麦克阿瑟(Heather McArthur)是纽约纪念斯隆-凯特琳癌症中心的医学肿瘤学家,根据他的陈述,还有其他前景广阔的生物标记,这里包括可激活T细胞的ICOS,目前预测该生物学标记在黑色素瘤患者体内对ipilimumab较敏感。此外,K167也是一个例子,他是反映T细胞增殖的指标。
登克特说,另外一个有价值的生物标记可能就是肿瘤组织中TIL的表达量。雌激素受体阳性癌往往低表达TIL,但是这一结论并不适用于更具侵袭性的恶性肿瘤,例如三阴性和HER2阳性的乳腺癌。根据登克特的说法,大约有25%的侵袭性乳腺癌是“淋巴细胞占主导的”,也就是说TIL的数量超过了癌细胞的数量。另外25%的乳腺癌,不论哪一种,都没有TIL,其余的一半介于上述两种情况之间。登克特的研究表明,乳腺癌TIL计数对免疫治疗的疗效有指导意义:高计数值意味着对治疗更敏感。此外,他预测免疫治疗也有相同的作用,“无淋巴细胞浸润的肿瘤组织对分子关卡阻断剂敏感的可能性不大。”
登克特说,通过使用疫苗来促进TIL的增殖是一种可行的方法。但是他认为在一些情况下,例如以低TIL水平为特征的肿瘤也许天生就不能被免疫系统识别,即便使用该疗法也是无效的,原因是它们不能表达足量的T细胞受体。登克特目前计划在一项即将启动的临床试验中来检验这个假设是否成立。该临床试验由德国乳腺研究所主持。
然而,黑利提醒人们TIL并不是都一样的,称“区分它们与计数同样重要”。他还提到,TIL可以展现出1型或2型免疫力,其中2型免疫力可以抑制抗肿瘤应答。正如一些研究所暗示的,假如2型TIL在乳腺癌中不成比例地高表达,那么上述即是一个关键的区别。登克特对此表示同意,但是做了如下补充:能识别肿瘤样本中1型和2型淋巴细胞的方法目前还在研发阶段。“免疫学家可能会说‘由于免疫系统的复杂性,我们必须仔细研究免疫细胞的不同类型’这句话是完全正确的。”登克特说,“但是作为病理医生,我们却把肿瘤细胞中所有免疫细胞的数量作为首要任务,而把免疫细胞的分型作为第二步。如果我们将这两部分结合起来并采纳不同的研究方法,我们就可以勾画出更完善的研究蓝图。”
与其他实验性治疗一样,免疫治疗目前主要用于试验进展期、转移性乳腺癌中。黑利说:“为了找到能够快速起效的药物,药物研发总是先针对转移性癌的患者进行。”对于癌症免疫治疗,尤其是疫苗的开发而言,目前的困难是,它们需要长达三个月的时间才能产生适宜的应答,“所以如果有人怀疑这种治疗方式不能起效的话,那就只能说明我们在目标患者的选择上出现了问题。”
不过最终,免疫治疗也许还是可以在早期乳腺癌治疗中取得更大的成功。麦克阿瑟是上述研究中少有的几位研究者。她选择性地将一些肿瘤切片打碎并用一种类似活检针的工具将它们冷冻。她说,一些癌症的免疫源性原本并不强,但人们认为这些细小的肿瘤组织碎片可以引发更强劲的免疫应答,即展现出更强的免疫源性。目前,麦克阿瑟正在检验将这种“冰冻消融”方法与ipilimumab相结合之后在那些初诊诊断为雌激素阳性癌的女患者体内的功效,而并不考虑HER2蛋白表达情况。
“这是肿瘤学领域中一个令人难以置信又激动人心的时刻。”她说,“我们正在见证免疫治疗在诸如黑色素瘤和肺癌等其他实体瘤中的显著进展,同时我们也热切期盼其在乳腺癌治疗中也能大放异彩。要知道,当下我们正处于一个新时代的转折点上。”
资料来源 Nature
责任编辑 彦 隐
更 正
本刊第1期刊发的“噬菌体:一个世纪的历史回顾”一文中“在地球上大概有超过1031种噬菌体颗粒”(43页)更正为“在地球上大概有超过1031种噬菌体颗粒”。

