生长因子调节细胞的行为,同时受抑制物的制约。这两种蛋白质的复合结构呈背对背的蝴蝶状;抑制物伸出的“翅膀”紧紧包围着它的配偶体——
多细胞生物利用分泌的生长因子蛋白质和其抑制基因之间的平衡来调节细胞的行为,从而控制胚胎的发育并维持成体组织的“原状”。格罗伯(Groppe)及其同事在2002年12月12日的《自然》上介绍了由一类生长因子——骨形态形成蛋白质-7(BMP-7)和其抑制基因蛋白质Noggin所组成的一种复合结构。这是对BMP的家族成员和其拮抗物的结合进行的最初研究,表明Noggin和它所抑制的生长因子有着惊人地相似结构,并暗示这两种蛋白质可能源于一个共同的祖先基因。
在一个由单细胞受精卵发育成一个多细胞的成体动物的过程中,细胞的产生必须与细胞的增殖、运动、专化直至死亡相协调。这样的协调需要细胞之间的相互交流,交流的方式之一,就是释放并回应指导细胞行为的各种长短不等的信号。某些重要信号就是分泌出的生长因子蛋白质,其中的一类即转化为生长因子-β总科。BMPs构成总科中的亚类,而该总科最初是根据它异常的生物学特性确定的,即当其被移植进适当的基质中时,BMPs有诱导肌肉中骨骼形成的能力。但除了充当骨骼和关节形成中的重要调节者外,这些蛋白质还调节发育过程中和成年后的许多其他过程。
每种BMP都是由两种同样的蛋白质(单体)构成,由半胱氨酸之间的二硫键结合成二聚体。BMP通过与几乎所有正常细胞表面都有的受体复合物相结合而发挥作用,这种受体复合物由Ⅰ型和Ⅱ型受体构成。结构学研究表明,BMP(以及TGF-β本身)的每一个单体,都能与Ⅰ型和Ⅱ型受体相连(图1a)。这种排列,也许有利于四聚体受体复合物,包括两个Ⅰ型受体和两个Ⅱ型受体的装配(图1b)。这对于把信号转导进细胞是十分重要的。
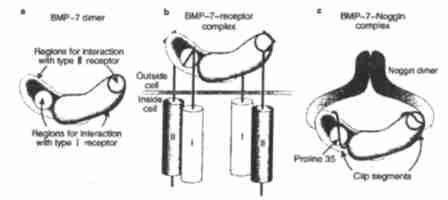
图1.中和生长因子。a.BMP-7(骨形态形成蛋白质-7)二聚体的表现。显示与1型(橙色)和Ⅱ型(蓝色)受体相互作用的界面。b.BMP-7是如何结合成Ⅰ型和Ⅱ型受体的四聚体复合物的,从BMPs向细胞供给信号,从而影响细胞行为。c.由格罗伯等人所解释的MBP-7和其拮抗物Noggin结构的表现。该图显示,封闭BMP-7受体相互作用表面的Noggin的氨基末端“发夹”片段;和插入与Ⅰ型受体中的苯丙氨酸接触的疏水其袋内脯氨酸35的位置。
分泌的生长因子如BMPs,是细胞功能的有效调节者。因此,分泌的抑制基因的复杂网络,就被用来保证把生长因子的活动限制在适当的位置、适当的时间和适当的细胞类型。发育中的有机体就是以这种方式,将生长因子紧紧地束缚起来。在脊椎动物中发现有几种类型的BMP抑制物,Noggin是其中之一(该蛋白质的作用是影响头脑的发育)。迄今为止,哺乳动物基因组内只发现一种Noggin基因,但它对人类是必不可少的:该基因的两个副本,只要有一个发生了突变,就导致骨骼发育异常(骨骼和软骨的发育病)。所以,认识拮抗物如Noggin基因在分子水平上的作用,是发育生物学和人类疾病研究领域的重大课题。
细胞模型图
格罗伯等人用X-射线结晶学测定了Noggin与BMP-7结合的结构。分析结果显示,两种蛋白质的结构惊人地相似。像BMP-7一样,Noggin也形成了一种具有双重对称轴的二聚体。二聚体的形状像一只蝴蝶,其特征结构称为反一并联β一片,在每个单体中从中心体向外伸展成“翅膀”状。中心体调节二聚作用,并形成一个胱氨酸纽结。这是二硫化合物结合的半胱氨酸的特征结构,也见于BMP-7和众多其他分泌蛋白质中。纽结呈环状,由分子内二硫键结合而成。它通过分子间的二硫键稳定二聚体的结构。
BMP-7二聚体的翅状结构和Noggin的翅膀很相似,只是更加致密。在复合体内,Noggin和BMP-7两个蝴蝶状结构背对背地排列。Noggin的翅膀伸出,把BMP-7的翅膀包围起来。全部结构的空间排列,便于每个Noggin单体的氨基末端伸展出去,蜿蜒环绕于BMP-7的周围,并形成一个“夹子”,把生长因子和其受体相接触的表面封闭。确切情况是,在Noggin夹子的氨基末端那一半内的一种氨基酸(脯氨酸35),伸入到了BMP-7上的一个疏水袋内,该袋对于和Ⅰ型受体中的苯丙氨酸的正常接触至关重要。在夹子的另一端,疏水氨基酸和其他氨基酸协作,将BMP-7上与Ⅱ型受体接触的疏水片遮盖起来。这些广泛的接触和BMP-7上面结合位点的封闭,也许可以对Noggin与BMP-7之间的高亲合力和它很强的拮抗活动作出解释。
Noggin的拮抗机理及其生理功能究竟有多大的重要作用?为解答这些问题,格罗伯等人制备了Noggin在每一个相互作用界面上具有不同突变体的版本,并将其用于小鸡的肢芽发育实验。在肢的正常发育中,预示将形成骨骼处的软骨的形成必需要有BMPs的参与。同时,诱导趾间细胞的死亡以便形成指也需要BMP。这样,用Noggin处理发育中的肢芽,造成软骨形成能力丧失和阻止趾间的细胞死亡。
但格罗伯等人发现,在Noggin第二相互作用界面上的突变,明显降低了它和BMP-7结合和拮抗活体内BMPs的能力。相反,第一相互作用界面上的突变,则对和BMP-7的结合能力产生的影响并不明显,对肢芽的发育只产生轻微影响。虽如此,这后一种突变,在许多人类骨骼发育异常病例中,确实会引起关节融合,因此受突变影响的相互作用界面,有着重要的生物学意义。
Noggin-BMP-7的这种复合结构,为分泌的拮抗物如何阻止BMP的功能提供了初步信息。有待探查的问题是,来自其他更大的蛋白质家族——DAN家族——BMP的拮抗物,是否具有相似的总体结构。但至少有一种拮抗物Cerberus,能抑制BMPs以及其他分泌因子的家族成员,包括在结构上与BMP无关的Wnt蛋白质。研究DANS为何能阻止多条途径将是很有意义的事情,而且Noggin和DAN基因在无脊椎动物的基因组内很少发现,但却被保存在各种脊椎动物中。尽管Noggin和BMP-7的生物学功能相反,但它们有着惊人相似的结构,这说明脊椎动物摹仿的能力,可能促进了从一个似BMP的古老基因向BMP拮抗物的进化。
[Nature,2002年12月12日]