研究人员阐明了偶联蛋白质结合和折叠的复杂性,并引导其他研究者向着新药的靶标方向在努力
探秘蛋白质探戈
蛋白质通常不会表现得很温顺――两个蛋白质分子间的相互作用,常常比蛋白质间的锁-钥匙模式更复杂,特别是考虑到在信号蛋白质相互作用时那些正在被形成、断裂和再形成的快如闪电的连接是更是如此。一些关键的信号蛋白质以高度混乱或展开的形式存在,只有当它们遇到它们的分子“舞伴”并与之相互作用,才会折叠成最终的构象。
但是,直到加利福尼亚州斯克利普斯研究所的结构生物学家彼得?赖特(Peter Wright)及其同事们描述了这些“本质上混乱的蛋白质”中的一个与它的靶标间复杂的、快节奏的“舞蹈”,研究人员才开始猜测涉及到这些“舞伴”的动力学和结构变化。赖特及他的合作者对一个无序的蛋白质部分[环磷酸腺苷反应元件结合蛋白(CREB)转录因子的可诱导活化结构域的磷酸化激酶(pKID)]和它的结合舞伴(CREB的KIX结构域)间复杂的、流动的相互作用进行了表征。
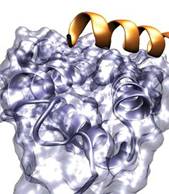
结合在KIX上的pKID(右上端)
首先,非结构性pKID通过弱的、非特异性的、疏水的分子间相互作用松散地结合在折叠的KIX上。然后,当pKID在KIX的表面上翻腾成形时,一个部分结构化的中间复合体形成了。最后,pKID呈现出它完全折叠的形状,结合在KIX上。这是2009年8月的热点论文揭示出的,该论文发表在2007年6月21日的《自然》上。
“彼得的工作做得非常漂亮,他们证明了在这样一个系统中那些步骤都是什么。”多伦多大学的生物物理学家、核磁共振波谱学专家路易斯?凯(Lewis Kay)说。“这是第一次看到过渡态的复合体,它存在的时间非常短暂,且不稳定,”赖特说,“过去,还没有人对这是如何发生的提供过任何线索。”
未解之谜正在展开
自从这篇论文发表后,其他科学家也使用赖特及其同事们使用的同样方法来获悉稍纵即逝的蛋白质之间的相互作用。在加州大学旧金山分校的查尔斯?克雷克(Charles Craik)实验室里,研究人员正在用小分子来“靶向”(target)疱疹病毒蛋白酶中的一个非结构性组分,疱疹病毒蛋白酶是由通过一个单一螺旋结合在一起的两个蛋白质组成的二聚酶。这个非结构性组分跟pKID的作用方式相似――pKID在完全结合于KIX之前是非结构化的。
克雷克的博士后、核磁共振波谱学专家格雷戈里?李(Gregory Lee)说:“我们在尝试着用小分子扰乱这种蛋白质-蛋白质间的相互作用,目的是剔除这些蛋白酶的活性。”赖特的研究结果对他们有所帮助。当非结构化蛋白质元件与它们的“结合伙伴”接触时,这些蛋白质组分是如何表现的?对此知道得越多,将“提供更多关于靶向哪个特定区域的线索”,李说。
蛋白质残基在多种疾病和信号传导事件的发展过程中都是很重要的。2002年,研究人员发现,人类癌症相关蛋白质(HCAP)数据库中,差不多80%的蛋白质都含有无序区域(disordered regions)。事实的确如此,无序结构域(如肿瘤抑制因子p53和激酶抑制剂p21)很可能是癌症发展和其他细胞信号传导级联中的关键因素,赖特说。
根据加拿大麦基尔大学核磁共振波谱学专家安东尼?米特迈尔(Anthony Mittermaier)的说法,对这些蛋白质行为――它们是怎样发现它们的同伴的,又是如何与之结合并折叠的――内在的机理进行详细研究,能为发现并利用疾病或信号传导途径中的脆弱点提供机会。他说:“如果你发现一个折叠的蛋白质和某种稀松的东西之间有相互作用,那将更难知道它们是如何开始的。”并且,了解这个折叠过程能够为药物开发者揭示出新的药物作用位点。他补充说:“获取更多的关于无序蛋白质是如何相互作用的信息,将有希望给我们一个更好的思路,即如何用小分子来扰乱这些相互作用。”
接下来的第二幕
在详细研究pKID和KIX之间的相互作用中,很棘手的部分是:通过相互作用形成的中间复合体高度不稳定,并且用传统的蛋白质成像技术(如结晶学方法)无法检验到。这些“朝生暮死”的结构像幽灵一样出现和消失。为了解决这个问题,赖特和他的团队用核磁共振(NMR)波谱来表征这两个蛋白质中高度动态的变化。为了解释获得的数据,他们使用了一种现有的方法(弛豫分散,以前曾用这种方法来观察酶活性),并把蛋白质折叠事件分离出来。这使他们能够了解涉及到蛋白质相互作用的动力学,而且显示这两个蛋白质组分正在形成一个时而结合、时而松开的中间态。
蛋白质构象
根据路易斯?凯的说法,赖特和他的团队使用的方法“能让我们看到蛋白质相互作用的细节,以前我们无法弄清楚这些”。他运用赖特的方法研究了蛋白质泛素(ubiquitin)和SH结构域3(Src-homology 3 domain,SH3)之间的相互作用,SH3在几个信号传导途径中都是非常关键的。
米特迈尔说,当他开始在麦基尔大学自己的实验室开始工作时,仔细阅读了赖特的论文。“我把这篇论文带到我们的第一次组会上。以它为例子,我们应该找到并完善我们自己的东西。”最近,他和一名同事用NMR波谱和一种热技术开展研究,表明无序的SH3结合一个较短的蛋白质的速度,要比先前证明的快几个数量级。
然而,现在还搞不清楚为什么无序蛋白质有这种行为方式,美国国立卫生研究院(NIH)糖尿病、消化、肾脏疾病研究所的理论生物物理学家格哈德?哈默(Gerhard Hummer)说。然而,他对此有一种解释:在电脑上,他进行了多次模拟试验,在模拟中当他让一个完全结构化的pKID与KIX结合时,“这个预结构化的蛋白质结合的速度就减慢了,只有原来速度的二分之一。”这可能意味着,处于无序状态能增加这些蛋白质传送细胞内信号的速度和效率。“因为pKID不必为即将被启动的结合而折叠,整体部分随时可结合,”哈默说,“因此,处于展开状态没有什么不利。”
[资料来源:The Scientist][责任编辑:则 鸣]



