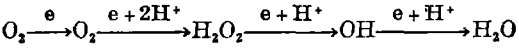大约在本世纪初,越益明白生物化学是一门特殊的有机化学。而且发现,物理化学家的概念可用于细胞能力学。这两种手段,已经支配着细胞生物学的许多分析研究。
关于细胞中金属离子的研究,具有这样的特点:断断续续地证实了某些酶特别需要专一的金属离子;膜现象中则涉及钠、钾和钙离子。现在已逐渐认识到这些金属结合的意义,且已经知道,几乎三分之一的酶类为了起适当的作用而需要有金属离子。金属离子可能紧紧地结合于蛋白质的特异部位,这样,金属离子就是酶分子整体的组成部分,或者金属离子可能只不过成为一种松散的附着物,起着一种激活剂的作用。
细胞生理牵涉的金属离子,大概是生命进化的基础。最近引起极大注意的一个例子是由于这样的发现:形成细胞中许多能量释放的需氧途径,充满着许多危险的副反应。一分子的氧完全还原成水需要四个电子,在连续的过程中,这样可能产生下列危险的中间物:
金属离子和需氧代谢之间的联系是通常有争论的一个特殊例子:细胞已经演化成与金属离子密切结合,许多金属离子在细胞代谢机制中起关键性的作用。金属离子的重要性,是由于各种反应中都涉及到金属离子。
一旦人们脱离了通常以钠、钾和钙(皆受主动运输系统控制)为代表的研究,就很不了解金属离子的细胞控制中涉及的基本过程。从大多数细胞挤出钙,以便使细胞质中维持每立方分米约10-7克分子的离子浓度。然而,这与铁相比还是高的。从上述推算,Fe(OH)3应有10-38(克分子/立方分米)4的可溶性产物,显然在细胞内Fe+++浓度不会超过10-13克分子/立方分米。很清楚,为了避免许多与这些铁有关的溶解性和毒理学的问题,细胞必须演化以复合形式的运输和代谢铁与其他金属的方法。
担心金属离子作为污染物效应的生态学家,曾分析了许多动物,目的在于发现是否存在能反映动物周围环境条件的指标生物种。很明显,动物可以浓缩超过环境水平数千倍的金属离子。也显然,个别器官例如软体动物的消化腺和肾脏,可能含有比其周围环境大一百多万倍的金属离子浓度。从这些观察可以作出两个推论:第一是动物具有处理金属离子的机制,第二是这些系统必须包括某一类型的解毒作用,因为在某些器官中细胞内水平显然比正常致死浓度还高许多倍。
细胞内的铁
首先重要的是把各种普通的金属蛋白(普通细胞代谢的组分)和少数特异蛋白质(涉及金属贮存)加以区别。特异蛋白最好的例子是铁蛋白,它是含有大量铁的细胞内分子。铁蛋白系统出现在环节动物、软体动物、昆虫甚至植物细胞中,但是在哺乳动物肝脏的网织红血球和肝细胞中,铁蛋白系统发展得特别完善,在肝中,铁蛋白提供许多铁,而在血红蛋白合成时需要大量的铁。铁蛋白是一种水溶性大分子,由一种分子量450000道尔顿聚集体的脱铁铁蛋白外壳组成。壳内含多达4500原子的铁,能以氧氢氧化铁贮存起来。马脾的铁蛋白由24个对称的脱铁铁蛋白亚单位组成,亚单位排成直径12 ~ 13毫微米的球体,亚单位间具有六道沟,形成一个直径7 ~ 8毫微米的腔。此腔充满铁离子或将铁离子放空,显然取决于动物的“铁态”。肠粘膜只少量地吸收铁,在血浆中以转铁球蛋白进行运输。转铁球蛋白是一种具有两个铁结合部位的小分子。各种来源的铁最后都变成细胞质库二价铁(Fe++)的一部分,附于一些蛋白质配体。通过蛋白质外壳的一道沟,二价铁进入铁蛋白分子,然后丢掉一个电子而氧化成三价铁类型。这种氧化作用的详细过程尚不清楚,但是脱铁铁蛋白可以加强氧化过程,细胞质分子例如烟酰胺腺嘌呤二核苷酸(NAD)和黄素单核苷酸(FMN)在体外可以促进氧化作用。出现血红蛋白合成时,通过从三价铁贮存型还原成二价铁,铁就脱离铁蛋白分子,这就导致这样的提议:铁的细胞内代谢是通过这个氧化还原系统加以控制的。
如果把铁注射进哺乳动物的腹膜,在几个小时内铁就能诱发脱铁铁蛋白合成增加。然而,放射性标记的这些分子业已证明铁蛋白有大约三天的短半存留期,这是正常的细胞质内蛋白质的代表值。所以,虽然铁蛋白无疑地是一种贮存分子,但它不是静态系统的终产物。
细胞内的铜
似乎在甲壳类中已发现一个贮存铜的系统,这个系统类似于脊椎动物的铁贮存系统。不是含铁的血红蛋白分子,而是这些无脊椎动物有含铜的色素(血蓝蛋白),这种色素在血液中同样起运输氧的作用。褐虾,陆生土鳖和淡水虾的肝胰腺中贮存有大量铜。在个别细胞的膨大液泡中,铜以水溶性络合物存在。这种铜似乎与含硫配件结合,起着用于血蓝素合成的贮存系统的作用。
在脊椎动物中,大量的蛋白质与重金属离子结合,但是如上所述,最重要的细胞内金属是金属硫因(巯基组氨酸三甲内盐)。这些化合物可能被定义为具低分子量(6 ~ 10000道尔顿)的细胞质蛋白(半胱氨酸的含量高达30%),对金属离子具有强结合的亲合力。金属硫因已经从许多脊椎动物的肝、肾分离出来,偶尔脾中也有,正常情况下细胞中金属硫因只有痕量存在,但在动物暴露于亚致死剂量的镉、汞、锌和较少量的银和铜中,能使特殊器官增加这些金属硫因蛋白质的合成和积累。
还不了解金属硫因在细胞中的酶催功能,似乎只起贮存或解毒系统的作用。这两个概念之间的差别与结合是否是可逆的,和金属离子正常结合是多长时间的问题有很大关系。金属硫因的半存留期只有1 ~ 4天,以致一旦诱发蛋白质合成,大概必定是连续的,为了避免释放出游离型的有毒金属离子,被结合的金属,后来常常可以在溶酶体中检验出来,因此,细胞内再循环似乎是很普遍的,可能具有贮存和解毒两种功能。
金属结石
这里提出一个有趣的,与其他重金属积累系统基本类型相似的系统,这个系统是以细胞内无机颗粒形成为基础的,特点是这些颗粒由同心分层沉积的无定形无机物组成。在少数情况下,这些颗粒像是相当纯的钙盐,起暂时贮存的作用。在跳钩虾体内,可以很清楚地看到这种不稳定的功能。蜕皮时,后盲囊上皮以颗粒贮存钙,但在新的外骨骼形成时又释放或溶解出钙。美味瘤蝤蛑蜕皮时,肝胰腺中出现相似的现象,而在淡水蜗牛体内,直到石灰质卵壳形成之前,蛋白腺细胞中都贮存着钙质颗粒。在这些例子中,细胞内颗粒好像也起贮存沉积物的作用。
在大多数情况下,细胞中出现的无机颗粒的成分是不同的,更为不活泼。无机颗粒基本上由细胞中主要无机缓冲剂的钙盐和镁盐(即碳酸盐和磷酸盐)组成,但是,这些离子的克分子比率,不仅在种间而且也在个体间有很大变化。除了这些主要组分之外,许多颗粒还含有很多种痕量元素。例如昆虫细胞颗粒的X-射线微探子分析证明,颗粒含有锰、钡、锶、铁、锌、铜和硅等。
对形成这些结石的细胞,业已进行大量超微结构研究,这种颗粒通常是在内质网或高尔基氏系统的膜结合的囊泡中形成。细胞本身通常与器官相联系,而器官通过一个腔开口于动物体外。从组织学研究和分析研究都有证据表明,有时有些颗粒可能从细胞挤出,以粪便形式从身体排出。所以看来,通过将颗粒沉淀成高度不溶性的无定形沉积物,然后将沉积物排出体外,这好像就是提供解毒细胞内金属离子的有效方法。
颗粒形成的机制
涉及形成这些颗粒的机制还不甚了解。有时,淡水无齿蚌的套膜组织中,出现细胞外结石。这些颗粒主要是碳酸钙和磷酸钙,但是颗粒也含有少量的锰、铁、锌、镁、硅、钡和硫。如果将颗粒脱钙,这些元素大多数消失,但是大部分的锌仍与有机基质结合。这暗示着,颗粒的基质可能有酶催特性,而酶催特性在结石的矿化作用中是很重要的。
虽然迄今只进行很肤浅研究,但看来金属沉淀系统无疑是在细胞中。从原生动物到脊索动物所有各门中,都出现金属沉淀系统,必须把它们的形成看作细胞的基本特性。最近研究发现,在食用牡蛎中,血液中嗜酸性变形虫状细胞积累铜沉积物,而嗜碱性变形虫状细胞形成锌颗粒。也许其能力更为显著的是藤壶的中肠细胞,在一个细胞中可以发现两种不同类型的颗粒:一种颗粒实际上是附于硫的纯铜,而另一种颗粒是磷酸锌。
贮存和解毒的机制
对于理解所有这些现象十分重要的是,贮存与释放必不可少的离子的那些机制和细胞质中解毒与固定离子的那些机制之间的差别。这两种机制的例子容易得到,但是生理学机制的细节则很难得。然而,至少可以有三种:第一包括多功能的分子,它能以共价键,多种多样的离子结合。它是可诱发的,有个短的半存留期,以金属硫因为代表。第二是由失去电子所发动的阳离子积累系统。铁蛋白分子是属这种类型,它很明显是一种专一的短期贮存系统。最后,有成分不定的这种无机物颗粒,也难以认为就包含任何阳离子的专一活性。这些颗粒好像正常地起着长期解毒系统的作用,但有时它们似乎是可逆的,功能像其他两个系统,作为短期贮存沉积物。
(Endeavour 1979年3卷1期2 ~ 6页)