(复旦大学遗传学研究所)
从包括人体在内的哺乳动物正常组织或肿瘤组织分离出来的细胞,都能像单细胞生物似的在实验室条件下生长和繁殖。这些离体培养的细胞同原先长在动物体内一样,除了能生成维持生命活动所必需的物质外,还能具体而微地继续表达该细胞所来源的组织的特性和遗传性状。因此,离体培养的细胞可作为一种模型,用来研究生物体的代谢、生长、分化、发育和衰老过程,研究诱变剂和各种环境因子对生物体的生理学和遗传学效应,研究肿瘤和遗传病的发病机制和防治措施等。
每一个离体培养的细胞都有一整套基因,一个人体细胞的基因组估计至少含有十万个基因。如要弄清楚某个基因的功能,最好是把这个基因从整个基因组里分离出来,在各种可以控制的条件,单独地进行分析。DNA介导转移基因就是分离哺乳动物单个基因和研究其表达的十分有效的方法之一。
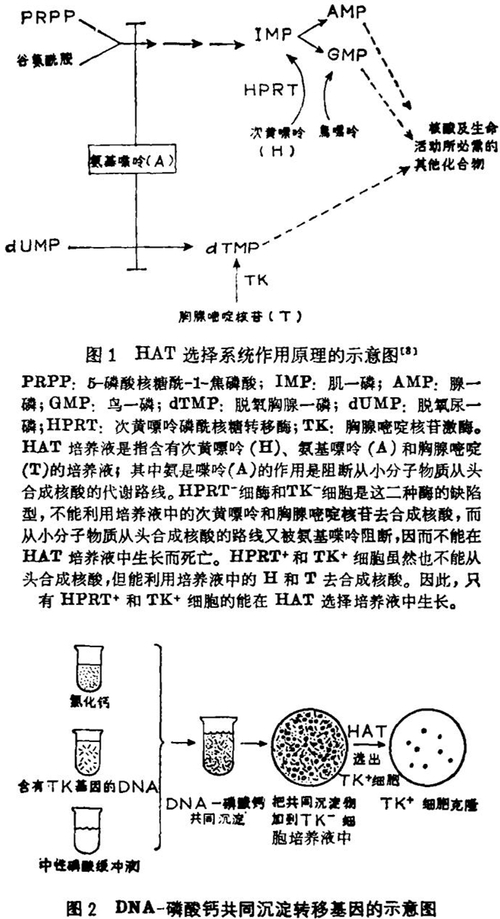
DNA介导转移基因(简称DMGT,DNA-Mediated-Gene-Transfer)是指把纯化的外源DNA引入受体细胞,并使外源ONA中所包含的基因在细胞里表达;这也称为基因转化。早在1944年阿弗利(Avery)等就研究了肺炎球菌不同类型之间的转化同DNA的关系[1] ,但哺乳类细胞的基因转化研究则是从六十年代初才开始的[2] 。1962年兹巴尔斯卡(Szybalska)等第一次报道把给人的次黄嘌呤磷酰核糖转移酶(HPRT)编码的基因,转入了不会合成这种酶的人体突变细胞(HPRT-)使之产生了酶,即变成了HPRT+细胞。由于基因转化的频率很低,所以他们设计了一个选择系统——HAT选择培养基,可以从上百万个HPRT-细胞中准确无误地、方便地把哪怕是只有一个HPRT+细胞选择出来[2,3] 。(选择的原理见图1及说明)在这里,HPRT基因成为DMGT的一个选择标记;随着研究的进展,陆续发现另外一些基因可在另外一些选择系统中作为基因转移的标记。例如,1971年曼尼恩(Munyon)等人[4] 证实简型疱疹病毒(HSV)的胸腺嘧啶核苷激酶(TK)基因,可使TK-细胞获得TK+表型,从而在HAT选择培养液中生长。维格勒(Wigler)等人[5] 则从人、中国仓鼠、小鼠的细胞里抽提高分子量DNA,通过DMGT使腺嘌呤磷酰核糖转移酶缺陷型(APRT-)的小鼠细胞变成APRT+,他们用的是含有氮丝氨酸和腺嘌呤的选择培养液。1980年,维格勒等人[6] 和列维斯(Lewis)等人[7] 成功地转移了给二氢叶酸还原酶(DHFR)编码的基因,使细胞获得了抗叶酸类似物——氨甲喋呤的能力。
选择系统的建立是发展DMGT的一个重要条件。可是自从1962年使用HAT选择培养液后,在相当长的一段时间内哺乳类细胞的基因转化研究迟迟得不到发展,人们对于DMGT的真实性仍持怀疑态度。其原因在于当初是把人的HPRT基因转入了HPRT-人体细胞,这样就很难区分真正的基因转移和回复突变。直到1973年情况才发生根本变化。那样,格拉翰姆(Graham)和范德 · 伊伯(van der Eb)[9] 创建了磷酸钙 - DNA共同沉淀法,即把供体DNA加到磷酸缓冲液里,然后缓缓地加入氯化钙溶液,由此产生的磷酸钙沉淀物中包含了供体DNA,把这种沉淀物直接加到受体细胞的培养液里,使通过细胞的吞噬作用而进入细胞,从而大大提高了转化效率,使基因转化频率远远高于自发回复突变频率。于是人们开始重视这项实验技术的研究和应用。
成功地进行基因转化除了要有明确无误的选择系统外,还要考虑二个重要条件,一是所转移的基因本身的特性;二是合适的受体细胞。基因的特性包括好几个方面。例如,维列克(Willecke)等[10] 用DNA把HPRT基因转入HPRT-小鼠细胞时,他们发现HPRT基因的转移频率只有TK基因转移频率的五分之一左右。据分析其原因可以是:HPRT基因比较大,在转化过程中容易断裂而失去活性;基因表达时对基因整合到受体细胞基因组中的位置有比较严格的要求,基因表达的时间延迟;供体DNA中所含待转移的基因的拷贝数目不一样; 不同的受体细胞等[10,11,12] 。至于受体细胞都是根据实验的目的而加以选定。如在转移TK基因的实验中,最常用的是小鼠L系TK缺陷型细胞株——Ltk-细胞,这种细胞的自发回复突变率极低,据估计小于10-8,实际上还没有看到从Ltk-自发回复突变为Ltk+ 的报道,因此Ltk-细胞是TK基因转化试验的理想的受体细胞[13,14] 。七十年代末和八十年代初,二个研究组以小鼠成纤维细胞NIH3T3为受体细胞,研究了通过DNA转化来转移癌变细胞的形态学表型[15,16] 。这项工作是DMGT应用于癌肿研究的一个重大发展,后来以此来鉴定和纯化导致细胞癌变的基因。
已分离出来的单个基因或基因的一份拷贝能否有效地转入受体细胞并得到表达,这对研究基因的结构和功能有重大意义。维格勒等[13,17,18] 在研究TK基因转化时回答了这个问题。他们用限制性内切酶BamHl切割简型疱疹病毒(HSV)DNA后,发现3.4 Kb(千硷基对)的DNA片段有转化活性,可以得到TK+细胞;而且从转化产生的TK+细胞里提取出来的DNA,照样可用来转化TK-细胞。这些事实说明,尽管病毒的DNA片段很小只有3.4 Kb,只占哺乳类细胞基因组DNA的百万分之一左右,但依然能在受体细胞里有效地得到表达;换句话说,转移单拷贝基因是完全可能的。
在用已经克隆的单个基因作DMGT时,由于供体DNA的量很少,与受体细胞接触而被纳入的机率相应减少,因而转化效率很低。为解决这个问题,可用载体DNA(Carrier DNA)同含有待转移基因的DNA混合在一起去转化受体细胞;载体DNA虽然不含有待转移的基因,或是不能在受体细胞里表达这种基因,但却能提高转化效率。例如用HSV-tk 3.4 Kb的DNA片段直接转化Ltk-细胞时,转化频率只及加入载体DNA后的百分之一。但是用载体DNA得到的转化细胞中,非稳定型的增多,这可能是载体DNA有助于使未整合到受体细胞基因组中的转化基因,在短期内仍能保持和表达[19] 。稍后我将谈到其机制。
在图1中已经提到,在选择培养液中只有已被转化的细胞才能存活和生长,所有未被转化的细胞都将死去,因此可从上百万个细胞中识别和分离出少数转化细胞。可是,绝大多数基因都没有这种选择系统;要逐个分析细胞以判定基因有没有转入,那像大海捞针一般是不可能做到的。在这种情况下,并发转化(Cotransformation)可以解决这个难题。—般的做法是一个有择选标记的基因(如TK基因)连同一个没有选择标记的基因,一起转入选择标记基因缺陷型的细胞(如Ltk-细胞),把在选择条件(如HAT选择培养液)中生长的细胞(如TK+细胞)挑出来。这些细胞中有很大一部分含有非选择标记的基因。这样,只需分析这样一些少量的细胞,就可很方便地分离和鉴辨出非选择标记基因所转化的细胞。并发转化中最常用的选择标记基因是TK基因。并发转化的效率很高,例如,当TK基因同噬菌体ΦX174 DNA,质粒pBR322,兔β - 球蛋白基因和人生长激素基因一起转入TK-细胞后,这些DNA在TK+细胞中出现的频率分别是15/16、4/5、6/8[20] 和9/13[21] 。但是,在并发转化试验中,非选择标记基因的用量一般都远远多于选择标记基因,有的多一千倍[20] ,有的甚至高达二万倍[22] 。那么,在并发转化过程中,这两个基因之间的关系又是怎样的呢?维格勒等[20] 用ΦX174 DNA顺序同TK基因一起转入Ltk-细胞获得许多个TK+细胞,他们把半数TK+细胞继续在HAT培养液中生长,保持选择压力;另一半则改用非选择培养液,这样,即使细胞丢失了TK基因变成了TK-细胞后仍然能够存活和分裂。然后,他们分析了从HAT培养液中生长的9个TK+细胞系,发现其中8个仍保持ΦX174顺序。可是,从非选择培养液中挑出的15个TK-细胞系中,却没有一个含有ΦX174顺序。这个实验表明在并发转化过程中,两个基因可能是连接在一起的,因此当细胞丢失TK基因时,同时也就丢失了非选择标记基因。
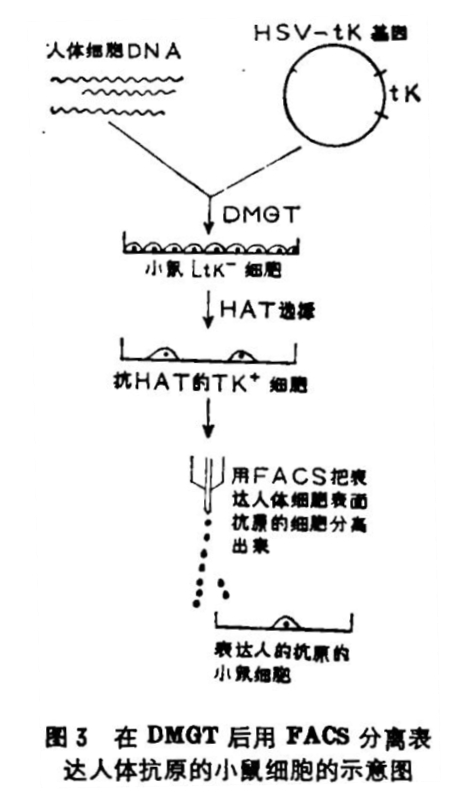
近年来,在分离给细胞表面抗原编码的基因的研究中,萤光激活细胞分类仪(FACS,Fluorescence activated cell sorter)起了很大作用,美国耶鲁大学生物系鲁德(Ruddle)教授的实验室做了很多工作当一个给人体细胞表面抗原编码的基因同TK基因一起转入Ltk-小鼠细胞,用HAT培养液选出TK+细胞后,再用该抗原的单克隆抗体间接免疫萤光染色,利用FACS就可把表达该抗原基因的TK+细胞分离出来,这些细胞里肯定已转入了产生抗原的基因。这里所说的间接免疫萤光染色的基本原理是、用杂交瘤技术制备出该抗原的单克隆抗体,这是小鼠的免疫球蛋白分子;再用它去免疫山羊,从山羊血清中分离出抗小鼠免疫球蛋白分子的抗体,然后接上萤光素。这种连接上萤光素的抗小鼠免疫球蛋白分子的山羊抗血清,就会专一性地结合到单克隆抗体上,使表达该抗原的细胞带上萤光。此时用小鼠骨髓瘤细胞上清液作为对照,用以测定自身萤光和非专一性的背景萤光。最后通过FACS就可把表达细胞表面抗原基因的细胞,一个个地分离出来(图3是该过程的示意图)。
既然两个基因可以同时转入一个受体细胞,而且都能表达,那么一个基因的二个片段或一个基因的两个互补缺陷型能否同时转入一个受体后得到表达。换句话说,在正常情况下不会表达的基因,会不会与另一个类似的基因或DNA片段在同一个受体细胞里相遇而表达其功能。由于人体细胞在日常生活中会受到细菌、病毒和其他病原体的感染,它们的一些有缺陷的基因在遇上另一些DNA片段后会不会得到表达,从而引起有害的效应呢?因此研究这个问题是很有意义的。笔者和林彬芳[27] 在分离人体TK基因时,用单独不能表达的TK基因的两个片段一起去转化Ltk-细胞,以及用TK基因的一个片段和TK的cDNA的一个片段一起转化Ltk-细胞[28] ,结果都能产生TK+细胞。用印迹法(Southern blot)杂交证明两个片段已首尾连接成一个完整的功能单位。斯曼尔(Small)等[29] 用HSV的二个不同缺失型的TK基因同时转化Ltk-细胞,转化频率大大高于用任何一种缺失型单独转化时的频率,表明两者得到重组并在功能上互补了。威斯康辛大学泰明(Temin)教授的实验室用鸟类逆转录病毒DNA的片段,单独地或混合地去感染细胞,然后测定其感染能力,证明DNA片段单独感染时不产生感染病毒,不同片段混合感染则产生完整的病毒DNA[30] 。特 · 圣 · 弗森特(de Saint Vicent)等[31] 研究叙利亚仓鼠CAD*基因二个有重迭顺序的片段去转化中国仓鼠CAD-细胞,得到转化细胞后经原位杂交证明,转入的基因片段整合在同一条染色体的同一位置上,但不同细胞的整合位置并不相同。这些实验表明在哺乳类体细胞里有一个重组系统,可以催化同源交换。
现在要问外源基因或DNA片段是怎样进入受体细胞,以及在受体细胞里是怎样表达的。鲁德实验室的研究人员在电子显微镜下仔细观察了DNA - 磷酸钙沉淀是如何进入受体细胞的[32] 。他们指出细胞的吞噬作用是主要途径,磷酸钙沉淀(Ca-Pi)有着重要作用。Ca-Pi可使吞噬泡的膜局部溶解,让DNA通过而进入细胞质;也可使DNA直接穿过质膜进入细胞。在进入细胞后,Ca-Pi可保护DNA不受核酸酶和吞噬体的作用。呼吸抑制物和分解细胞里的微管的药物如秋水酰胺等可遏制DNA Ca-Pi进入细胞。因此,细胞吸收DNA Ca-Pi的过程类似于“受体介导的”吞噬作用。Ca-Pi也许是专一性地吸附在与吞噬有关的某些细胞表面基团上;在一定的pH范围内(PH7.1—7.5)和一定的DNA浓度(10—25微克DNA/转化系统)等条件下形成的DNA Ca-Pi沉淀物,才有可能进入细胞。如在其他条件下生成的沉淀物,可能因为构型不同以致无法吸附在表面基团上而不能实现转化。此外,这种细胞吞噬作用还同能量和温度有关。当细胞里缺少ATP或在低于37℃温度下培养时,都观察不到细胞吞噬过程。
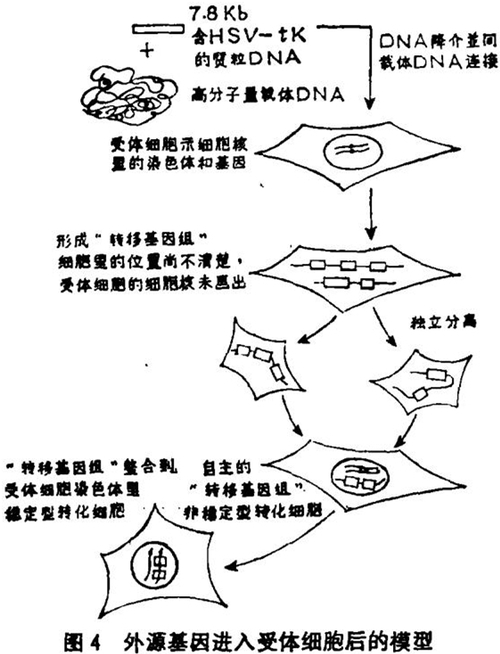
外源DNA进入受体细胞后的情况,鲁德等[33,34] 提出了一些模型来解释。转移基因(例如TK基因)先是同高分子量的载体DNA连接在一起;形成“转移基因组”(“trans-genome”) [35] 转移基因组可以带有转移基因的若干份拷贝,如果它没有整合到受体细胞的染色体里去,但能够抗御受体细胞的核酸酶的作用和有自主复制以及使转移基因表达的能力,那么,受体细胞仍能在选择条件下存活;只是随着细胞分裂的进行,将不断地丢失“转移基因组”,因此获得转移基因表现型(如TK+)细胞的数目将随细胞世代而逐渐减少。这就是非稳定型转化细胞。反之,当转移基因组整合到受体细胞染色体里后,则每一个子细胞都能得到转移基因,这就是稳定型转化细胞。图4以HSV-tk基因为例,说明非稳定型和稳定型转化细胞的生成。
这个模型有其实验依据。斯坎哥斯(Scangos)等[33] 用HSV-tk基因的3.5 Kb病毒DNA片段插入pBR322 BamHl位置所构成的质粒pTKx-1为供体DNA,用HindⅢ酶切使之成为线状,同高分子量载体DNA混合后去转化Ltk-细胞,他们选出了几个TK+细胞。让这些TK+细胞在非选择培养液(HT培养液)中生长一个星期,这时细胞不管是否仍保持TK基因都能正常生长和繁殖。然后每隔一个星期或十天,把同样数目的细胞分别接种在HAT和HT培养液中,计算生成的细胞克隆数。如果形成的是稳定型转化细胞,它们始终保持着TK基因,则HAT中的细胞克隆数目同HT中的细胞克隆数目的比值应该接近1。如果形成的是非稳定型转化细胞,则据估计每天有10%的TK+细胞失去TK基因而变成TK-细胞,这时HAT中的细胞克隆数目必定少于HT中的细胞克隆数目,二者之比一定小于1,而且随着培养时间的延长,这个比值将逐渐趋近于零。他们获得的实验结果确是如此。
当前,DMGT的最大用处是用来分离哺乳类的基因;同时由于DNA可以切割、连接、改变其组成、分析其顺序,因此DMGT又可用以研究DNA的结构与功能之间的关系以及基因表达的条件。
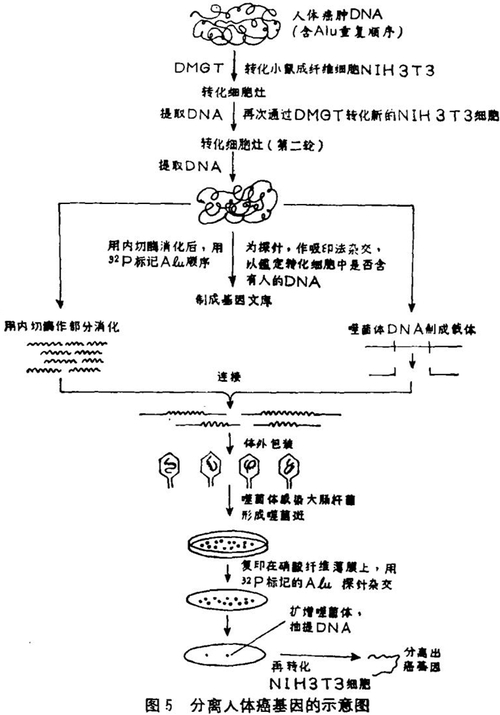
图5是运用DMGT来分离纯化单个基因的基本做法。先提取高分子景ONA作为供体(例如,正常的人体DNA或人体癌肿DNA),用来转化异种的哺乳类细胞(例如小鼠细胞)。在选择条件下把已转化的细胞分离出来。如果我们要分离人的TK基因,则在HAT培养液中的Ltk+细胞挑出来。如果我们要分离人的癌基因,则以小鼠成纤维细胞NIH3T3为受体,当这种细胞因转入了人体癌肿DNA中所包含的癌基因而转化成癌细胞时,将会失去正常细胞的接触抑制作用,在培养瓶壁上不再形成单细胞层,而是细胞相互堆积形成一个转化细胞灶。这种细胞的形态特征就成了癌基因转化的选择标记。所有这些转化细胞都是含有少量人体DNA的小鼠细胞,换句话说,这些转化细胞的DNA是大量的小鼠DNA中夹杂极小一部分人的DNA,可是要分离的癌基因正是在人的DNA中,现在的问题是怎么把也许只占百万分之一的人的癌基因分离出来。这里要谈到DNA的重复顺序。
人体DNA中重复顺序占20—30%,其中最大的一族是Alu顺序[36,37] ,人体单倍体基因组合有30万份Alu顺序,约占人体DNA的3—6%。Alu顺序长300 bp(碱基对)。在长为300 bp的重复顺序中,60%有核酸内切酶AluⅠ的切点,所以称为Alu顺序。Alu重复顺序散布在基因组里,迄今已分离出来的结构基因的附近都有Alu顺序。因此,Alu顺序可作为人体基因存在的指征,也就是说,只要把人的Alu顺序分离出来,就有可能把它附近的人体结构基因一起“带”出来。当然除了Alu顺序外,还可以用别的顺序作为指征。在把小鼠转化细胞DNA制成基因文库后,可用32P标记Alu顺序作为探针,把含有Alu顺序的重组DNA分子挑出来,逐个地进行测定和分析,最后就可得到所需要的基因。
施嘉和等[15] 最早用DMGT的方法来研究癌细胞DNA的转化。目前用这种方法已分离得到好几种人体癌肿的癌基因,如膀胱癌[38] 、视网膜母细胞瘤[39] 等。
近二十年来,特别是在发现用DNA磷酸钙共同沉淀物转移基因以来的十多年间,DMGT得到了很大发展,成为具有多方面应用潜力的有效的实验方法。它沟通了细胞遗传学、体细胞遗传学和分子遗传学的研究领域,使遗传学研究从细胞、染色体水平深入到分子水平,并在基因工程研究中有实际应用价值,预期今后将会对遗传病和肿瘤的治疗和基因工程作出贡献。
主要参考文献
[1] Avery,O. T. ,et al. 1944 J. Exp. Med. 79,137.
[2] Szybalska,E. H. ,et al 1962 Proc. Natl. Acad. Sci. USA,48,2032.
[3] Szybalski,W. ,et al 1962 Natl. Cancer Inst. Monogr. 7,75.
[4] Munyon,W. ,et al 1971 J. Virology,7,813.
[5] Wigler,M. ,eta] 1977℃ell,11,223.
[6] Wigler,M. ,et al 1980 Proc. Natl. Acad. Sci. USA,77,3567.
[7] Lewis,W. H. ,et al 1980 Somat. Cell Genet. 6,333。
[8] 赵寿元 1880遗传2,6.
[9] Graham,F. L. ,et al 1978 Virology62,456。
[10] Willecke,K. et al 1979 Mol. Gen. Genet,170,170。
[11] Scangos,G,et al 1981 Gene,14,1
[12] Peterson,J. L,et al 1980 Proc. Natl. Acad. Sci. USA 77,6468。
[13] Wigler,M. ,et al 1977 Cell,11,223
[14] Perucho,M. ,et al 1980 Nature 285,207。
[15] Shlh,C,et al 1979 Proc. Natl. Acad. Sci. USA 76,5714
[16] Cooper,G. M. ,et al 1980 Nature 284,418。
[17] Pellicer,A,et al 1978 Cell 14,133。
[18] Wigler,M. ,et al 1978 Cell 11,725。
[19] Huttner,K. M. ,et al 1981 J. Cell Biol. 91,153
[20] Wigler,M. ,et al 1979 Cell 16,777.
[21] Robins,P. M. ,et al 1981 Cell 23,29
[22] Hnttner,K,M. ,et al 1979 Proc. Natl. Acad. Sci,USA,76,郎20。
[23] Kamarck,M. E. et al 1982 Somat. Cell. Genet. 8,385。
[24] Kamarck,M. E. et al 1983 Cytometry 4,99。
[25] Barbosa,J. A. ,et al 11983 Perspectives on Genes and Melecular Biology of Cancer,ed. Bobber son,D. L & G. F. Saunders;Raven Press,New York,P. 221。
[26] Barbosa,J. A. ,et al 1988 Gene Expression in Normal and Transformed Cells,ed. Celia,J. E. &R. Bravo,Plenum Publishing Corp,p. 379。
[27] Pin-Fang Lin,et al 1983 Proc. Natl. Acad. Sei. U. S. A. 80,6528
[28] 赵寿元1884第三届国际细胞生物学大会专题学术讨论会(上海)论文摘要集:43页
[29] Small,J. ,et al 1983 Science 219,174.
[30] Miller C. K. ,et al 1983 Science 220,606.
[31] de Saint Vicent,B. R. ,et al 1083 Proc. Natt Acad. Sci. U. S. A. 80,2002.
[32] Loyter,A. ,et al 1982 Expt. Cell Res. 139,223.
[33] Scangos. G. A. ,et al 1981 Mol. Cellular Biol. ,1 ,111.
[34] Huttner,K. M. ,et al 1982 Natl. Cancer Inst. Monogr. 60,63—68.
[35] Klobucher,L. A. ,et al 1979 Nature 280,657.
[36] Schmid,C. W. ,et al 1982 Science 216,1065.
[37] Ullu,E. ,1982 TIBS,June,26.
[38] Shih,C. ,et al 1982 Cell29,161.
[89] Shimizu,k.,et al 1983 Proc. Natl. Acad. Sci. U. S. A. 80,383.
————————
* CAD——高等真核细胞中催化尿嘧啶核苷生物合成最初三个步骤的多功能酶,它含有氨甲酰基 - 磷酸合成酶,天冬氨酸 - 氨甲酰基转移酶和二氢乳清酶活性。