控制人口的迅速增长,不仅是我国,而且是全世界面临的重大问题。预计本世纪末全球人口将超过六十亿。尽管采用和推广了多种节育措施,由于现有的方法不尽完美,影响其推广使用。人们都期望能有一种简易、有效无害而且可逆的避孕方法,而免疫避孕就是这样一种理想的方法。这意味着,只要注射一种特制的“疫苗”,就可避孕半年以至数年。从目前的研究状况来看,免疫避孕有如下优点:使用方便、乐于被接受、易推广;一次免疫后可避孕相当一段时间,若要继续避孕,届时再注射一次即可;作用可逆,无需采取任何措施,免疫抗体随时间流逝而自行消失,正常生育状态亦随之恢复;疫苗有高度专一性,不产生副作用,不干扰人体正常生理,不影响性机能和其他功能;可随时检测免疫对象是否处于不育状态。
早在1899年兰特斯坦(Landstein)和梅奇尼可夫(Metchinokoff)就进行了生殖抗原的免疫试验,在异种动物身上得到抗精抗体。1932年巴尔斯金(Babkin)用新鲜精液注入妇女体内造成不孕状态12个月之久。1948年梯勒(Tyler)报道卵子和精子内含有一些物质,它们以免疫作用方式在受精中起重要作用。1961年罗(Rao)发现抗HCG血清能阻止人绒毛膜促性腺激素(HCG)和LH的生物活性,提出了应用免疫方法来干扰HCG功能从而达到避孕的可能性,1968年门奇(Menge)用胎盘匀浆免疫牛,发现可降低牛的生育率,证实胎盘内具有抗生育成分。五十年代后,由于Freund佐剂在实验免疫学中的广泛应用,成功地建立了“免疫性无精子的动物模型。”1968年福辛(Voisin)用睾丸组织结合佐剂免疫动物,造成睾丸内精子细胞的脱落和溶解,但不影响间质细胞,因而动物能继续产生雄性激素,维持第二性征及正常性欲。1972年西弗斯(Shivers)发现用卵子外层透明带免疫动物后,动物产生抗体阻止精卵结合,从而开辟了透明带免疫避孕的途径。1976年斯特温斯(Stevens)和塔尔屋(Talwar)对绒毛膜促性腺激素HCG的免疫避孕的研究,将免疫避孕的研究推向了高湖。
临床上不明原因的不育患者,从另一角度找到了用免疫学方法进行生育控制的实际价值,1954年威尔逊(Wilson)和鲁姆凯(Rümke)各自发现几名不明原因的不育男子的血清可使精子凝集,1959年鲁姆凯调查了2000例不育男子,发现其中3%精液有精子自身凝集现象。1964年弗兰克林(Franklin)和肖威梅尔(Schwimmer)分别报道,不明原因的不育妇女血清中,精子免疫阳性率分别为72%和40%。在相当一部分妓女中,发现她们身上含有抗精抗体。国内外资料都表明输精管结扎者中,至少有一半在手术结扎后数月乃至数年体内含有抗精抗体。在正常情况下,男性生殖道比身体其他任何组织,内在化程度高得多,而且存在着血 – 睾屏障,故人体不会产生抗精抗体。如果成年后,生殖器官发生炎症或堵塞,导致精子外渗,身体的其他组织本能地视精子为“异物”,从而导致免疫反应。妇女在正常情况下,女性生殖道会酶解精液抗原,但在某些条件下或者存在功能映陷时,酶解作用缺乏,结果抗原仍能保持完整从而诱发免疫反应。其次生殖道的感染可能起类似的佐刑作用。免疫不育者的一般健康状况良好,没有因免疫而引起器官损伤或系统疾病的迹象。1977年西弗斯还发现不明原因的不育妇女血清中存在抗透明带抗体,很明显,免疫不育者的这些临床资料,展示了免疫避孕实用化的可能性。
免疫避孕的基本原理是向机体引入免疫原,诱发系统免疫,干扰生殖过程中的某一环节而导致不育。虽然免疫攻击生殖系统其中任何一个“靶子”即可造成不育,但实际上必须考虑众多因素。首先要确定生殖过程中的某些关键性抗原分子,用它作免疫疫苗能刺激机体的体液免疫或细胞免疫,从而“击中靶子”。欲产生足够强烈的免疫反应,也应选择合适的佐剂、免疫途径及免疫疗程等。一个理想的避孕疫苗应符合下列标准:
1. 特异性强,只作用于“靶子”,所产生的抗体与机体其他成分无交叉反应;2. 具有高度免疫原性,足以刺激机体产生免疫反应;3. 不干扰正常的生理功能,不干扰月经周期,不影响性功能;4. 抗生育效应可逆;5. 抗原来源充足,价格低廉。
七十年代以后,国内外学者已从不同环节对免疫避孕进行深入研究。有些在动物身上获得满意避孕效果,有些已进入人体临床试验阶段,现分别介绍如下。
一、精子抗原
早在本世纪初已证实精子是一个抗原。在动物和人体实验中、用睾丸或精子不管对雄性作自身免疫或对雌性作主动免疫,均可产生免疫不育。已有证据表明,睾丸和其他组织,如脑,具有共同抗原;睾丸组织细胞与血型抗原亦有共同抗原。为避免交叉反应,研究集中在精子抗原方面。况且尽管精浆中许多成分具有抗原性、但大多数研究表明,利用精浆液抗原产生的抗体并不足以抑制生育,从豚鼠精子中分离,纯化出四种抗原S. P. T和Z,它们各有自己特有的免疫学和细胞学性质。T抗原结合在精子膜上,能诱导精子制动抗体,用来免疫雌雄动物,都能产生抗生育效果。S在顶体上,是一种热稳定和水溶性糖蛋白。与非精子毒性抗体一起引起延迟过敏反应。P位于顶体内,是一种β蛋白,抗原S、P、T皆诱发自身免疫使无精子生成。而抗原Z则引起异体免疫,增加雌鼠死胎数。
6.1
从家兔的精子膜分离出RSA-1抗原,其抗体能降低生育力75%。1982年波尔逊(Poulsen)纯化到一种人精子膜抗原,发现其至少有三条肽链组分,分子量一个为41,000,另二个为77,000。近几年,关于精子膜抗原的研究十分活跃。
研究较多的另一类精子抗原是精子特有的酶类。研究过的酶有多种:透明质酸酶,顶体蛋白酶、山梨醇脱氢酶、放射冠分散酶以及涎酸酶等。
对乳酸脱氢酶 - X(LDH-X)的抗生育效果曾进行了专门研究。这种LDH-X在结构上不同于肌肉和其他组织的LDH,它位于精子中段,已从啮齿动物,牛和人的精子上分离纯化出结晶的LDH-X。并测出隞LDH-X分子量为140,000。LDH-X是组织专一性的,但不具有种的专一性,故来自某一动物种的LDH-X可应用于其他动物种。用LDH-X免疫雌性明显阻碍受精,免疫雄性可诱发发生无精子。LDH-X免疫避孕的问题在于它的抗生育效果不是百分之百。关于LDH-X与顶体酶的合剂及LDH-X与透明质酸_合剂,是否比单一抗原的抗生育效率会更高,正在进行探讨。
二、卵子抗原及其他女性生殖道抗原
在卵巢、子宫、卵母细胞、着床前胚胞和女性生殖道的分泌物中,已识别和分离出专一性和非专一性糖蛋白或蛋白抗原。如输卵管中胚胎发育抑制因子,子宫分泌物中的一种与透明带脱落有关的肽酶等。其中以卵子外层的透明带抗原的抗原性最强。
透明带的完整性对生殖来说极为重要。透明带不仅对受精来说是必需的,而且阻止卵粘附于输卵管上皮组织,也防止疏松结合的处于二细胞和四细胞阶段之胚泡在转移时解离。现在认为,精子接近卵子似乎是随机的,并无数量的限制,而精子与透明带的结合必须发生在透明带表面的精子受体位置。在正常情况下,精子进行穿透时,受体被“去活”。如果受体位置或其附近存在抗原,则所产生的抗体将遮盖透明带的精子受体部位或改变透明带性质,因而阻止精子的穿透以及与卵子的结合。实验证明,溶解的透明带溶液对精子具有受体作用,当活动的精子预先用透明带溶液处理后,尽管精子活动性不变,但这种精子不能再穿透卵子。
透明带自次级卵母细胞阶段开始发展,直至胚胎着床前脱落。正常情况下,胰蛋白酶和链霉蛋白酶能溶解透明带。但用透明带抗血清处理后,在透明带外层出现沉淀层,并且难以为胰蛋白酶和链霉蛋白酶所溶解。精子也不能穿透这种透明带进入卵子。即使精子进入卵子,随后的抗原 - 抗体反应也能将胚泡禁锢在#明带内,阻止透明带脱落,从而阻止胚胎着床。抗体与透明带抗原作用后,除阻止精子穿透外并不影响卵子其他机能,因为精子仍能使无透明带卵子受孕。透明带抗原既具有组织特异性,只与“靶”器官起作用,又具有所期望的那种交叉反应特性,即哺乳动物的一个种的透明带抗原与其他种动物以及人的透明带抗原起交叉反应。由于可从兔、牛、羊、猪的卵巢制备透明带抗原,这就解决了透明带材料来源问题。
用田鼠热溶解透明带抗原免疫小鼠,可维持3个月不育,以后又恢复正常。用抗血清处理正常卵子,可使精子不能穿透其透明带。将免疫后的动物在交配后杀死,从其输卵管内取出卵子作形态观察,可见透明带外表不规则,多孔易碎,但卵黄膜完全正常。这种抗血清与鼠,罗猴的卵的透明带发生明皇的交叉反应。检查了动物体内其他组织,则未发现任何变化,如果用I131标记的兔对田鼠卵抗血清IgG注入田鼠体内,可以看到标记物从肺、臂、脾、子宫中很快消失,但在整个免疫不育期内,始终存在于卵巢之中。用热溶解之牛卵透明带抗原免疫赚兔,结果表明所产生的抗血清对兔和罗猴都有交叉反应,与同种免疫反应一样强烈。抗血清对狨、田鼠、狗和人卵都有交叉反应。体内外实验表明,抗体阻止精卵结合。从免疫过的兔取出卵子,与萤光化合物培育,证明内源抗体已复合于卵透明带上面。
作者本人用猪透明带抗原免疫家兔,实验结果很大程度上证实上述现象。在不明原因的不育妇女血液中,检测到抗透明带抗体,除自身免疫反应诱发产生自身抗体这一原因外,也可能因一种存在于女性生殖道的细菌所致,它具有与透明带有交叉反应的抗原。目前,关于透明带免疫避孕的研究,国内外正是方兴未艾。
三、胎盘抗原
胎盘是妊娠期特有的器官。干扰胎盘功能,妊娠就维持不下去。早期的动物实验,证明抗胎盘血清是一种致流产剂。胎盘特异蛋白SP1,分子量90,000,由合体细胞制造,其浓度在妊娠三月末达峰值,一直维持到足月。PP5和PAPP-A也是与妊娠相关的非激素活性蛋白,曾用免疫学方法干扰这些特异蛋白以观察其抗生育效果。对胎盘抗原研究最广泛是胎盘激素之一——人绒毛膜促性腺激素。
HCG系胎盘午早期发育阶段,一般认为受精后8 ~ 9天就开始分泌的产物,也有人认为,胚泡一形成即产生HCG。HCG功能之一是维持妊娠黄体,使黄体增加雌激素和孕酮的分泌。如果用免疫方法阻断HCG,就可能终止妊娠。
HCG作为一个“自身”蛋白质,人体通常对它是有免疫耐受性的。用作主动免疫时,必须在它的分子上连结半抗原或载体,才能获得较大的免疫原性,初期研究表明,应用和半抗原( 氨基苯磺酸)结合的HCG,免疫妇女能产生抗HCG抗体。可是,这种抗体在抑制HCG作用的同时也抑制黄体生成激素(LH),造成月经失调。
HCG免疫避孕的研究今后必须解决下列问题:1. 克服人的个体差异,使免疫对象都能产生高滴度抗体水平,并维持相当一段时期。防止抗体滴度下降而可能出现的流产。2. 必须充分排除HCG抗体与LH及其他激素或多肽交叉反应的可能。3. 已在一些非胎盘组织(如肠粘膜)及肿瘤细胞中也发现微量HCG样物质,其生理功能至今尚不清楚。故还必须作长期安全性的研究。
四、性腺轴生殖激素抗原
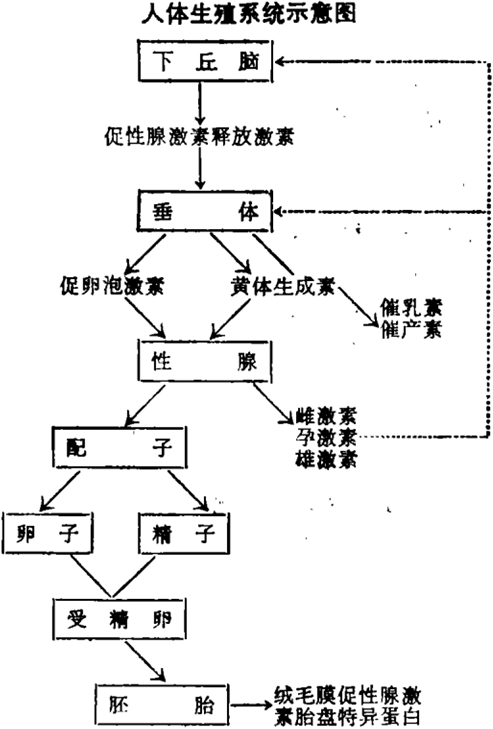
生殖活动主要由下丘脑 - 垂体 - 卵巢(或睾丸)这根性腺轴所调控。尽管人的卵巢能产生几十万个卵子,但一个妇女一生中只排300 ~ 400个卵,每个月周期只排出一个卵子。这是由多种性腺激素相互协调的结果。下丘脑释放促性腺激素释放激素RH-LH,RH-LH促使垂体释放黄体生长素LH和促泸胞激素FSH。卵巢在FSH和LH作用下泸泡生长并分泌甾体激素等。甾体激素对下丘脑和垂体又有反馈作用。况且,卵巢(睾丸)本身又具有一些非甾体调节因子参与调控作用。月经中期的LH峰克服抑制因子作用,从而使卵巢排放一个成熟卵子。毫无疑问,用免疫学方法干扰一种激素(或因子)即可能达到避孕目的。
大量动物实验表明,免疫干扰性腺轴生殖激素,可以获得肯定的抗生育效果。LH-RH耦合载体蛋白作免疫原,免疫后避孕效果十分高,但性腺萎缩,性功能下降或丧失。以LH作免疫原,抗体与其他激素发生交叉反应,抑制甾体激素生成,导致反馈作用消失。这样垂体补偿性产生更多促性腺激素,垂体负担过多,而且加重产生免疫复合物沉积症的危险。甾体激素靶器官较广,脑、肝、皮肤均为靶器官,故以甾体激素作避孕疫苗会影响许多器官正常的生理功能。
在寻找免疫抗原的研究中,一个有趣的事实是发现动物桑椹期胚胎,精子和大多数肿瘤中存在共同抗原。在肿瘤中发现的胚胎抗原有HCG,癌胚抗原、α - 甲胎蛋白,硫糖蛋白、胎铁蛋白、γ - 甲胎球蛋白、T球蛋白、乙胎蛋白等,这些共同抗原,以及胚胎细胞与肿瘤细胞表面的相似性,提示肿瘤细胞与胚胎细胞可能具有共同的免疫逃脱机理。这样就出现了一个令人鼓舞的新设想,分离纯化这些抗原,制成一种既能抗生育又能抗肿瘤的新型疫苗。
综上所述,免疫避孕有着较为广阔的前途。其中HCG、精子膜抗原和透明带抗原这三方面有可能突破。如果免疫避免疫苗问世,由于其本身所具有的优越性,估计会被人们广泛采用。这样,对疫苗的长期安全性就必须事先严格地加以考察。一要调查所用疫苗对靶器官以外的组织和功能是否有毒性或副作用,对抗原,载体、佐剂要分别进行急性、亚急性和慢性动物试验。二要专门研究免疫有效期和抗体消失后一个较长时期中的生殖情况及子孙的致畸影响,三要同时监视体液和细胞免疫情况,以及因反复免疫而导致的局部损伤,变态反应,自身免疫病和免疫复合物疾病出现的可能性。由于要作长期安全性和潜在危险等研究。一般估计,女性免疫避免疫苗可望1990年有所突破,男性免疫避孕疫苗也许要到2000年才能达到实用化程度。