人体循环系统可以构想成为两棵连接许多大小枝干的“树”。心脏的左心室把血液泵入主动脉,逐渐流经直径渐缩、数量渐多的分叉血管,最后到达毛细血管。在毛细血管内及其周围,发生着维持生命的质量转换过程。毛细血管引流用过的血液通过许多静脉传送给腔静脉干,流入心脏的右心室。这一循环回路包括肺,肺里的毛细血管是血液再充氧的地方。人体循环系统的血管内径大的约为3厘米,小的不到5微米。内径小于500微米的血管通常叫做微循环血管。血液循环压降几乎有80%是由微循环造成的。
血液循环是一个热 - 质转换系统,其工作流体是血液,即血浆的血球悬浮液(血球占体积的50%)。血浆是一种水合盐溶液,类似于海水,含有各种各样分子重量从44,000至1,000,000不等的高分子,这些高分子中最重要的是白蛋白、血纤维蛋白原和球蛋白。血球体积约92%由红细胞组成,其主要功能是向人体组织提供氧气,排泄由氧化过程产生的二氧化碳。血球中的其他元素是白细胞和血小板(凝血者)。在人体血液中,红细胞与白细胞之比为600:1,与血小板之比为20:1。因此,血液的流动特性受红细胞支配是不足为奇的。
血液特性
人体血液的红细胞形似一个盘子,盘面呈双凹形,盘径平均约为8.5微米,细胞中心壁厚为1微米,边缘附近约为2.5微米。应当着重强调,特性长度范围大大超过红细胞的流体不同于两者相差无几的流体。对于前一种情形,经验证明可以满意地处理为一种连续的均匀流体;对于后一种情形,必须考虑到血流实际上的不均匀性和多相性。这种区别实际上是定义微循环的依据。
—般的大规模粘度测定法测得血液明显地显示出非牛顿力学特性,且仅仅在相当低的剪切率下就能得以显现。实验表明,极其灵敏的测试技术也会释放一种微屈服应力,也就是说,需要一种有限的剪应力破碎静态血液中形成的红细胞凝块。剪切率约为100 s-1或超过此值时,全部血液可被视为一种牛顿流体,在正常体温下其表观粘度约为3.5厘泊。相对于血液中的悬浮微粒而言,这一粘度值是相当低的,原因是红细胞具有非同寻常的变形性。
血液“流升”到动脉树时,便到达一个使其特性成为非牛顿体的区域,甚至在剪切率较高的情况下也是如此。这个区域由许多直径为50 ~ 500微米不等的血管组成,或许,这些血管还可用来验证血液的某种连续统一体模型。流变学家用微玻璃管研究发现,血液的表观粘度取决于管径,而且实际上随管径渐缩而减小。这种现象叫做Fabraeus-Lindqvist效应,目前认为这是红细胞在血流断面非均匀分布的一种表象。尤其是,界面层为红细胞贫乏层时,则将导致某一特殊血管断面的红细胞平均浓度下降,低于任何留在或进入心脏的血液浓度。如果能够校正这种局部浓度失调,仍可以相当精确地使用经验连续统一体模型估算血液的局部表观粘度。问题在于,确定每根血管中红细胞的瞬时浓度是不可能的。我们可能寄予最好的希望是,适当精确的时间,近似乎均的浓度,譬如说,可能适用于研究所有尺寸在100 ~ 150微米范围内的小动脉,至少说适用于某一特殊器官。在一些小动物体内有限的微循环区域中,利用高尖端显微镜技术快速显现和记录微循环血流,研究人员正在获得这方面的信息。
在直径与红细胞直径比较接近的微血管中,必须抛弃血流的连续统一体模型。另一方面,血浆仍可以处理为一种连续流体,因为甚至最小的血管直径也比水分子“直径”大若干个数量级。因此,流经一根毛细管的血流可以描述为一种两相流:这种不可压缩流体,是携带较大的、可变形的、中性悬浮物体的牛顿流体,其形状在任意给定时刻都取决于血管直径和血流速度。就宏观血流而言,血浆速度场受到毛细血管(内皮)表面不滑动界面条件的制约,而且毛细血管在任何时刻都含有红细胞。
微循环血流
由于心脏的泵吸作用,流经每根微循环血管的血流通常是脉动的,而且,可能由于周围组织的局部代谢需要或其他外力的作用,血液流动通常是断续的。因此,在同样的尺寸范围的血管中,流体的速度、雷诺数、管壁剪应力等变量的差别相当大。对于内径小于500微米的血管(动脉、小动脉、毛细血管、静脉和小静脉),假设巅值流速为每秒九升,则可求得相应的平均血流速度在小动脉中为4厘米/秒,在毛细管中降至1毫米/秒。在毛细管中,这些速度转换为雷诺数约为10-3 ~ 5,管壁剪应力约为100达因/厘米%当然,这些数据相当粗糙,但却显示微循环中的血液肯定是层流,在大多数情况下,还可满意地假设为一种蠕变流动方式。
此外,剪应力的量值大大超过血浆中破碎红细胞凝块所需的能量(约为2达因/厘米2)。
红细胞的作用
盘形红细胞是在人体中发现的唯一无核细胞,其结构显得非常简单,由一种含有血红蛋白的水合溶液薄膜构成。除某些罕见的疾病外,例如镰刀形细胞贫血病,血红蛋白溶液的浓度虽然相当高,但实际上仍可视为一种牛顿液体。仅仅靠这种薄膜就能维持红细胞特有的双凹形。显然,如果能够维持薄膜的力学平衡,红细胞处于静态时,其断面不可能存在压力差。
红细胞膜的运载特性极为复杂,对发挥血的适当功能攸关重要。而且,细胞膜的力学特性控制着每个细胞的变形和变形率,因为毛细管中红细胞的流动轨迹具有复杂的拓扑结构。采用精巧的显微操作技术,流变学家已经能够把红细胞膜描绘成一种具有恒定厚度的,超弹性的粘性物质,这种物质只要在局部区域保持静态,即可承受较大的剪应变,但只要受到极小的区域性膨胀就会破裂。研究结果表明,对于许多情形而言,正常红细胞膜可以恰当地模拟为一种开耳芬固体(平行弹簧和减震器)。
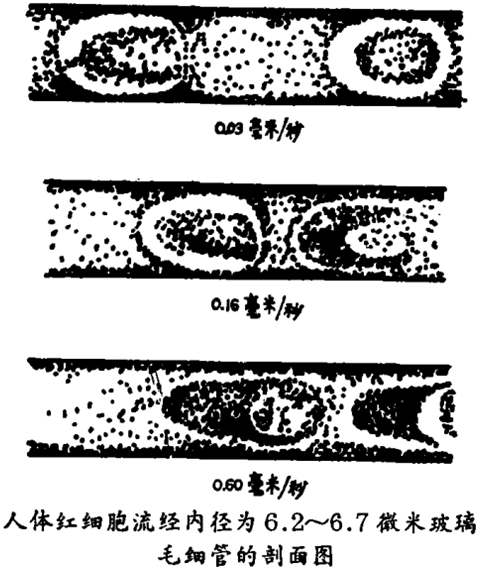
在静态下,由于许多毛细管的直径小于红细胞的直径,红细胞只有大幅度地改变其盘形,才能进入或通过毛细管。通常,这种屈服变形必须囊括某一主要直径。一旦红细胞进入毛细血管,由于法向应力和切向应力在细胞膜上的组合作用,则将进一步变形,变成像子弹弹头一样的囊胞。直流支配这些表面应力,因而也支配结果细胞的形状。当血流速度和红细胞流速增加时,红细胞被迫变形,变成比毛细血管断面纤细得多的形状(见图)。在这一过程中,红细胞与毛细血管管壁之间血浆的润滑膜变宽,管壁上的局部剪应力减小。就是说,红细胞流经毛细管造成血液压力降低的作用减弱。
在任意给定时刻,某一根毛细管中也许根本不含红细胞,或是充满一条未断裂的细胞链。通过毛细管导致总的压力降低,取决于流经毛细管的红细胞数量、流速,以及红细胞和毛细血管管壁之间血浆膜的平均厚度(亦取决于红细胞流速)。显然,红细胞的变形性是压降方程式中的一个关键因子。红细胞变形性愈小,血浆层愈薄,压降愈高。一个接近毛细血管入口的红细胞,是处于一种瞬变状态的。为了进入毛细管,红细胞不仅必须变形,而且必须迅速地调整其形状,使之不堵塞毛细血管入口,并能通过毛细血管。换言之,如果一个红细胞要进入和通过一根毛细血管,必须充分发挥其动态及静态变形性。
变形性紊乱
在同几种严重疾病有关的血管病理学中,红细胞的变形性起着明显的作用。例如,在镰形红细胞贫血病中,血液循环中的大多数红细胞丧失了变形性,且在充氧时显得非常畸形。有人认为,丧失变形性的红细胞将导致毛细血管堵塞,造成疼痛危象或器官梗塞。特别是,脾和其他器官过滤出刚性较大的红细胞时,则难免患贫血病,在疟疾传染病中也发现类似的情况,寄生物传染菌浸入红细胞,并在其中生长时,这些红细胞在血液循环中将逐渐丧失其变形性。其他许多遗传病也同红细胞的变形性、畸形红细胞的数量有关。近来的一些研究报告显示,红细胞的变形性与血浆构素物质有关,这些物质包括各种药剂、血管荷尔蒙,以及血小板释放出的产物。剪应力过大也可能影响变形性,因为红细胞可能通过一个假心脏阀或一个非肉体的旁路系统进入心脏。
在许多诸如此类的情况下,科学家们至今没弄清导致红细胞变形性削弱的力学特性,这也是当前有待研究的项目之一。这种研究必然要求医学家、工程科学家,以及现代流变实验学家的通力协作。有效的分析工作,必须创造性地运用连续统一体力学原理,以及深入了解红细胞各种运载现象的机理。
[Mechanical Engineering,1986年4月]