2009年诺贝尔医学奖得主伊丽莎白·布莱克本(Elizabeth Blackburn)在今年林道会议上发表的演讲中,介绍了她获得诺贝尔奖的端粒研究。众所周知,端粒是染色体两端的“保护帽”,能够起到某种抗癌作用,并与人体衰老现象有所联系,但其完整的生物学上的机理仍是一个谜。
TTAGGG、TTAGGG、TTAGGG,无数次的重复。似乎很难置信,这种让人大脑麻木的重复中竟然会隐藏着一些对人类来说意义重大的奥秘。这些在哺乳动物染色体末端起到保护作用的核苷酸序列,对于生物体确实有着十分重要的作用,它既是抵御肿瘤生长的坚强壁垒,又能在机体老化过程中起到缓冲器的作用――延缓退化。鉴于这些被称为端粒的染色体末端的重要性,诺贝尔委员会将2009年度诺贝尔医学奖授予了在产生和维护端粒结构的功能和机制研究方面做出巨大贡献的布莱克本、卡罗尔·格雷德(Carol Greider)和杰克·绍斯塔克(Jack Szostak)。

端粒研究的先驱者、诺贝尔奖得主伊丽莎白·布莱克本,正在与一位年轻的研究人员交谈
20世纪70年代末,布莱克本与她的导师约瑟夫·高尔(Joseph Gall)开始在单细胞有机体内研究端粒现象,“当时的研究只限于生物学领域内的一个小圈子内,即酵母和原生动物,”得克萨斯大学西南医学中心专门研究端粒的细胞生物学家杰里·谢伊(Jerry Shay)说,“如今,端粒研究已经成为一个重要的领域,并将出现许多令人振奋的新的研究成果。”
端粒的两面性
然而,端粒所起的作用决非想象中的那么简单。例如,端粒变短是一个喜忧参半的结果:它可延缓癌细胞分裂的速度,但同时也阻碍了自然组织的修复过程――无论是在人体或小鼠体内,较短的端粒意味着疾病的产生和机体的衰老。尽管端粒如此高深莫测,但科学家们仍在苦苦研究和探索,以期破解神秘的端粒之谜,最终造福人类健康。
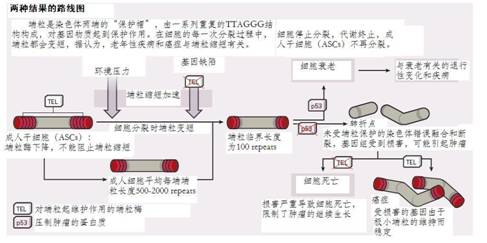
DNA的每一次复制过程,都会导致染色体变短,在端粒变得极短之时,就可能对一些重要的DNA序列造成破坏,并可能导致细胞修复机制出错,将受损的染色体末端误认为受损的DNA链,而将其两端融合起来。在20世纪30年代末,1983年诺贝尔奖得主芭芭拉·麦克琳托克(Barbara McClintock)的研究表明,未受保护的染色体末端会产生不断融合和破裂的循环,最终导致染色体结构的断裂和重排。
端粒是由端粒酶产生并进行维护的,端粒酶间歇性地在成人干细胞中被激活,这种机制有助于机体组织的维护和修复。由于大多数其他成年细胞不能产生可检测的端粒酶,其端粒随着每一次细胞分裂会变得更短。当端粒长度达到最短临界点时,就会触发机体危机管理机制,如监视DNA完整性的p53肿瘤抑制蛋白。其结果是,危机管理机制诱导细胞要么自毁,要么进入导致人体渐渐衰老的休眠状态。
由于染色体损伤有可能促使细胞生长失控,人们因此会认为严重受到侵蚀的端粒也可能会产生同样的风险,幸运的是,p53肿瘤抑制蛋白通过阻止细胞分裂可停止细胞生长失控。格雷德等人的研究表明,端粒缩短诱导的衰老可能是一种防止肿瘤形成的保护措施。“一般来说,缩短的端粒可以限制细胞分裂,停止肿瘤生长,这在小鼠实验中可以明显看到。”约翰·霍普金斯大学医学院的分子生物学家格雷德说道。
如果因基因突变影响到p53的功能(如各种癌症的发生),那就失去了一个重要的保护屏障,此时,端粒变短就是癌症产生的一个主要原因。从事癌症研究的生物学家罗纳德·德皮霍(Ronald DePinho)对失去p53活性的缩短端粒的小鼠进行了研究,结果发现它们的癌细胞确实在增多。更重要的是,有着正常长度端粒的癌症易感小鼠所患的癌症与人类中的老年人所患的癌症不太一样,它们通常所患的癌症为乳腺癌、结肠癌和皮肤肿瘤。但他同时发现,“端粒缩短小鼠所患癌症的类型却在向着与人类相似的方向发展,如上皮癌。”这一发现表明了端粒长度在人类癌症中所起的重要作用。
如果没有端粒酶的存在,肿瘤发展速度将会受到限制。“通常来说,细胞分裂失控是因端粒酶调控出现问题而产生的,”谢伊说道。事实上,谢伊和他在西南医学中心的长期合作者伍德林·赖特(Woodring Wright)发现,人类肿瘤的90%都存在有端粒酶活跃的现象。研究人员曾经认为,促使肿瘤细胞活跃的条件之一是休眠的端粒酶基因被重新激活。但最近的研究结果表明,肿瘤生长始于已产生端粒酶的干细胞,只要一小簇端粒酶就能满足肿瘤生长的条件,并不需要大量端粒酶的重新激活。“绝大多数的肿瘤细胞都只有很短的端粒,”赖特说,“它们一直保持这样的长度,而不是积极地去延长它。”
由于癌细胞往往比健康干细胞拥有更稳定更完整的端粒酶活性,这种酶可为各种癌症治疗方案提供最有效的药靶。加利福尼亚州Geron生物技术公司正在测试一种称做imetelstat端粒酶抑制剂的功效,目前已进入II期临床实验阶段,主要针对肺癌、乳腺癌和多发性骨髓瘤。据Geron公司首席医疗官斯蒂芬·凯尔西(Stephen Kelsey)说,这种抑制剂对尚不成熟且正在快速分裂的肿瘤细胞最为有效。他认为,类似imetelstat这样的药物在癌症手术切除或化疗之后能产生较为良好的效果,可强势抑制手术和化疗后幸存下来的肿瘤细胞卷土重来的可能性。
抑制端粒酶的药物有望通过迫使细胞进入衰老状态阻止肿瘤的生长,不过这一理论目前尚未在人类身上获得证明。Geron公司希望,到2012年年底获得初步治疗效果的相关数据。临床有效剂量的初步安全性研究尚未发现该药物对健康细胞端粒酶表达有持久的不利影响。“一般情况下,肿瘤细胞的端粒较短,这将提供一个治疗窗口,可有选择性地杀死癌细胞,”Geron公司前首席科学官、如今是Telome Health公司执行总裁的卡尔文·哈利(Calvin Harley)说道。
端粒与疾病
除了在癌症研究方面取得的成果,该领域还将一些研究重点放在端粒缩短与老年性疾病之间的联系上。“这并不是说,癌症研究的重要性降为其次,而是与人类年龄老化相关的疾病的研究在过去几年里已转移到了生物科研的最前沿,”约翰·霍普金斯大学肿瘤学家玛丽·阿玛尼奥斯(Mary Armanios)说道。
例如,先天性角化不全症(DC)是一种罕见的疾病,参与端粒维持的基因产生突变是发病的首要条件,DC患者因骨髓衰竭而失去产生新的血细胞的能力。最近的研究还发现,特发性肺纤维化(IPF)风险也与端粒酶基因突变有关,IPF是一种更为普遍的疾病,以肺部大面积结疤为特征的一种致命疾病。
DC和IPF这两种疾病表示身体修复衰老或修复受损组织的机能出现了故障。斯坦福大学的血液学家史蒂文·阿坦迪(Steven Artandi)解释道:“我们知道,端粒酶是维护端粒的,以维持其在干细胞内的自我更新。当这种机制出现差错时,疾病就会产生。许多情况下,这些患者出生时都是健康的,当他们进入童年后期或成年早期时,由于基因突变,机体组织就有可能出现问题。”
继承了端粒酶突变基因的人也可能会继承端粒过早缩短的基因,或导致IPF更早发病。阿玛尼奥斯团队的研究表明,从病理学上看,这种端粒缩短现象会一代比一代严重。她说:“上一代人患有IPF症,其后代的情况会一代比一代差,最终导致发展为再生障碍性贫血骨髓衰竭症。”
端粒缩短至少是许多疾病产生的部分原因,试图找出端粒缩短生理效应特征的早期尝试并没有成功,研究人员发现缺乏端粒酶的小鼠似乎没有出现什么不良的影响。然而,在仔细观察后发现,实验室培养小鼠的端粒在出生时比人类要长好几倍,似乎年龄增长与端粒缩短对于这些小鼠的影响很有限。之后科学家通过对患有端粒酶缺陷的小鼠进行序列育种,培养出了类似人类端粒长度的新品种小鼠,从而克服了这一局限。
研究人员目前可以利用这些短端粒小鼠,对许多疾病进行以前难以进行的活体实验。例如,标准的实验室小鼠一般不会患肝硬化,而端粒较短的小鼠则有可能会患上肝硬化。德皮霍指出,这一研究结果表明,端粒缩短是“发病机理不可分割的一部分”。同样,阿坦迪和其同事海伦·布劳(Helen Blau)也认为,培养杜氏肌营养不良症的小鼠模型需要端粒较短的小鼠。阿坦迪说:“短的端粒会损害干细胞的功能,可充分揭示杜氏肌营养不良症对小鼠生理的影响,看来这种疾病对小鼠的影响与对人类的影响十分相似。”
端粒与寿命
当我们渐渐变老之时,端粒的缩短将加速老化进程,这一直是该领域研究的重点。至少,对小鼠的研究表明,端粒对寿命和生存质量有着很大的影响。“小鼠模型清楚地表明,端粒短于正常状态是衰老原因之一,”西班牙国家癌症研究中心(NCIO)细胞生物学家玛丽亚·布拉斯科(Maria Blasco)说道。
布拉斯科和同事在基因改造动物实验中表明,增加端粒酶的同时增加p53基因表达的小鼠“寿命延长了40%。”最近,德皮霍研究小组对端粒酶重新激活对端粒已达临界长度小鼠的影响进行了评估。“这些小鼠的状态并不太好,相当于80岁或90岁的人,”他说,“然后,通过端粒酶激活,逆转了端粒‘开关’之后,这些小鼠的认知能力和繁殖能力等都得到了改善和提高。这一事实告诉我们,机体组织的退化并非不能逆转,即使在严重退化的情况下。”
端粒随着岁月流逝不断缩短的事实表明,端粒长度在某种意义上记录了生物体的生理年龄,就像树木的年轮一样。然而,从事端粒研究工作的科学家告诫道,这种解释有些过于简单化。“有明确的证据表明,端粒不是衰老的唯一决定性因素,”2009年度诺贝尔医学奖获得者格雷德说,“导致衰老可能有五种、六种,甚至七种不同的途径,端粒在衰老过程中只是起到了其中的一部分作用。”
较短的端粒和各种疾病之间可能存在的关系引起了许多研究人员的兴趣,并纷纷建立起以测量血细胞端粒长度进行疾病预测和诊断的科技公司。例如,肿瘤学家彼得·兰多普(Peter Lansdorp)于2005年在温哥华创立了Repeat Diagnostics生物技术公司,专门从事端粒长度测定业务,以帮助医生对因基因突变影响端粒功能的患者进行确诊。另外还有两个公司直接向消费者和医疗单位提供服务,即布莱克本和哈利于2011年3月联手推出的Telome Health公司和布拉斯科于2010年12月在马德里建立的Life Length公司。Life Length公司称,他们能够对“生物年龄”进行测量,并建议每年测量一次端粒长度。
人们对这些新成立公司的关注一直是一个引发争论的话题。布拉斯科说:“人们想知道自己的端粒长度,因为越来越多的论文都表明,端粒越短其疾病风险越高。”哈利指出,端粒长度与一些具体疾病之间存在的联系即使不那么明确,人们仍然有可能以这些测量结果为依据来决定自己的生活。“端粒长度测量让人们可以监控自己的健康状况,更密切地配合医生的工作,并对自己有可能患哪种疾病的风险获得更多的具体信息,”哈利说,“如果我知道自己的端粒较短,那么我想会更听从医生的话。”
部分科学家担心的是,由于人类对端粒的了解还太少,他们对端粒测量的意义表示怀疑。格雷德说:“端粒测量肯定是一项有益的举措,但我只是觉得为时过早,时机尚未成熟。”
种种之疑虑
弄清楚端粒长度与疾病之间的关系,需要进行更多的研究和实验。“遗憾的是,有很多数据我认为非常值得怀疑,”兰多普说,“已完成的研究主要是流行病学方面的。因此,很多观察资料可能只是相关的或间接的。”
测量方法也是争论的焦点之一。Telome Health公司与迄今进行的大多数流行病学研究一样,采用了可快速确定细胞内平均端粒长度的DNA信号放大技术,但这种技术产生的结果可能带有人为因素的影响。布拉斯科、兰多普和其他人用的则是更耗时且昂贵的技术,例如,使用荧光探针研究单个细胞内的端粒,但个别细胞未必能代表总体情况。阿玛尼奥斯说:“每个细胞内有92个端粒,每个端粒都有自己不同的长度,但决定基因表型的却是最短的端粒。”端粒测量通常从白血细胞开始,一是其数据容易获取,二是其最接近于干细胞库的端粒长度。然而,人们仍然不清楚,这些测量结果是否能代表整个机体的端粒长度。
端粒长度还可能受到诸种环境因素的影响,使得对端粒长度测量结果的诠释变得更为复杂。布莱克本和伊萨·埃帕尔(Elissa Epel)在旧金山加利福尼亚大学的研究发现,端粒加速变短是生活方式和精神压力的直接反应,如创伤后应激障碍或严重抑郁症等。“一开始对此我是持怀疑态度的,现在我开始有点相信了,”谢伊说,“端粒究竟意味着什么,我将继续关注这方面的进展。但我相信,最短的端粒很可能与环境压力有关。”
同时兼任Life Length公司科学顾问的谢伊希望,在生活方式和其他因素对端粒的影响方面,直接面向消费者的公司收集到的数据将能更好地反映整体人群的情况。德皮霍认为,研究端粒对癌症产生和机体衰老的作用,是在与时间赛跑。“到2025年,地球上60岁以上的人将达12亿,”他说,“我们需要了解衰老过程,我们需要了解如何控制衰老,以提高老年人的健康水平,减少与年龄相关的疾病并让老年人继续保持活力。”
资料来源 Nature
责任编辑 则 鸣