近几十年来,科学家们一直在用单一的微生物给无菌动物移植,以评价它们对健康的贡献。通过把现代免疫学技术、工具与这些模型结合起来,我们正在开始揭开和细菌共栖对人类健康的影响
无论何时,我们身体暴露于环境中的表面,几乎全部被数以万亿的共生的细菌覆盖。但是,它们在干什么?它们为什么要这么做?如果你想了解共生的微生物对哺乳动物的影响,那么与不带细菌的老鼠呆在一起是很好的起点。
对益菌产生兴趣
我2002年开始从事对这个问题的研究,那时熟悉无菌老鼠模型的人仍如此之少,以至于我不得不说服了一位退休的技术员帮助我建立灭菌室,并教我“卫生工程”的方法。跟他那个时代(50年前)使用的老式的钢和玻璃的装置不同,我们用塑料泡沫能做出漂亮的、现代化的可容纳4个老鼠笼子的无菌室。在最初发生了几次无菌室污染后,我开始明白为什么研究人员很少使用无菌动物了。
差不多一个世纪以前,科学家构想出无菌动物,但直到1945年才成功饲养出无菌动物。美国圣母大学的詹姆斯·A·瑞尼尔斯(James A. Reyniers)领导的团队第一个成功饲养并研究了无菌动物。当时研究人员得出结论,除净哺乳动物身上的微生物可能是件好事。他们饲养的成年老鼠都长出巨大的腹部(这源于消化问题),但除此以外,它们似乎和典型的老鼠一样健康,活得一样长。
那时候,科学和细菌之间是敌对关系――微生物学家的主要目的是研究传染病――似乎没有人想知道表面上看似被动的共生细菌在做什么。事实的确如此,先后有20位科学家因研究对有害微生物的免疫反应而获得诺贝尔奖,从肺结核到胃溃疡的病原体幽门螺杆菌。但从大局来看,细菌感染是罕见的和小概率的。在已知的30多万种细菌(可能总共有几百万种之多)中,只有大约170种对哺乳动物是致病的。
当我2000年接受微生物技术训练时,研究的焦点仍是在病原菌上。但是,我逐渐被益菌的潜在好处激起了兴趣。毕竟,我们人类已经和共生细菌一起共同进化了几百万年。戴维·斯特罗恩(David Strachan)于1989年提出了“卫生假说”(hygiene hypothesis),他把身体对环境微生物暴露较少(这在发达国家很常见)与较高的过敏症发生率联系起来。这个观点对我很有启示:共生细菌帮助我们牵制病原菌。
1990年代末,新的研究正开始揭示共生体也有助于肠道结构的发育。如果细菌对发育是如此重要,那么它们还可能做什么别的吗?它们能让我们更健康吗?尽管充满了挑战,但是我确信,了解细菌的系统效应的最好方法就是从完全不带细菌的老鼠开始。
机会主义病原体
2002年我从加州大学洛杉矶分校获得博士学位后,就进了哈佛医学院丹尼斯·卡斯珀(Dennis Kasper)的实验室。他正致力于研究一种流行的共生细菌――脆弱拟杆菌(Bacteroides fragilis,人类肠胃中的一种机会主义的病原体。该细菌通常被划分为一种严格的厌氧菌,只有当氧的水平极低时才能生长――译者注)。
卡斯珀的实验室已对覆盖在脆弱拟杆菌上的荚膜多糖研究了数年(类似于猕猴桃上的毛绒),其表面多糖是重复糖分子链,能在细菌的表面上形成一道粘液状的屏障。卡斯珀已经发现,所研究的8个多糖中,2个多糖有一种独特的两性离子结构:这些多糖分子在其每个重复单元上既有正电荷又有负电荷。很多种细菌表面都覆盖了多糖,而只有少量的细菌具有两性离子多糖。
初进卡斯珀的实验室时,我想学习更多的关于这些多糖及其性质的知识。我把脆弱拟杆菌中涉及到多糖产生的基因进行突变处理,以表达这8个表面多糖的不同组合产物。通过删除基因的启动子区,我删掉了8个多糖中的7个。但是,尽管做了几百次实验,我仍无法制得不带这8个多糖的活细菌。这很清楚地表明,这些细菌需要这种糖衣来维持正常的功能。但是我很想知道这些多糖是否也很重要,因为它们提供了一些哺乳动物宿主缺乏的东西。
卡斯珀的实验室已经证明,在试管中,多糖A(PSA)――这8个多糖中最普遍的多糖――能刺激免疫系统的T细胞。他们还检测了脆弱拟杆菌的另一种两性离子多糖――多糖B(PSB),但发现它的刺激效应跟PSA比相形见绌。PSA是否影响了动物的整个免疫系统?这是一个只能在无菌老鼠受控情况下提出的问题。
重启无菌老鼠模型
无菌动物研究工作的全盛期是1940年代——50年代。近年来,一些研究人员重新启用了那时的无菌老鼠模型,发现了除老鼠巨大的腹部和消化困难以外更多的问题。随着新的细胞和分子工具的使用,研究人员证明这些动物的免疫系统存在严重问题:抗体缺乏,对感染有较高的易感性,淋巴集结和次级淋巴小结(淋巴细胞发挥活性的场所)的数量减少,肠内巨噬细胞活性较低,肠内上皮淋巴细胞的数量和细胞毒性减少。
1992年,荷兰国家应用科学研究院衰老和血管研究所的莱克斯·纳杰尔克肯(Lex Nagelkerken)发现,与照常规培养的老鼠相比,无菌老鼠的CD4 T细胞的数量减少了。CD4 T细胞对调节免疫反应起到关键作用,能激活细胞反应和抗体反应。于是,我们决定用CD4 T细胞水平作为无菌老鼠健康免疫系统的标记。
我们给一组无菌老鼠移植了完整的脆弱拟杆菌,给另一组老鼠移植了另一株脆弱拟杆菌,这株细菌缺少多糖A(PSA)但另7种多糖都有。使我高兴的是,完整的脆弱拟杆菌(即野生型)使那些老鼠的CD4 T细胞水平恢复了,而在移植了缺少多糖A的变异细菌的老鼠中,CD4 T细胞水平几乎与无菌老鼠中的CD4 T细胞水平一样差。
这是一个重要的结果。不仅是单一的菌株能够使CD4 T细胞恢复到健康水平,而且我们还确定了介导这些效应的特定表面分子。我又检查了多糖A(PSA)对免疫系统其他“武器”的影响。它们是能直接杀死别的细胞的CD8 T细胞,以及产生抗体的B细胞。结果显示,这些细胞似乎并没有受到影响。看上去,带有完整多糖A的细菌特定地诱导了CD4 T细胞。
当浏览脾脏的组织学(脾脏和淋巴结一起,是免疫反应发生的场所)时,我们发现移植了不带多糖A的脆弱拟杆菌的无菌老鼠,缺少界线明确的滤泡结构(follicular structure),而这种结构是健康免疫细胞发育的一个明确标志。移植了野生型脆弱拟杆菌的老鼠含有大量的滤泡。细菌在除了肠道外的器官发育中可能扮演一个角色,这是第一个证据。
“助手”CD4 T细胞
为了核查多糖A(PSA)分子的特定作用,我从脆弱拟杆菌表面提取、纯化了多糖A。当我喂给无菌老鼠这种多糖时,它们的CD4 T细胞发展成常规水平,而且是在没有一点细菌的情况下!
下一个问题是,多糖A(PSA)是同等地刺激所有的CD4 T细胞,还是CD4 T细胞中的一个分支被优先激活?原来,“助手”CD4 T细胞依据它们分泌的细胞因子被分成2类:T-助手1(Th1)细胞,能激活免疫系统的细胞武器;T-助手2(Th2)细胞,能激活体液或抗体,制造B细胞。Th1和Th2细胞之间的平衡对免疫系统行使正当的功能是很重要的。当我们研究无菌老鼠的Th属性时,发现它们的Th细胞因子有一个异常的平衡。
跟常规老鼠相比,无菌老鼠制造了大量的白细胞介素-4(interleukin-4,即IL-4,这是一种Th2细胞因子)和极少的γ-干扰素(IFNγ,这是一种Th1细胞因子)。但是,移植了野生型脆弱拟杆菌的无菌老鼠把γ-干扰素的水平恢复到了正常,并且降低了Th2细胞因子的量。纯化的多糖A(PSA)能把无菌老鼠的Th1/Th2平衡恢复到正常水平。因此,似乎是健康免疫系统的固有特征的东西,事实上竟然完全被一种单一的细菌分子所控制。
我们的成果发表不久,一项扩展“卫生假说”(hygiene hypothesis)的流行病学研究吸引了我的注意。这项新研究表明,非过敏性自身免疫疾病,例如多发性硬化、1型糖尿病、克隆氏症在欧美国家的发病率也呈上升态势。这使我想到,脆弱拟杆菌可能在大范围的免疫性疾病方面也有作用;或许,它正在为促进肠道健康而“塑造”一个协调的、复杂的免疫图谱。
一般来说,免疫系统应该识别外源病原体(例如细菌)并消灭它们,同时避开健康的人体细胞。但是,有时免疫系统不能分辨“自体”和“非自体”之间的不同,结果导致自身免疫性疾病。这类疾病的一个特征就是,Th1/Th2的比例失调,导致免疫系统攻击宿主的组织。因此,如果脆弱拟杆菌能够纠正Th1/Th2的失调,或许它也能改善自身免疫疾病。
发现新CD4 T细胞
我选择炎性肠病(IBD)作为研究对象,这是一种包括人类溃疡性结肠炎和克隆氏症在内的自身免疫疾病。患者表现的症状有腹痛、腹泻,以及由免疫细胞攻击小肠或大肠而导致的直肠出血。在美国,大约200万人正遭受着这些疾病的困扰,并且这个数字还在快速增加。
几十年来,研究人员一直在寻找导致IBD的病原菌株,但一无所获。不过,最近几项研究指出,共生(而不是病原)细菌在引发炎性肠病上起到了作用。由于脆弱拟杆菌的好处已在我脑海里留下了深刻印象,所以我很想弄清楚:如果引发炎性肠病不是因为存在某些共生细菌,而是因为缺少保护性的共生细菌,那情况将会怎样?
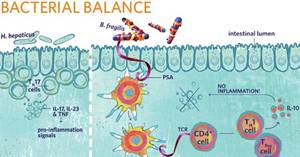
为了检验这个假设,我给野生型老鼠移植了脆弱拟杆菌,然后通过引入肝螺杆菌(Helicobacter hepaticus,这是已知的一种可在实验模型中引起炎性肠病的细菌),诱导老鼠患炎性肠病。结果显示,脆弱拟杆菌可保护老鼠不患上炎性肠病,但是,用缺少多糖A(PSA)的脆弱拟杆菌移植的老鼠没有受到保护。脆弱拟杆菌似乎使自身反应性免疫细胞停止了活动,并防止了对肠道的伤害。
2006年,我在加州理工学院晋升为助理教授。那时,研究人员已经发现了一种新的CD4 T细胞,它能充当自身免疫疾病的一个“关键性调解人”。这种新细胞(Th17细胞)不久就在免疫学界风靡一时。Th17细胞可以制造IL-17――一种与每种已知的自身免疫疾病都有关的强效炎性T-细胞因子。当时已很清楚了,免疫反应实际上能被理解为Th1(细胞),Th2(体液),或Th17(自身免疫)途径。几项研究发现,Th17反应涉及到引起老鼠模型的炎性肠病。多糖A(PSA)是否在诱导Th1细胞因子,使平衡远离太多的Th17(和Th2)?
如果真是这样,那将支持我早期的研究结果,即多糖A(PSA)启动了Th1细胞因子的产生,Th1可以减少无菌老鼠中较高的Th2响应。但是,这个机理是什么呢?多糖A(PSA)也抑制“促炎的”(proinflammatory)Th17细胞吗?
真正全新的影响
我已经证明,多糖A(PSA)能引起CD4 T细胞的增殖,就像我早期研究的无菌老鼠中的情况一样,而且还证明,另一种被称为“调节性T-细胞”(T regulatory cell)的细胞也被激活,它通过制造细胞因子IL-10阻止了发炎。这种细胞因子足以抑制“促炎的”IL-17,并保护肠道免受免疫攻击(见图)。我开始充分意识到,脆弱拟杆菌不仅在诱导离散的免疫反应(如Th1细胞),而且在为促进肠道健康而“塑造”一个协调的、复杂的免疫图谱。
有几个实验室近来已能够对健康人和炎性肠病患者的微生物群进行测序。结果显示,跟健康人相比,炎性肠病患者的拟杆菌(Bacteroidetes)数量显著减少。现在,临床一般对炎性肠病患者给予消炎药物,但是这抑制了整个免疫系统,使病人有患其他疾病和感染的较高风险。理论上讲,作为一种“益生菌疗法”(probiotic therapy)的脆弱拟杆菌,或甚至是单独的多糖A(PSA),都将对人有更加特定性的消炎反应。
脆弱拟杆菌肯定不是人类肠道中唯一重要的共生细菌――它仅仅是第一个和一个免疫调节分子一起被发现的共生菌。人类微生物组计划(Human Microbiome Project),是一项由美国国立卫生研究院(NIH)资助、要对数百人的微生物群进行测序的计划。目前,这项计划已着手测定存在于人类肠道中的相对大量的全部细菌。随着存在于健康个体中的细菌“家底”的摸清,那将更容易理解哪些细菌可能在患者中丢失了。有希望的是,人类微生物组计划将引导发现其他的有益细菌。
近几十年来,科学家们一直在用单一的微生物给无菌动物移植,以评价它们对健康的贡献。通过把现代免疫学技术、工具与这些模型结合起来,我们正在开始揭开和细菌共栖对人类健康的影响――真正全新的影响!
资料来源 The Scientist
责任编辑 则 鸣
――――――――
本文作者萨基斯·马兹曼尼亚(Sarkis Mazmanian)是加州理工学院生物系的助理教授;萨拉·麦克布赖德(Sara McBride)在马兹曼尼亚的实验室里从事研究。题图为脆弱拟杆菌。

