随着科学家对RNA化学修饰研究的深入,表观转录组学的研究工具进一步增加。
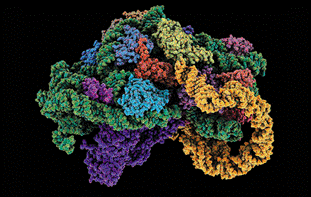
在蛋白质合成过程中,细菌核糖体与信使RNA结合,图为该复合体的分子模型
2004年,以色列特拉维夫大学的肿瘤学家吉迪恩·雷肖比(Gideon Rechavi)和同事们比较了所有人类基因组DNA序列和对应的信使RNA序列,信使RNA(mRNA)携带着基因制造蛋白质的所需信息。他们正在寻找一种改变,组成RNA序列的一种核苷酸组件――腺嘌呤核苷(简称A)被换成了另一种标准组件――次黄嘌呤核苷(简称I)。这种“A到I的变化”会改变蛋白质的编码序列,在人类发展史中,对于维持先天免疫应答至关重要。“我们的工作听起来很简单,实际上非常复杂,”雷肖比回忆到,“已经有不少研究小组尝试过,但都失败了。”究其原因,主要是测序错误和单核苷酸突变使数据受到干扰。但是,利用新的生物信息学方法,雷肖比的团队在转录组(生物体或细胞群体中所有的mRNA)中发现了上千个变化了的修饰位点,随后又增加到了数百万个。
次黄嘌呤核苷多少有点特殊:通过比较DNA和RNA序列,研究人员能够轻易地发现这种缺陷。不过,至少有1/4的mRNA带着化学标记,也就是组成RNA的A、C、G、U四种核苷酸被修饰过,但是目前的测序技术是无法发现的。(类似的标记在DNA上也有,称为表观遗传学标记。)现在,科学家尚不清楚RNA上的化学修饰有何用途,还需要努力研究。
在过去5年中,科学界掀起了研究N6-甲基腺苷(m6A)的浪潮:在转录组中确定m6A的位点图谱,并证明这一修饰对健康和疾病至关重要。不过,研究工作量巨大:在mRNA和其他RNA的转录产物上都有这一标记,而且几乎所有物种内都有,甚至病毒也不例外。
核苷酸上的化学修饰本身并不是惹人注目的新发现。让它走上前台并让表观转录组学成为焦点的是一类酶的发现,这些酶各自负责化学修饰的添加、去除或者是与化学修饰结合,发挥特殊作用。2010年,芝加哥大学的化学生物学家何川提出,化学标记是可逆的,对基因表达起着重要调节作用。不多久,他的研究团队就找到了第一个“橡皮擦”,这种名为FTO的酶能够去除mRNA上的甲基标记。也就是说,细胞能够主动地控制m6A。这个发现利用了新一代测序技术,能绘制出m6A和转录组中其他化学修饰的位点图谱。
如今,表观转录组学正在蓬勃发展,不过相关的工具却还不完善。当前的方法缺乏灵敏度,不能用于检测珍稀样品。科学家既不能确定转录组中特定化学修饰的数量,也不能在单次实验中绘制一种以上的化学修饰位点图谱。芝加哥大学的分子生物学家潘涛与何川合作研究FTO,他表示:“目前我们亟需新技术来检测各种RNA化学修饰。”
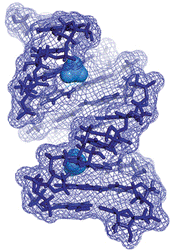
甲基化RNA二聚体
这就是说,表观转录组学的研究人员正在为他们的领域有了方向而欢欣鼓舞。美国威尔康奈尔医学院的遗传学家克里斯·梅森(Chris Mason)领导了绘制m6A位点图谱的工作,他说:“正如你想到DNA就会想到DNA的组装和表观遗传学修饰一样,我认为,在现在和未来,在提到RNA时,没有人会不想到‘如何修饰’这个问题。”
利用抗体绘制修饰位点图谱
早在20世纪70年代,科学家就利用m6A上的放射性同位素标记第一次证明了mRNA存在化学修饰。但是,这个研究原理是,mRNA转录物的3′末端含有一串腺嘌呤核苷,以此选择性富集mRNA转录物,研究人员担心,这些标本可能含有痕量的其他类别的RNA分子。威尔康奈尔医学院的化学生物学家萨米·贾弗里(Samie Jaffrey)说:“人们停止了这方面的研究,因为太难判断,mRNA中的m6A到底是不是污染物。”
同样困难的是弄清转录组中m6A位于何处,这有助于理解m6A的功能。常规的测序方法需要逆转录――把RNA转换成互补DNA(cDNA)――然后扩增、测序。问题在于制备cDNA的逆转录酶经常会把化学修饰除去。贾弗里指出:“那样就不可能看见m6A了,逆转录以后,它就像个普通的A一样了。”
虽然存在技术难题,但是科学家意外地发现了一种细菌RNA的化学修饰,这引起了贾弗里的兴趣,他准备在哺乳动物的RNA中寻找这种修饰。他与梅森合作,研究小组把RNA切割成小段,用抗体分离出包含有m6A的部分,然后进行测序。“我们清楚地看见mRNA的标签,非常显眼。那绝不是污染。”贾弗里说。雷肖比的团队也进行了类似研究,发现了大量的m6A,在7000个人类基因上有12 000个位点。该团队还发现,这种修饰常常集中出现在外显子和终止密码子中,前者是蛋白质编码区,后者是mRNA中代表蛋白质编码序列结束的3个密码子。
上述研究人员采用的方法是m6A-seq和MeRIP-seq,已经广泛应用于绘制不同疾病背景和生物体中的m6A位点图谱。针对m6A的抗体和试剂都可以在网上获取。研究人员认为,这种化学修饰控制着细胞发育成不同类型的过程,这个过程一旦异常就会导致癌症。实际上,表观转录组与癌症的第一个联系已经被发现。何川的团队证实,在某些急性髓细胞白血病病例中,存在远高于正常水平的FTO酶,将刺激细胞分化的转录产物上的m6A除去。
与此同时,另一个研究小组对何川团队的成果进行了不同的解释。使用分辨度更高的新一代抗体做图法(miCLIP),贾弗里的团队证实m6A的抗体也能与N6,2′-O-二甲基腺苷(m6Am)结合,这是对mRNA 5′末端化学结构的修饰。当时,贾弗里并不知道m6Am究竟有什么生物学意义。但是,他的团队发现m6Am(不是m6A)是FTO清除作用的主要目标,它会影响mRNA的稳定性和亚细胞定位。对于贾弗里来说,何川团队之前的研究成果将FTO与急性髓细胞白血病关联起来,正说明m6Am(不是m6A)与癌症的起源和发展有不可忽视的关系。

癌症生物学家霍华德·张
斯坦福大学的癌症生物学家霍华德·张(Howard Chang)指出,这种差异在新兴领域是常有的事。“这一特殊问题与早期研究组蛋白化学修饰时遇到的问题并没有什么不同。”他举例说明,DNA被紧紧包裹在细胞中,而经过化学修饰的组蛋白在DNA周围。
更多化学修饰
RNA上的其他化学修饰同样吸引着科学家们的注意。2016年,北京大学的化学家伊成器的研究团队和雷肖比、何川的团队都利用抗体在小鼠和人类细胞系中找到了N1-甲基腺苷(m1A)。两个研究小组用不同的方法保护m1A不被逆转录干扰,他们的研究都证实,早在20世纪60年代就在总RNA中发现的m1A位于mRNA开始生产蛋白质的位点上。压力条件改变可化学修饰的位点,说明它们是动态的。
关于m1A的作用,目前科学家们还不得而知,不过他们有一个令人向往的线索:大多数转录产物只有一个m1A位点,这样的产物翻译成蛋白质的概率比那些缺乏修饰的更频繁。“这是令人兴奋的现象,当然也是复杂的,我们正在研究一种新的mRNA翻译调节机制。”雷肖比说。
其他整体位点图谱方法依赖于这样的事实,有些RNA化学修饰充当了附加化学标记的手柄。2011年末,伊成器组建了实验室,当时假尿苷(pseudouridines或pseudoU)在许多种类的RNA中都发现了,唯独mRNA中没有。2015年,他的团队描述了一种化学标签和拉下(pulldown)方法用于富集转录产物上的修饰。出乎他的意料,pseudoUs在小鼠和人类的mRNA中含量比预想的要丰富得多。于是他的工作重点就转移到研究这个标记的功能。“我认为,pseudoU在mRNA中有多重作用,这取决于何时、何地、如何安装和调控RNA的转录。”伊成器说。他补充说,我目前已经知道,这些pseudoU是化学标记的“写入者”,是否也是“阅读者”和“清除者”呢?仍然悬而未决。
图谱技术的进展
无论是用抗体还是化学方法,绘制RNA化学修饰位点图谱都是一项棘手的任务。梅森指出,抗体会与其他化学修饰交叉反应,所有研究人员要用至少两种不同抗体对结果做互相关(cross-correlate)分析。与其他方法相比,化学方法能切断、结合或者富集某些区域,对其他区域的检测效果却不尽人意。伊成器说,测序深度和生物信息学算法选择也会影响修饰位点的检测。甚至,细胞在培养中保持活性的时间长短都会影响修饰水平,梅森说,所以,找到图谱基线对于对照至关重要。
但是无论如何,仅仅显示样品中含有特定的化学修饰还不够。相反,对所有的RNA化学修饰进行定量是至关紧要的,因为细胞可能就是依赖某个化学修饰的正确数量来发挥正常功能,潘涛说道。有些研究者想通过增强写入和擦除酶来调整修饰水平,因此定量对他们来说尤其重要。仅仅存在这样的酶就可以表明,精确调整修饰水平是重要的。
2015年,潘涛的团队描述了一种量化化学修饰的有效方法,至少在一种名为“转移RNAs”的RNA上是有效的。具体方法是:用逆转录酶读取各种化学修饰,从而获取第一个化学修饰下游的序列。目前,潘涛表示,他的小组正在把同样的技术运用到如m1A等mRNA化学修饰上。
不过,也许确定功能最快的方法是识别这些标签的“阅读者”、“写入者”和“清除者”。2012年,雷肖比团队进行了m6A-位点图谱研究,创造了大量带有或不带有m6A化学修饰的RNA短片段,以它们为诱饵钓出了与RNA结合的蛋白质。2014年,他的团队采用类似的策略发现了一些m6A的“阅读者”。其他研究也推断出与此不同的细胞功能。现在,雷肖比打算用同样的诱饵法把m1A的“阅读者”也钓出来,虽然这可能会更困难,因为m1A集中的位点(就是蛋白质的翻译起始点)结构比m6A的序列更复杂。
一旦确定某个酶是某个化学修饰的“阅读者”,基因编辑技术就可以轻易调节蛋白的表达,让研究人员从细胞的总体改变中探明化学修饰作用。例如,霍华德的一项研究除掉了m6A的一个“阅读者”酶,以此证明了这种化学修饰在决定细胞命运时的重要性。
但是如同所有的后天获得的性状一样,解释这些发现非常复杂,比如同样的酶可能与大量不同的RNA作用,一种化学修饰也可能在不同的RNA中有不同的作用,霍华德指出:“如果通过研究其他物种的RNA而取得突破,而不是人的RNA,我一点也不会惊讶。化学修饰在细胞中大量存在且十分重要。”
更多研究工具
近年来,何川的团队发现,RNA化学修饰提供了一种调控转录产物的方法,在不少细胞功能中发挥作用,比如开启细胞分化的过程。研究人员需要更好的技术来探究它们之间的联系,于是,2016年10月,美国国立卫生研究院(NIH)决定,给予何川和潘涛5年时间、投入1 060万美元,建立一个技术开发中心,为识别和绘制RNA化学修饰位点图谱服务。何川表示,最大的关注点是想出能在修饰位点上产生突变并能扩增的方法。
借助新的成像技术,今后科学家可能对特定转录产物上的某个化学修饰做图像分析。“我多么渴望有人能发明一种技术,让我看到mRNA上的m6A修饰。”何川说,不过,现在还是不可能的。傅燕是他以前的研究生,目前正在哈佛大学生物物理学家庄小威的实验室中工作。傅燕把超分辨率显微镜与庄小威开创的单细胞RNA MERFISH成像结合。傅燕说,自己在过去两年中取得了进展,但是数据有干扰,需要进一步优化条件,以便更有效地检测出化学修饰。
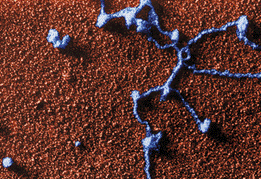
电子显微照片,RNA聚合酶分子与DNA链的特异连接物
另一些研究人员正在设法避开传统RNA测序中的问题。英国牛津纳米孔公司(Oxford Nanopore Technologies)报告,他们延伸了RNA与线性DNA,让其通过镶嵌在膜中的纳米孔。美国太平洋生物技术公司也宣布,运用该公司的单分子实时(SMRT)化学测序技术,他们能直接对RNA测序。“这个想法在SMRT研制时就有了。”公司的首席科技官乔纳斯·库尔赖斯(Jonas Korlach)说。SMRT利用复制DNA链的DNA聚合酶,能够实时观察到荧光核苷酸聚合成DNA链。为了让这些技术能用于RNA,库尔赖斯、梅森和合作者用HIV中的逆转录酶取代了聚合酶。与DNA平台一样,修饰过碱基与未修饰碱基在聚合速率上截然不同,前者远低于后者,从而让每种修饰都具有了“动力学特征”。
不过,技术上的障碍仍然存在,RNA结构本身比DNA更复杂。一是RNA容易自身折叠形成环和结等高级结构。在他们的研究中,牛津纳米孔公司把RNA组装到cDNA上,能“烫平”二级结构,让RNA穿过小孔。二是RNA比DNA容易降解,妨碍长时间的测序过程。
还有另一个挑战存在于数据方面,那就是RNA化学修饰的数量。在同一个RNA分子中识别出多种不同的化学修饰需要大量的训练集才能教会探测软件辨别不同的化学修饰。温斯顿·提姆普(Winston Timp)是约翰?霍普金斯大学的生物医学工程师,他已经利用牛津纳米孔公司的技术开发了新方法用于探测特殊的DNA修饰。他打算把这一技术应用到RNA上,开发识别m6A修饰的训练集。“问题是,我们不知道一个特定的分子上的化学修饰到底会有多么不同,但是那正是我们要研究的,这是令人兴奋的研究领域!”他说。
资料来源 Nature
责任编辑 遥 醒
――――――――――
本文作者卡瑞驰(Kally Rae Chi)是《自然》杂志记者。







