我们已经拥有一系列出色的基因编辑器,但一直缺少高效的运送者。
如果你是一个航天发烧友,同时又紧跟CRISPR的动态,那么你或许会把这两个领域的新晋“顶流”——火星登陆的毅力号和体内注射的碱基编辑——组成“CP”,因为它俩从某种层面上看是非常相像的。
毅力号探测器乘坐火箭升空,之后依靠自身的巡航、下降和减速系统完成火星软着陆,随即开始在目标区域活动,并借助多种相机、分析仪、成像仪、光谱仪等装备寻找生命的迹象。CRISPR系统通过注射进入机体,之后靠着递送载体保驾护航行至目标细胞,载体随即释放碱基编辑工具,细胞内的基因编辑工作由此开始。
对于毅力号来说,从时速2万公里变为0的着陆过程是极具挑战性的“恐怖7分钟”。而对于基因/碱基编辑系统而言,从进入生物体到开始编辑的整个过程都是不可见又不可控的“恐怖时间”。
火星登陆成不成,仰仗着陆系统的能耐;碱基编辑好不好,指望递送载体的水平。如果我们想让体内注射形式的基因治疗真正发挥作用,设计出更智能、更高效的递送载体是关键。
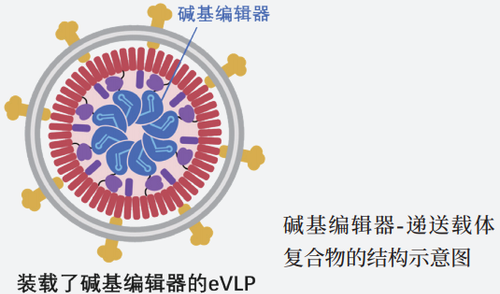
近期,由刘如谦(David Liu)博士领导的哈佛团队推出了新一代(第四代)的“工程化类病毒颗粒”载体(eVLP)。该团队于2022年1月发表在《细胞》(Cell)上的研究显示,这些气泡状的eVLP能将CRISPR和碱基编辑组件传送至各类器官和组织。相比于前三代载体,新版eVLP以更高的效率抵达目标,释放组件,编辑细胞,且副作用极小。(所谓“类病毒颗粒”是病毒蛋白的组装体不具备病毒的遗传物质,换言之,eVLP载体只拥有病毒的躯壳,却没有病毒的灵魂。)
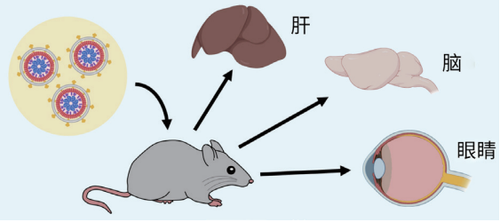
新成果包含了3个关键的概念验证试验:研究团队借助有eVLP加持的碱基编辑系统,成功恢复了遗传性失明小鼠的视力,关闭了小鼠肝脏中与高胆固醇水平相关的突变基因,修复了小鼠大脑内的缺陷基因。
第四代eVLP如同一艘功能强劲的分子飞船,载着基因修改器,驾轻就熟地进入视网膜组织,失明小鼠在完成单次注射后的短短5周内就获得了视力。小鼠的肝脏和大脑组织存在防御屏障,尤其大脑的屏障非常牢固,但eVLP还是攻坚成功,准确送达——单次注射降低了肝脏突变基因导致心脏和神经损伤的风险,而进入脑细胞的编辑工具有大约50%的机会改变缺陷基因。
更令人赞叹的是,eVLP是一个“即插即用”的平台:通过改变目标组件,理论上它可以抵达身体的任何地方。
刘如谦指出:“我们非常需要一种更好的方法来将蛋白质输送到生命体的各种组织中。我们希望这些eVLP不仅能用于传递碱基编辑工具,还可运载其他的蛋白质。”
生物技术公司Verve Therapeutics的联合创始人兼首席执行官塞卡?凯瑟瑞桑(Sekar Kathiresan)博士表示:“总的来说,刘博士及其同事在基因编辑工具的递送方面取得了令人激动的新进展。”(凯瑟瑞桑并未参与新研究。)
智能运送官
我们已经拥有一系列出色的基因编辑器,但一直缺少高效的运送者。
所谓的碱基编辑是CRISPR的一种变体,以其极致的精确性而风靡行业。与传统的CRISPR类似,碱基编辑工具有两大组成部分:负责寻找目标基因的向导RNA,以及负责替换单个碱基(A、G、C、T)的Cas蛋白。不过碱基编辑不像Cas9“魔剪”那般剪断DNA双链,因此它更少犯错,有望成为治疗数百种遗传疾病的终极方案。
病毒长期以来都是研究人员首选的递送载体,因为它们具有感染细胞的能力。科学家会消除病毒引发疾病的能力,与此同时,又利用它携带碱基编辑器的编码序列的本领。载体一旦进入细胞,其中的编码序列就会表达蛋白质。细胞因此能够产生自己的碱基编辑工具。刘如谦团队和其他科学家此前都利用过腺相关病毒(AAE)将编码碱基编辑器的DNA递送至靶组织。
但这种方式并非最佳。一方面,我们知道碱基编辑器的核心功能部件是负责转化碱基(C→U)的脱氨酶,以及能与目标DNA结合的Cas蛋白。将这些蛋白质以DNA序列的形式导入目标然后再表达继而开展编辑(借助核转染技术),整个过程更加漫长,增加了脱靶频率。另一方面,病毒载体虽然高效,但会导致细胞超速运转,产生过多碱基编辑器,加重细胞负担,带来副作用。此外,病毒也有可能通过进入基因组本身而破坏基因完整性,引发癌症风险。
鉴于上述种种,我们是不是可以设计出一类取病毒之精华而去病毒之糟粕的“仿”病毒载体,直接带着碱基编辑器而非其编码序列,奔赴目的地呢?
新eVLP,新世界
只有病毒躯壳而没有病毒DNA的eVLP就是这一思路下的典范作品。它不会造成真正的感染,却又能像真病毒一样快速有效地“感染”细胞 ,且装载的是编辑工具,没有细胞内“再表达”环节。
当然,它也存在不足之处,那就是递送精准度很糟糕:旧版本(前三代)的eVLP有时候会像一艘归航系统失控的飞船,撞向其他行星并引发意想不到的灾难;它也不擅长“到点卸货”,编辑器有时明明已经抵达目的地了,却被锁在载体内无法释放,这让整个基因编辑工作失去了意义。
而刘如谦等人所做的工作就是弥补老eVLP的短板。他们分析发现,如果限制在eVLP内充当载体“安全带”的蛋白质的数量,“货物”会更容易被释放;此外,货物的包装方式也会影响其释放。安全带和货物之间的平衡似乎是既保证货物安全又能助其在目的地顺利释放的关键。另一方面,在eVLP的外层修饰特定的蛋白质有助于它抵达目标器官。
刘如谦表示:“我们知道了一些eVLP的关键瓶颈,以及解决它们的方法。虽然我们必须为一种不寻常的蛋白质货物开发新版本的eVLP载体,但是我们可以高效地完成这项工作。”
工作的成果是喜人的,新载体所能包装的货物量是老版eVLP的16倍,新工具的编辑效率比过去提高了26倍。
如研究团队事先所预期的,四代eVLP几乎不受脱靶效应的困扰。他们检测了DNA水平和RNA水平的脱靶情况,发现eVLP相比于病毒或其他质粒载体,几乎不会发生脱靶现象。
刘如谦团队计划未来开发更优质的“安全带”蛋白质,为载体内的“货物”提供更好的服务。这些货物可以是基因编辑器,也可以是胰岛素或用于癌症免疫治疗的蛋白质等。此外,他们还将进一步解析 eVLP,探索它在人体内的更多可能,并尝试研发更新型的载体。
资料来源 singularityhub.com