( 中科院上海药物研究所)
艾滋病在全球的恶性蔓延
2002 年12 月1 日是1988 年伦敦世界卫生部长会议倡导的第十四次世界艾滋病日/ 运动。艾滋病出现至今不过20 年, 却给人类带来了巨大灾难。据联合国艾滋病联合规划署公布的最新统计数据, 自1981年发现首例艾滋病以来, 全世界累计已有6000 万人感染了艾滋病病毒, 仅2002 年, 全世界已有300 万人死于艾滋病, 新感染艾滋病病毒的人数约有500万。
目前, 世界上艾滋病发病最严重的地区仍然是非洲, 紧随其后的则是亚洲和太平洋地区。中国艾滋病流行的情况十分严峻, 艾滋病病毒的感染人数每年以30 %的速度增长。据了解, 自1985 年我国发现首例艾滋病病人以来, 艾滋病在我国目前已进入快速增长期, 感染人数急剧增加。中国卫生部官方网站提供的数据表明, 2001 年报告艾滋病病毒感染人数较2000年增长了58%。到2001 年底, 我国艾滋病病毒感染者累计已达85 万人, 居亚洲第4 位和世界第17 位。其中艾滋病病人数累计达20 万人以上, 现存活病人8万~ 10 万。另据初步统计, 2002 年上半年我国报告发现艾滋病病毒感染者比2001 年同期增长了16.7 %,累计感染总人数已增长到100 万。如果不采取积极有效的措施, 专家估计, 到2010 年我国实际艾滋病病毒感染人数将达到1000 万人。
什么是艾滋病?
艾滋病( AIDS) 的全名为“获得性免疫缺陷综合症” 。它是由艾滋病病毒, 即人类免疫缺陷病毒( human immunodeficiency virus, 简称HIV) 感染引起的传染病。通俗地讲, 艾滋病是艾滋病病毒侵入人体后破坏了人体的免疫系统, 使人体丧失抵抗各种疾病的能力, 从而发生各种难以治愈的感染和肿瘤, 最后导致被感染者死亡的一种严重传染病。1982 年9 月, 美国疾病控制中心以“ 获得性免疫缺陷综合症” 为这种复杂的疾病命名。这个命名表达了艾滋病的完整概念,从中我们可以了解到艾滋病的三个明确定义:
获得性:表示在病因方面是后天获得而不是先天具有的。
免疫缺陷:表示在发病机理方面, 主要是造成人体免疫系统的损伤而导致免疫系统的防护功能减低、丧失。免疫缺陷病的共同特点是:a .对感染的易感性明显增加;b.易发生恶性肿瘤;c .临床及病理表现多样化。
综合症:表示在临床症状方面, 由于免疫缺陷导致的各个系统的机会性感染、肿瘤而出现的复杂症状群。
艾滋病病毒是一种不同于一般病毒的逆转录病毒, 具有极强的迅速变异能力, 而人体产生相应的抗体总落后于病毒的变异, 因而无法阻止艾滋病病毒的繁殖和扩散, 更何况人体免疫系统产生的抗艾滋病病毒抗体是毫无作战能力的非保护性抗体。艾滋病病毒的迅速变异能力也给目前特效药和疫苗研制工作造成了极大困难。
艾滋病病毒对外界环境的抵抗力弱, 离开人体后, 常温下在血液或分泌物内只能生存数小时至数天, 在自然条件下则不能存活。高温、干燥以及常用消毒药品都可以杀灭这种病毒。
艾滋病病毒主要通过性接触、血液和母婴三种方式传播。据分析, 目前我国艾滋病的传播途径主要以经注射吸毒感染为主, 占累计总数的68.0%, 经采血( 血浆) 途径感染人数占9.7%。此外, 经性接触途径感染人数占7.2%, 血液和血制品感染占1.5%,母婴传播为0.2 %, 尚有13.4%的传播途径不详。
抗艾滋病药物的设计原理
20 世纪90 年代以来, 随着人类对病毒及其感染过程的分子生物学水平的深入了解, 抗病毒药物有了突飞猛进的发展, 尤其是抗艾滋病病毒药物。自1987年第一个治疗HIV 感染/AIDS 的药物齐多夫定( AZT) 被美国FDA 批准上市后, 迄今抗艾滋病药物已发展到18 个品种。目前向美国FDA 申请的新药有100 个之多, 是抗病毒药物发展史上进展最迅速的药物, 这充分说明国际上为研制抗AIDS 药物已投入了巨大人力、财力, 以期克制这一危害人类健康的元凶。
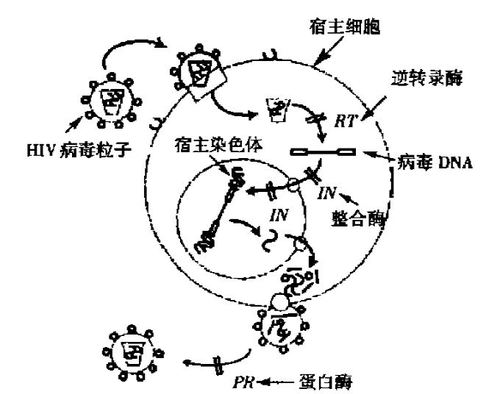
图1 HIV-1 的生命周期和抗HIV 药物靶标
抗艾滋病药物的作用机制是阻断HIV 病毒生命周期的某一个或几个关键步骤, 从而抑制病毒的复制和感染。如图1 所示, HIV -1 病毒感染的第一步是病毒粒子与宿主细胞表面受体结合并穿透细胞膜, 然后脱去蛋白质外壳释放出基因RNA 和逆转录酶( Reverse transcriptase , 简称RT) 进入靶细胞的细胞质。在RT 的催化作用下, 病毒RNA 逆转录成前病毒DNA。前病毒DNA 被移位进入细胞核, 在细胞核内被病毒产生的整合酶( Integrase , 简称IN) 整合进入宿主细胞的染色体, 利用宿主细胞已有的基因复制和蛋白表达系统进行复制。病毒的蛋白酶( Protease, 简称PR)将基因表达产生的多聚蛋白裂解, 变成各种有活性的结构和功能蛋白, 再同复制的遗传物质RNA 组装成为成熟的子代病毒, 释放出来进一步感染更多的体细胞。
因此, 根据如上所述的HIV -1 的生命周期, 目前已应用或正在研制的抗艾滋病药物主要针对病毒复制过程的8 个重要环节, 即HIV 对宿主细胞的依附( 进入抑制剂) , HIV 与细胞的融合( 进入抑制剂) ,病毒RNA 的逆转录( 逆转录酶抑制剂) , 前病毒DNA的整合( 整合酶抑制剂) , DNA 的转录, 病毒蛋白质的表达, 病毒的组装, 以及病毒粒子的发芽和成熟( 蛋白酶抑制剂) 。
目前临床上用于治疗艾滋病的18 种上市药物都是逆转录酶抑制剂和蛋白酶抑制剂, 而且两种酶的抑制剂联合使用( 即鸡尾酒疗法) 更能有效控制病毒的感染, 但药物毒性、病人的并发症、多重抗药性的出现都急切呼吸利用病毒复制周期的其他靶点来发展新的治疗途径, 提供更多更有效也更适合长期使用的治疗手段。病毒生命周期的早期事件易受药物的影响,因此成为设计HIV-1 复制抑制剂的新靶标, 而其中病毒-细胞的融合和病毒-细胞的整合成为最有前景的候选者。
现有的治疗艾滋病药物
目前抗艾滋病药物主要靶向HIV 复制过程的关键酶- -HIV 逆转录酶( HIV RT) 及HIV 蛋白酶( HIV PR) , 前者又分为核苷类HIV RT 抑制剂( NRTI)及非核苷类HIV RT 抑制剂( NNRTI) 。现分述如下:
1.核苷类逆转录酶抑制剂( NRTI) :属于这一类的药物有9 个品种, 即①齐多夫定zidovudine ( AZT 或ZDV) ;②地丹诺辛didanosine (ddl、Videx) ;③扎西他滨Zalcitabine (ddc) ;④司他夫定Stavudine (d4T) ;⑤拉米夫定Lamivudine (3TC) ;⑥阿巴卡韦abacavir(1592U89Ziagen, ABC) ; ⑦ Tenofovir ; ⑧ 复合制剂combivir (AZT+3TC) ; ⑨复合制剂trivizir (AZT+3TC+ABC) 。其中齐多夫定是第一个上市的抗AIDS 药,也是治疗AIDS 的首选药。
2.非核苷类逆转录酶抑制剂( NNRTI) :属于这一类的药物有3 个品种, 即①奈韦拉平nevirapine ;②地拉韦啶delavird ;③依非韦伦efavirene 。
3.蛋白酶抑制剂( PRI) :属于这一类的药物有6个品种, 即①沙奎那韦saguinavir ;②茚地那韦indinavir;③利托那韦ritonavir ; ④奈非那韦nelfinavirr ;⑤安普那韦amprenavir ;⑥复合制剂Kaletro
核苷类逆转录酶抑制剂均为合成DNA 的天然底物的衍生物, 通过竞争性地抑制天然核苷与HIV -1逆转录酶的结合, 阻碍前病毒DNA 的合成;并由于核苷类逆转录酶抑制剂在结构上3’缺乏羟基, 当它们代替天然核苷结合到前病毒DNA 链的3’末端时,不能再进行5’-> 3’磷酸二酯键的结合, 终止了病毒DNA 链的延长。非核苷类逆转录酶抑制剂的作用机制与核苷类逆转录酶抑制剂不同, 它们不需要磷酸化, 不直接掺入新生的病毒DNA 链, 而是直接与病毒的逆转录酶的催化活性位点结合, 改变酶蛋白的构象, 使得酶失活, 从而抑制病毒的复制。蛋白酶抑制剂作为底物类似物竞争性地抑制HIV-1 蛋白酶的活性, 或以其对称结构干忧蛋白酶的活性位点, 使得蛋白酶的活性被抑制, 子粒病毒不能成熟, 从而抑制HIV-1病毒的复制。
自1987 年第一个抗艾滋病药物齐多夫定上市,临床治疗艾滋病基本应用单药治疗, 疗效并不理想。自1995 年蛋白酶抑制剂( PRI) 引入临床后, 迅速降低的血浆HIV 病毒载量和突出的疗效, 使人们对AIDS 的治疗加强了信心。此后又发展了一系列联合疗法, 即鸡尾酒疗法, 基本采用三药或三药以上联合用药( 常用组合为1 个PRI 加2 个RTI) , 通过治疗确已降低了死亡率, 延缓了AIDS 的进展, 改善了患者的生活质量。但长期用药产生的耐药突变、毒副反应、价格昂贵等因素促使各国科学家不断探索治疗艾滋病的新靶点、新药和新的治疗方案, 以发展更有效的防治措施。
方兴未艾的全球抗艾滋病新药研发
目前抗艾滋病的新药研究主要集中在如前所述的HIV-1 复制过程中的8 个关键环节, 通过抑制病毒复制所必需的酶的活性或阻断细胞受体与病毒衣壳蛋白的结合, 来抑制病毒的复制和感染。在2002 年美国西雅图召开的第九届世界逆转录病毒年会上, 科学家们发布了一条令人兴奋的消息:一批全新的抗艾滋病病毒物即将问世, 其中一些药物候选体具有新颖的作用机制, 另外一些则是现有抗病毒药物的第二代改进品种。
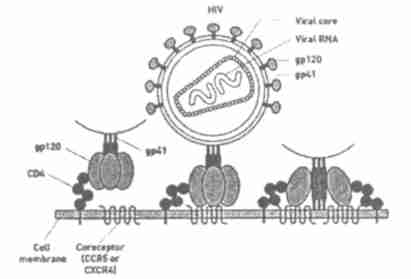
图2 HIV-1 融合的过程
新型的药物中含有一种叫做“ 进入抑制剂”( HIV-1 entry inhibitor) 的药, 可以阻止病毒进入人体细胞、从里面获得养料、进行自我复制。如图2 所示, HIV-1 与细胞的融合或称HIV-1 进入细胞的过程分为三步:病毒的依附( viral attachment) 、辅受体相互作用( coreceptor interaction) 和融合( fusion) , 每一步都由病毒和细胞的受体介导, 极易受治疗性干预的进攻。HIV-1 的进入是一个多步骤过程, 提供了对HIV-1 复制的治疗性干预的多重机会, 而且HIV-1 进入过程的协调性赋予了靶向其不同步骤的抑制剂之间具有协同作用的特性, 因此, HIV -1 进入抑制剂成为极富前景的新一类抗艾滋病候选药物。迄今为止, 已有7 种HIV-1 进入抑制剂进入临床研究,其中融合抑制剂T20 ( 由美国的药业公司Trimeris 和Roche 共同开发) 已进入临床试验Ⅲ 期, 有望发展为上市药物。T20 的问世已被广泛认为是艾滋病治疗机理的一大进步。研究人员称: “ 这是我们首次发现,阻止和干扰受体可以抵抗艾滋病毒。” 另外, 他们还发现一种叫做BMS805 的药物, 可以把艾滋病毒包裹起来, 也能达到阻止病毒进入人体免疫细胞的目的。
和以往的抑制病毒自我复制的药物不同, 这种HIV-1 进入抑制剂可以阻止艾滋病毒进入人体细胞。专家称, 新药物比起现在使用的药物具有明显的优势:它们容易使用, 毒性更低, 而且特别适于那些已对现有药物产生抗药性的患者。另外, 这种药物有可能用于预防HIV 感染。
抗艾滋病化学疗法的另一研究热点是以HIV -1复制所必需的三大基本酶之一的整合酶( IN) 作为靶标。HIV -1 编码三种酶:逆转录酶( reverse transcriptase,简称RT) 、蛋白酶( protease , PR) 整合酶( integrase , IN) 。由于目前临床上用于治疗艾滋病的药物都是逆转录酶抑制剂和蛋白酶抑制剂, 均不能根除HIV, 并出现了多重抗药性菌株, 因此, 整合酶抑制剂有望提高疗效, 并能与已有的抗艾滋病药物产生协同作用组成新的联合疗法用药方案( combination therapy regimen) 。逆转录病毒DNA 在整合酶的催化下插入宿主染色体内, 进而发生HIV 的复制和感染;而且HIV-1 IN 以单一的活性部位与病毒和宿主两种不同构象的DNA 底物作用, 有可能限制HIV 对整合酶抑制剂药物产生抗药性;加之整合酶只存在于病毒中, 哺乳动物类均无对应酶, 因此整合酶成为大有前景的抗HIV 药物设计的新型靶标。由盐野-葛兰素史克联合制药公司研制的新药S -1360 就是通过抑制艾滋病病毒的整合酶来控制病毒对细胞的感染的。这家公司介绍, S-1360 在通过了一期临床试验后已被定为“ 可开发药品” , 正在艾滋病病毒感染者中进行二期试验。在抗艾滋病的机理上, 研制公司称S -1360 实现了一个机理上的突破, 它扩大了抗艾滋病药物的选择范围, 可能在其他药物的辅助下更好地控制艾滋病病毒在人体中的复制, 从而完善艾滋病的治疗。
总之, 由于艾滋病对人类的危害, 各国政府投入了巨大的人力、物力和财力与之斗争, 并在全球进行广泛合作。抗艾滋病新药发展之快前所未有, 新药、新靶点、新治疗方案、疫苗研究日新月异, 在全人类的努力下, 多管齐下, 力争打赢这场“ 艾滋” 狙击战。