
惠利健
中国科学院分子细胞科学卓越创中心研究员
普罗米修斯是希腊神话中的英雄,他用黏土创造了人类,并且违抗宙斯的命令,盗火给了人类,最后使得自己在高加索山脉上接受宙斯的惩罚:每天恶鹰会来啄食普罗米修斯的肝脏,而他的肝脏又会在夜晚重新生长出来。为了人类能拥有光明和温暖,他必须日复一日地忍受这种痛苦。这个神话刻画了普罗米修斯为人类献身的英雄主义,普罗米修斯之火也成了引导人类进步的象征。有意思的是,这个神话还描述了一个生命的奇迹,即肝脏的强大再生能力。
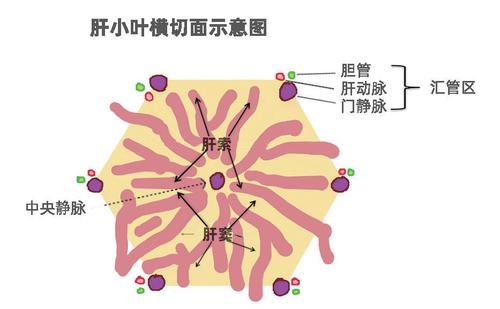
肝脏是体内最重要的器官之一,发挥着代谢、分泌、解毒等多种生理功能。肝脏从大体上来看,是一个相对均质的组织。从具体的构建细节来看,肝脏是由一个一个的肝小叶作为基本功能结构单元构成的。肝小叶可以大致想象成一个多边形的结构,中心区域是中央静脉;几个顶点是汇管区存在的地方,汇管区内有肝动脉,门静脉和胆管。肝细胞和胆管上皮细胞是构成肝脏的主要细胞类型,前者是肝脏内最重要的功能细胞,占肝脏总重量的约80%。肝细胞从中央静脉排列成索状,一直到汇管区。动脉和门静脉的血液经过肝索间内皮细胞形成的肝窦中流入中央静脉。肝细胞和肝细胞之间会形成胆小管的亚细胞结构,肝细胞分泌的胆汁流入胆小管,通过互相间连接的胆小管,最后汇入由胆管上皮细胞构成的胆管中。肝脏中还有一些免疫细胞、星型细胞等,分布于血管内皮细胞周围或者肝窦间隙中。
哺乳动物的大多数组织器官都缺乏再生完整器官的能力,但肝脏是个例外。在极端情况下,肝脏被切除高达70%后,残余的肝组织仍然可以在2周左右的时间内再生出整个肝脏器官来(尽管其外观的大体结构并不能被再生出来)。在其他一些急性化学性损伤过程中,肝脏也往往能够非常好地再生损伤组织。但当受到持续性损伤时,比如慢性病毒感染、脂肪性肝炎、长期药物肝损伤等,肝脏的再生修复能力会遭到破坏,常会出现肝纤维化等病理状态,严重时会导致肝硬化和肝衰竭,危及病人的生命。
肝脏是再生研究的热点器官
由于肝脏的强大再生能力,并且肝脏再生与相当多的肝脏病理变化相关,因此肝脏一直是再生研究领域中深受关注的器官。肝脏再生过程有相当多非常有意思的科学问题,比如:再生过程的诱导因素是什么,而组织完成再生后,整个过程又是如何被恰到好处地终止;再生过程的血管和胆管重建问题;免疫细胞对肝脏再生的作用;衰老状态下,再生能力下降的原因等等。但在这些问题中,一个核心的关注点是,肝细胞作为最重要的功能细胞,是如何被再生出来的,其细胞来源是什么,涉及哪些调控的因子?
20世纪中后期,对肝脏再生的研究主要是形态学描述,比如利用光学显微镜和电子显微镜,进行组织结构和细胞形态方面的观察。研究者主要采用肝脏切除模型来研究肝脏再生。在这个过程中,观察到在很短时间内,肝细胞就出现了内质网变形、线粒体减少等变化;在肝脏切除大约24小时左右,肝细胞出现了细胞分裂象,提示肝细胞正在发生增殖。随着同位素标记和核酸标记技术的发展,人们可以真正跟踪肝细胞增殖过程中细胞遗传物质——脱氧核糖核酸(DNA)的复制,从而可以了解肝脏再生的细胞来源。利用啮齿类动物模型,研究者发现在肝脏切除后16小时左右,肝细胞开始出现DNA的复制,大约在24~36小时达到高峰;当再生完成时,所有肝细胞发生了一次或者两次增殖。基于这些研究,领域内普遍认为,在肝脏再生过程中,肝细胞的自我复制是再生的主要细胞来源。
在对肝脏切除再生过程的一系列研究中,利用生物化学的分离纯化和检测手段,人们还发现了一系列在再生过程中有诱导生长作用的因子和激素类物质,比如上皮细胞生长因子(EGF)、肝细胞生长因子(HGF)、甲状腺素、去甲肾上腺素等。这些因子的单独使用,在体内和体外实验都可以看到对肝细胞增殖有部分的诱导作用。不过那个时代的研究缺乏遗传学动物模型,因此这些因子体内的确切作用机制,不是非常明朗。有意思的是,对肝脏再生过程进行组织学分析,可以观察到不同形态大小的肝细胞,而体外培养这些肝细胞时,似乎也看到它们的增殖能力不尽相同。也由此提出肝脏内不同肝细胞可能增殖能力不同,对再生的贡献大小不同的假说。
寻找肝脏干细胞
在胚胎发育中,大家发现了胚胎肝脏干细胞的存在,其发育来源于胚胎早期形成的内胚层组织。在肝脏形成过程,这些干细胞可以进一步分化为两类不同的上皮细胞——肝细胞和胆管细胞。20世纪90年代,随着实体组织中成体干细胞概念的逐步形成,肝脏再生领域中也有人提出成体肝脏中是否存在肝脏干细胞。这些成体肝脏中的干细胞可以在损伤后贡献到肝细胞的再生,以及胆管细胞的再生。因此,研究者们参照其他器官,特别是血液组织造血干细胞的研究方案,利用在细胞表面特异表达的分子,分离纯化可能的成体肝脏干细胞。这个研究的过程参考了胚胎发育时期肝脏干细胞的表面特异分子。
最后的结果是,大家发现了近十种不同的表面分子,这些表面特异分子可以标记互相间重叠程度或大或小的若干类群细胞。利用谱系追踪技术,不同实验室在各自研究的损伤模型中,发现这些细胞似乎都能贡献到肝脏再生中去。利用肝细胞移植技术,大家还发现这些细胞多多少少也都可以在移植后再生。但是,很难想象成熟肝脏中存在这么复杂的干细胞体系。因此,成体肝脏干细胞是否存在,让研究人员产生了极大的困惑。
另一方面,在肝切除模型中,早期有人对肝脏尝试了连续的切除和再生研究。发现可以进行多达12次连续的肝脏切除和再生。在20世纪90年代,大家也逐步建立了肝细胞移植的模型,基本思路是构建一些功能缺陷肝脏动物模型,移植野生型动物的肝细胞后,这些野生型的肝细胞可以在肝脏中定植和扩增。利用这些肝细胞移植模型,大家发现肝细胞可以长期连续移植。通过相应的计算,估计肝细胞可以扩增30多次,也就是大约10亿倍左右。基于这些发现,有人提出了肝细胞可能并不是终末分化细胞,其本身是否就是单能干细胞(unipotent stem cell)的假说。基于这个假说,一直寻找的肝脏干细胞可能就是成熟肝细胞;不过,这个假说也指出,这样的单能肝脏干细胞很可能就无法贡献到胆管细胞了。
尽管成体肝脏干细胞的寻找并不顺利,或者说让人非常有挫败感,但在对肝脏干细胞的探索过程中,还是涌现了大量的新数据和新假说。比如,利用移植技术,基本否定了成体组织内存在多潜能干细胞的概念;也否定了血液细胞可以转换为肝细胞的假说。另一方面,利用这些新发现和新技术,推动了一些成果的临床转化研究。比如,研究者们发现了胚胎肝干细胞的培养方法,提出了肝细胞移植治疗的概念,建立了肝细胞移植的动物模型。此外,也开始初步尝试生物人工肝的大动物和临床研究。但是,由于肝细胞培养和分化的技术难题,而临床治疗所需的细胞数量极大,因此,这些技术都没有真正实现临床的治疗应用。
肝细胞属性转换研究的兴起
21世纪以来,随着细胞谱系遗传标记技术的进一步发展,研究者们可以更为精准地跟踪细胞在体内的谱系变化。到2010年前后,利用了一系列高度复杂和精准的遗传标记方法,若干个实验室陆续确认再生过程中的肝细胞都是来自原有的肝细胞,从而基本否定了肝脏干细胞的存在。在同一个时期内,随着获诺贝尔奖的诱导性多能干细胞(iPSC)技术的建立,以及中国、美国等学者成功实现了将成纤维细胞体外转变为其他类型功能细胞,不同细胞属性间可以发生转换(包括细胞去分化和细胞转分化)这个概念得到广泛认可。与此同时,一些关于体内损伤再生过程的细胞属性转换的研究也开始出现,主要是在肠道、胰岛等上皮组织中发现细胞属性转换对组织损伤修复的作用。
在此背景下,有研究者开始考虑肝脏是否也存在通过细胞属性转换方式实现损伤后的组织再生。因此,利用遗传标记方式,对损伤后肝脏再生过程进行详细的研究分析。研究者发现肝细胞在某些急性损伤后,的确会发生去分化,获得胚胎肝脏干细胞的某些特征;并且这些细胞在损伤后修复过程中,可以再次分化为肝细胞和胆管上皮细胞。这些经由肝细胞“去分化-再分化”的再生方式可以贡献到30%以上的肝组织再生。由于这个去分化过程十分短暂的,因此,用传统方法无法很好地捕捉到。这也部分解释了为何很长一段时间,研究者看到了多种所谓的“肝脏干细胞”——很可能大家标记的细胞处于去分化过程的不同阶段。更为有意思的是,中国和英国的科学家利用细胞谱系标记技术率先证明,在肝细胞增殖受到抑制的条件下,肝细胞的再生可以由胆管细胞而来。在严重的长期损伤下,大约50%以上的再生肝细胞是来自于胆管细胞。虽然胆管细胞形成肝细胞的过程到底是直接转分化,还是去分化后再分化,抑或其本身就具有兼性干细胞的特质,仍然有争论,但是这个发现,给肝脏再生提供了一个全新的模式。
肝细胞是实现细胞移植治疗的关键细胞。虽然肝细胞在体内具有强大的增殖能力,但是在体外培养扩增,一直到最近几年都没有完全解决,这也是造成临床肝细胞移植治疗迟迟没有重大进展的原因之一。上述这些细胞属性转换现象的发现和概念的建立,特别是去分化的概念提示大家,是否可以将分化的肝细胞先进行去分化为肝脏干细胞后,再实现体外扩增肝细胞。因此,中国、荷兰、日本和韩国的学者利用这一假说,率先克服了成体肝细胞无法在体外培养扩增的技术难题,实现了肝细胞的体外获得,为肝细胞移植治疗等提供了扎实的技术支撑。
从这些研究历史可以看到于2010年前后,中国学者开始逐步加入到全球肝脏再生研究的第一梯队中,并做出了一系列重要的本土原创贡献。这完全是因为随着国家经济实力的增强,对科研投入的加大,才能使新一代的本土研究者能够有机会在相关领域内做出中国人的贡献。可以预期,我国的科技人员未来会在各个前沿基础和应用研究领域获得更多出色的原创成果,也期待相关研究成果能够早日实现产业化和临床应用的突破,为中国和全世界人民的健康谋福祉。
新技术促进肝脏再生研究
从上述对肝脏再生研究的回顾,我们大致可以看到知识发展的某些规律性。新发现的产生,常常伴随一些无法解释的现象,一些未被解答的科学问题。利用时代发展中全新的技术方法,结合本领域或者其他领域一些尚未被完全证实的新概念范式,逐步产生了一些新的发现。而新的发现必然带来新的认知、新的突破和新的应用(这些新认知、新突破、新应用,有些是可以预测的,有些是无法预测的),同时也带来了一些新的困惑、新的不解,这又推动研究者继续探索新的方向和领域,肝脏再生也是如此。
肝小叶是肝脏的基本功能结构单元,长期以来,大家知道从汇管区到中央静脉,肝细胞的代谢表达谱不同。在肝细胞移植过程不同区域肝细胞移植后,可以形成所有的肝细胞,因此这种不同被认为是微环境诱导的差异,并没有联系到肝脏再生中去。随着谱系追踪技术不断深入,研究者们可以更好地标记不同区域的肝细胞。这时,大家发现肝脏不同部位的肝细胞似乎贡献到再生中的能力不同。近来,随着单细胞测序技术的引入,带来了大量的数据,从而使得数据源头驱动、结合生物学机制研究的范式,也在肝脏再生研究领域成为一种新的研究方法和体系。2015年前后,单细胞表达谱测序技术开始逐步成为实验室的常规技术。与此同时,有不少研究者对肝脏不同部位的肝细胞,不同损伤状态下的肝细胞进行了单细胞测序,发现的确肝脏这个表面上看起来均质的组织,实质上在不同组织区域,存在着很大的表达差异。因此,这就对肝脏的再生提出了全新的挑战,这些空间位置不同,表达谱不同的细胞,在再生中是如何作用,是否都发生一样的变化?在再生过程中,又是如何重新形成的?在特定病理条件下,如何重塑微环境?如何合理精准地动员这些细胞贡献到再生,并且避免肝脏疤痕(纤维化)的形成?对这些问题的回答和了解,很可能把我们对肝脏再生带入到一个全新的领域,非常值得期待。
肝脏再生的普罗米修斯之火
回溯过去半个多世纪肝脏再生的历史,在探索未知的前沿,是一条充满荆棘的光荣之路,艰辛曲折然而意义深远。我们对自然的认识很大程度上是受限于我们现有的技术和工具;技术和工具的局限性,使得很多探索无法深入并企及细节,相关的结论和由此构建的理论框架也就必然会在某些方面存在困难。框架性理论的构建一方面指导了我们更高效地对未知的探索和理解,另一方面也常常会使我们对新的认知造成局限。所以那些全新的技术体系,那些反复出现、无法解释的现象,不管是新的还是旧的,成为那些活跃在第一线的先锋们的关注点。只有那些勇于打破成规的行动者和真正深刻的思考者,如同普罗米修斯给人类带来火种,才会给整个领域一次又一次地带来全新的观察和颠覆性的理论体系。