布朗(Brown)和戈德斯坦(Goldstein)认为近年对动脉粥样硬化的认识,有点像25年前发现癌基因前,人们对癌症的理解,希望提出一个统一的假设对癌症种种起因进行解释。已经确认一些致动脉粥样硬化的原因有胆固醇 - 载脂蛋白、吸烟、高血压、年龄和遗传因素,但一元化的理论还未建立。克里格(Krieger)及其同事从巨噬细胞源性互补DNA克隆分离出Ⅰ,Ⅱ型两种清除细胞受体,使这一理论临近阐明。
清除细胞受体发现于1979年;当时试图搞清低密度脂蛋白(LDL)-胆固醇是如何累积在巨噬细胞或家族性高脂血症(FH)患者的动脉粥样化斑中的,由于FH患者缺乏LDL受体,其粥样化斑动脉壁中和血浆LDL高于其他个体,明显存在着满载 - 胆固醇巨噬细胞,并称此为泡沫细胞。从正常和FH对象分离出巨噬细胞的LDL受体数极少不能摄取天然LDL,但在离体培养则活跃地吞噬化学修饰的LDL(赖氨酸残基经乙酰化作用)使巨噬细胞转变为泡沫细胞。
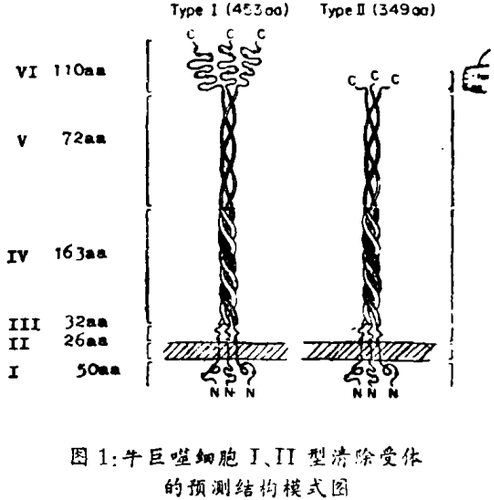
本期柯达马(Kodama)和罗勒(Rohret)等的论著从牛肺cDNA文库中分离出两种相关的受体互补DNA克隆,可编码出两种不同类型的Ⅰ,Ⅱ清除受体,并已分离鉴定。巨噬细胞清除受体是三聚体的膜糖蛋白,分子量220 K。Ⅰ型受体的计算分子量为49,975,有七个可能的N-连接糖基化作用位点,先测定其部分氨基酸(aa)序列,推导出一级结构,显示有六个顺序相连的肽结构区:Ⅰ、氨基末端胞浆区(1 ~ 50个aa残基位于胞浆)Ⅱ. 跨膜区(51 ~ 76 aa)Ⅲ、间隔区(77 ~ 108 aa)Ⅳ. α - 多重螺旋区或α - 螺旋多重绞链区[(α-helix Coiled coil domain)(108-272 aa)Ⅴ. 胶原样区(272 ~ 343 aa)Ⅵ. 羧基末端的富集半胱氨酸区(343 ~ 453 aa)
细胞表面受体
巨噬细胞形成泡沫化的关键是细胞表面受体介导脂蛋白的内吞作用。受体能识别细胞负电荷的增强,这样当赖氨酸残基通过乙酰化作用使LDL蛋白去遮蔽时,消去正电荷。乙酰 - LDL的摄取为一些但不是所有多聚阴离子的互相竞争而抑制,由此看来,受体能识别结构与电荷。尤为明显的是受体能区别而与其结合的为单链多核苷酸,多聚肌苷酸[Poly(Ⅰ)]和多聚鸟苷酸,而不能结合多聚腺苷酸和多聚胞苷酸(poly A-C)。由于受体的广泛特异性,不用多久就称乙酰 - LDL受体为清除受体。
Ⅰ、Ⅱ型清除受体的5个同一共有结构区为Ⅰ氨基末端胞浆区(残基1 ~ 50)Ⅱ. 跨膜区(残基51 ~ 76)Ⅲ. 间隔区(残基77 ~ 108)Ⅳ. α- 螺旋多重铰链区(残基109 ~ 271)Ⅴ. 胶原样区(残基272 ~ 343)。两者不同之处是Ⅵ区,Ⅰ型受体羧基末端为110个aa的富集半胱氨酸区,而在Ⅱ型受体的Ⅵ区以6个aa残基所置换。
aa:氨基酸
斯坦伯格(Steinberg)及其合作者对清除受体配体生理意义的研究发现氧化LDL与乙酰 - LDL结合受体时互相竞争,释出足够的胆固醇而形成泡沫细胞。由一个胆固醇脂为核心并为阿扑脂蛋白B-100与成百的磷脂分子的疏水层所包围,构成复合LDL微粒。磷酸脂蛋白的不饱和脂肪酸易受化学氧化,血浆中此氧化过程为抗氧化剂所阻断。并认为当氧化剂耗尽,LDL延搁动脉壁而被捕集。然后,LDL模拟乙酰化过程受氧自由基控制而转变为活性醛和氧化物,粘附于阿扑B-100的赖氨酸残基。在离体培养,氧化LDL对各种细胞具细胞毒性,而其重要性为下列三方面所证实。(1)通过氧化LDL抗体免疫染色显示醛 - 赖氨酸结合物粥样化色斑;(2)在离体源于动脉壁粥样化斑的LDL,结合于清除细胞受体,增强负电荷造成泡沫细胞;(3)Watanabe - 渡边 - 遗传高脂血症家兔是与FH相对应的动物模型,抗氧化剂佛波醇能局部地阻止动脉粥样硬化。
从交叉 - 竞争实验看来,巨噬细胞表达了几种清除受体的类型;乙酰-LDL型、氧化LDL型和两者结合型。清除受体多样性可能的解释是存在着不同的受体亚型。
Ⅰ,Ⅱ型受体结构上的同一性,生物活性明显相似,氨基酸序列Ⅰ- V区肽段是共有的,不同的结构只是Ⅱ型受体羧端不存在Ⅰ型的110个aa的细胞外富集半胱氨酸区,而被6个aa残基所置换,像一个截端的清除受体。因此,Ⅰ型由453个Ⅱ型由349个aa组成。两种受体有未中断的24个甘x · y复片段伸向细胞外。这里的多数ys和一些xs是脯氨酸。与纤维状胶原的结构相类似胶原样单体有338个甘x · y重复序列,互相卷曲围绕,构成三螺旋结构。与胶原样重复序列一样,可以预测两个清除细胞受体有23个七价基重复,存在着α - 螺旋多重绞链相互作用的可能性。巨噬细胞清除受体有纤维状多重螺旋结构肽段是首次发现。两种类型清除受体是同型抑或是异型三聚体来源,仍是未知。
哺乳动物清除受体表达载体 - 质粒PxSR7,转染于Cos细胞时,每个克隆受体有相似的亲和力结合乙酰 - LDL,显示了预期的多聚阴离子的结合特异性,乙酰LDL,顺丁烯二酰化 - 牛血清白蛋白(M-BSA),poly(Ⅰ)能抑制,125Ⅰ标记乙酰LDL的内移化和脂解,而LDL,BSA和poly(C)则不能。一个重要的问题,还未解决就是两种类型受体或只是其中之一是否与氧化LDL结合。巨噬细胞的所有清除活性可由其细胞受体来解释,且应该继续探讨其清除作用。
受体的三个主体胞外结构区(Ⅳ,Ⅴ,Ⅵ区)参与特异的配体结合,配体包括化学修饰的LDL和一些多聚阴离子等。两个胞外纤维状结构区(Ⅳ与Ⅴ)之—或两者是受体与配体特异结合的决定性因素是组装此三聚体受体的关键部件。
胶 原
另外的问题是胶原如何参加介导的?两者的三聚体结构和其广泛的特异性结合支持了清除细胞受体和胶原之间有功能相似性。正如作者克里格(1990)提出胶原可以结合很多分子。氧化LDL沉积在高含量胶原组织中,如腱和粥样硬化斑块及其动脉壁中、清除受体与胶原竞争结合氧化LDL。巨噬细胞能沿胶原纤维移动,以清除细胞受体作真空吸尘器用,摄取氧化脂蛋白及其他多聚阴离子,使粘附于胶原。
且不问清除受体与胶原问有多少相似的功能,清除实体可能是机体重要的防御机构,使清除细胞能摄取和降解氧化或化学性能改变的蛋白质,这些解释了游走单核巨噬细胞清除受体的发生。巨噬细胞侵袭,循环不良灌注组织如腱和动脉粥样化斑血管壁,可以适应抗毒剂的递减,也可以解释在肝血窦内皮受体的大量富集,这里受体可能起过滤器的作用,从血流中去除氧化蛋白。
受体胶原样结构肽段,胞外间质胶原和有类似胶原样重复序列的三螺旋结构的少数胞外蛋白质;有乙酰胆碱脂酶,C1q补体因子,肺泡表面活性物质 - 相关载脂蛋白,这几个是重要的细胞表面受体。这里,胶原介导了各种细胞功能,使受体与Von Willebrand因子,动脉内膜中脂质微粒,离体时天然或修饰LDL等种种分子相结合。
尽管在多数组织,清除受体可能起到保护作用,但对粥样化斑动脉壁也可能引起动脉损伤作用。氧化脂蛋白的摄取可以诱发巨噬细胞分泌细胞分裂素,生长因子系列和其他介质刺激胶原的分泌,促进平滑肌细胞增殖和进一步增加LDL的氧化,所有这些都将增加粥样化斑的数量。上述作用的结果是血管正常的恢复或是动脉疤痕的增加。但在冠状动脉有限的空间,甚至一极微小的疤痕将是灾难性的。
吸烟能氧化LDL,使结合于清除细胞受体的LDL去遮蔽。年龄增长常伴随氧化蛋白的累积。使动脉中胶质增加,在所有上述的进程中清除受体都能起到保护作用吗?作者希望能产生一元化的理论来解释胆固醇、高血压、衰老和遗传因子的致动脉粥样硬化机理
[Nature,313期1990年]