在细胞蛋白质功能研究中把配体(和蛋白质结合的有机化合物)和变异作用联系起来——
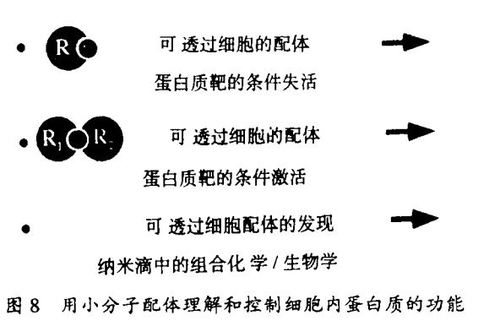
要测定细胞蛋白质的功能一般需要一种改变功能的手段。这样做的最常用的办法是间接的方法,并涉及应用编码有关蛋白质的基因的突变。一种补充的直接的途径则是使用小分子配体,以改变与之结合的蛋白质的功能。由于许多蛋白质在细胞内发挥功能,能渗入细胞的配体就特别有价值。这种能够使与之结合的蛋白质的功能发生激活或失活的配体是存在的。
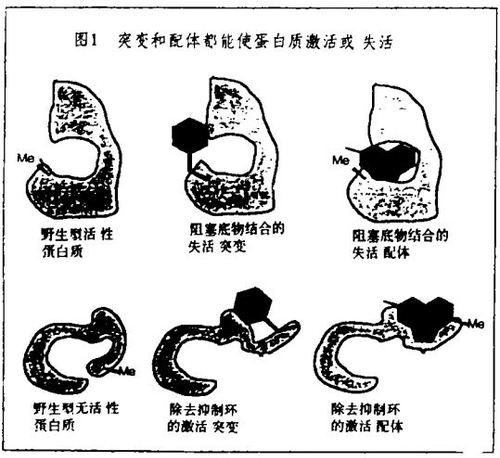
大多数用来研究蛋白质功能的突变作用使编码的蛋白质失活,其中最常用的是缺失突变,广泛地用于从细菌到哺乳动物的遗传学。条件突变也是有用的,在此失活作用只能在实验者所能达到的“非允许”条件下观察到。一个例子是温度敏感折叠突变。把温度变到非允许温度就阻止了新生肽链的折叠,因而阻止了它们获得细胞功能。
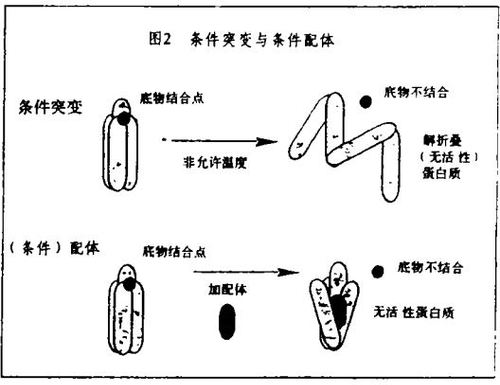
存在许多能使它们所配位的靶蛋白质的功能失活的小分子,它们是以有条件的方式这样做的,即失活作用要求在实验中使用这些分子。其中最常见的是那些和酶的活性部位结合,因而抑制了酶的关键活性的分子。但是也存在许多小分子通过其它途径使蛋白质失活的例子。例如,秋水仙素不仅用来发现它所结合的蛋白质——微管蛋白,而且用来研究它的细胞功能。细胞松弛素和latrunculin已用于使另一种细胞结构蛋白质肌动蛋白失活,同时也用于肌动蛋白功能的研究。在信号传导过程中,雷帕霉素(Rapamycin)(结合到亲免蛋白,在此是FKBP12上的配体的一个例子)和trapoxin在我们的实验室中被分别用来发现和研究它们通过结合并使之失活的蛋白质FRAP和组蛋白脱乙酰酶(HDAC)。因为这些分子被用于模拟温度敏感折叠突变的研究,人们对这两种技术的专一性感兴趣。小分子和温度迁移对全套转录过程的影响的最近观察结果表明,前者有极高的专一性而后者则无。
激活编码蛋白质功能的突变也是已知的。其中最著名的是致癌突变,它使正常处于细胞周期调节下的信号蛋白质产生组成活性(consititutive activity)。条件激活突变是极少见的。但是,条件激活其靶蛋白质的小分子配体却代表了已知配体的相当部分。和秋水仙素相反,紫杉醇和discodermolide是和微管蛋白结合并使之激活的小分子。这些配体促进微管蛋白聚合成微管(细胞骨架的一个组分)。环孢菌素、雷帕霉素和FK506与亲免蛋白结合并因此诱导后者与信号蛋白质钙调神经磷酸酶和FRAP形成配合物。最著名的“激活”配体是类固醇激素,在与类固醇激素受体结合后它们激活转录过程。最近,已开发了从失活配体构建激活配体的一般方法,这个技术将在我的讲演中讨论。这个技术涉及合成能够同时与两个蛋白质结合引起二聚的结构(“二聚剂”)。通过简单地使两个蛋白质在细胞中有邻近的关系,假如它们也有合适的相对取向,其中的一个蛋白质的激活就能够发生。这是由于当蛋白质的配体依赖有效摩尔数很高的时候,在适当选择的一对蛋白质之间能够发生的化学过程(例如磷酸化、蛋白水解作用)的速度就增加了。在我的京都讲演中这个概念将会数度出现。
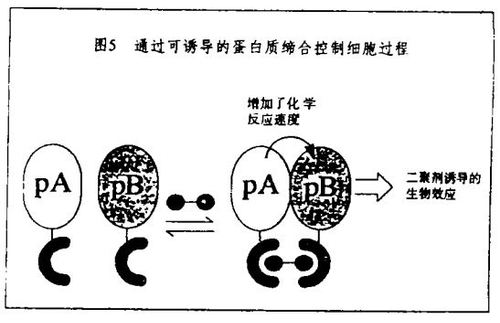
前述的例子提供了关于配体和突变在细胞蛋白质功能研究中的等价性的说明。迄今,除少数例外,使用的配体要么是天然产物,要么是它们的合成的变体(例如,天然产物的合成二聚体)。为了扩展这个基于配体的途径,正在发展发现配体的有力方法。由遗传学家定义,用于鉴别阐明蛋白质功能的突变的原则,在寻找具有类似性质的新配体时也是有价值的。遗传学家制造了大量突变,用各种方法去制备突变库,通过有效的筛选选择所需的突变。同样,“化学遗传学家”合成大量小分子(使用所谓“split-and-pool”合成的策略),用各种方法去合成复杂的、不对称的、类天然产物的分子,通过与产生小分子的split-and-pool方法相匹配的筛选选择所需的配体。我的讲演将集中于我们在实验室中通过使用这些原则来发现类天然产物化合物的新近的工作。
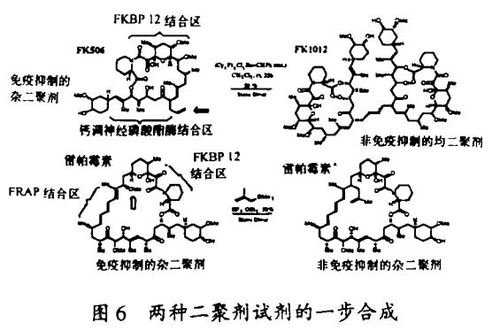
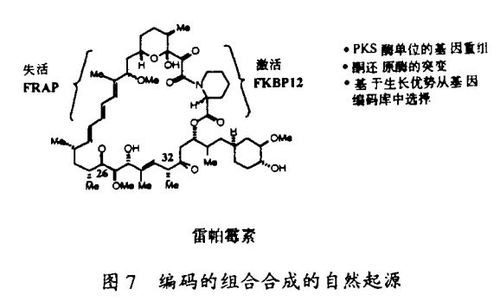
虽然这种发现配体的途径仅在最近在实验室中试验,在自然界却已被广泛地用于产生上述的天然产物配体。例如,细菌遗传学家已经揭示了polyketide合成的完整的轮廓,这种合成产生了像雷帕霉素和FK506这样的polyketide天然产物。这些分子通过一个包括Claisen缩合、酮还原、脱水和烯酮还原的重复顺序而合成。含有完成这些功能的酶单元(enzyme module)的polyketide合成酶编码于单一的细菌操纵子中。通过由基因重组而产生的演化,这些酶单元组序看来已经被混杂了,而这正是split-and-pool合成所要仿效的。其它类型的基因修饰,如酮还原酶单元的突变,进一步增加了天然polyketide库的结构复杂性。最终,自然选择的过程产生了polyketide配体家族现有的成员。它们在现今的细胞生物学研究中的频繁应用导源于作为蛋白质的配体的选择,这是经过了数十亿年的演变的结果。
哈佛大学研究室中的化学遗传学
我的研究领域是由合成有机化学和细胞生物学合并而产生的。在这些研究中,合成了能透过细胞的分子并使用它们来理解和控制细胞周期调节中的信号传导通路。我的研究的部分目的是把化学遗传学扩展为研究所有蛋白质的途径,发现新的能透过细胞的配体。类天然产物物质的split-pool合成和它们的细胞内蛋白质结合性质的微型技术的检定正在哈佛大学化学与化学生物学系Howard Hughes研究所和哈佛医学院的化学和细胞生物学研究所中发展。这个研究是我在京都讲演的主要内容。
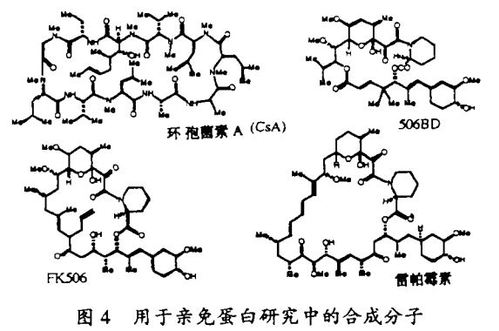
我的研究室在发现新的非天然的类“天然产物”分子的当前兴趣起源于过去的一项工作,这项工作确定了免疫抑制剂环胞菌素A、FK506和雷帕霉素的分子机理。我们研究室的合成化学家完成了3种免疫抑制剂的全合成,并制备了这些试剂,用来和Merck的科学家共同发现了亲免蛋白的FKBP家族,并用功能和结构的术语表征了它们。一种设计的并合成得到的称为506BD的配体被用来表明随着受体结合,这些免疫抑制剂引起被结合的亲免蛋白功能上的增益。这种功能增益的分子基础由于1991年我的一位博士后研究员刘钧(译音)发现FKBP12-FK506和亲环素(cyclophilin)-CsA都能和蛋白磷酸酯酶-钙调神经磷酸酶(Calcineurin)结合并抑制它而得以阐明。这个发现导致另一个发现,即,钙调神经磷酸酶在激活细胞周期休眠T细胞的T细胞受体信号通路中是一个关键分子。
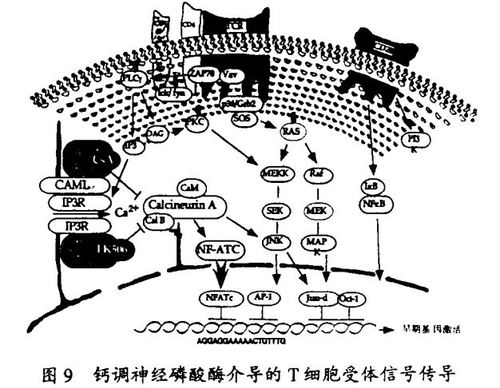
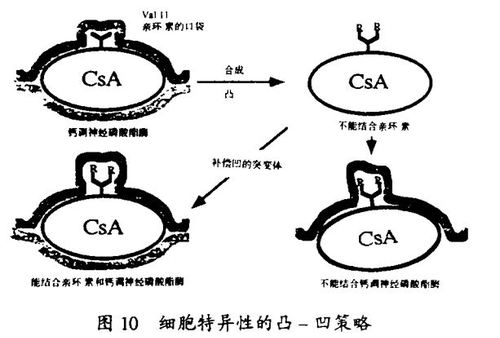
我的一位研究生Peter Belshaw已经证明了一种新的策略,它使CsA和FK506的结构变体在转基因动物中只抑制它的靶组织或靶器官中的钙调神经磷酸酶,因而能够理解钙调神经磷酸酶在这些位置的功能。这一策略涉及用定位诱变和合成化学来创造新的受体-配体对(“凸-凹”, “bumps and holes”) 。
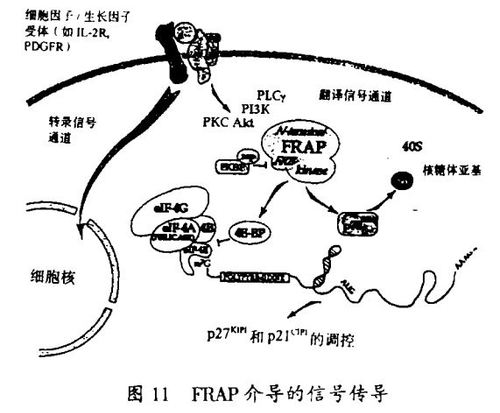
我的另外两位研究生Eric Brown和Mark Albers证明了FKBP-12-雷帕霉素配合物能与细胞周期G1期的一种过去不知道的,现在称为FRAP的调节子结合。应用雷帕霉素作为FRAP的功能丢失温度敏感等位基因的等价物,蛋白质激酶活性被证明对于p70S6激酶的激活是必要的。一种名为FRP1(FRAP相关的蛋白质)的人类关卡同系物也已被发现,本实验室已经开始致力于阐明这个迷人的“PIK有关的激酶”家族的其它成员的功能。
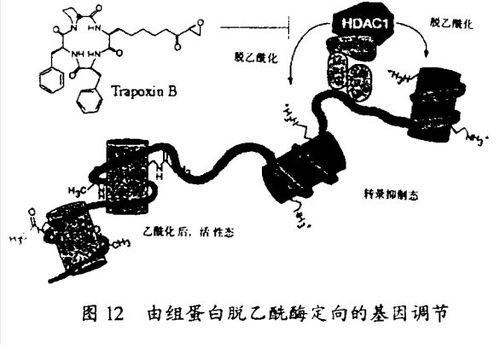
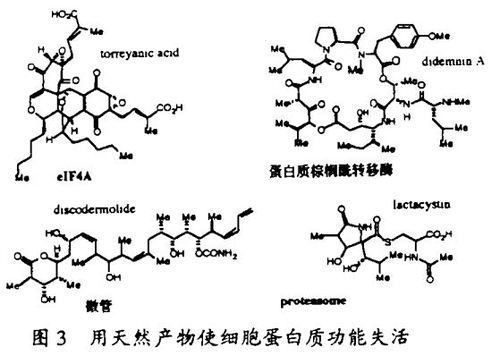
对天然产物敏感的细胞周期信号传递通路的研究已经导致其它新的信号传递蛋白质(如组蛋白脱乙酰酶HDAC1,它是trapoxin的靶子;蛋白质棕榈醜转移酶,它是didemnin的靶子)的发现,鉴定了多种已知信号传递蛋白质(微管蛋白,它是discodennolide的靶子;proteasome,它是lactacystin的靶子)的有价值的探针,并揭示了这个途径具有广泛的普遍性。trapoxin的例子提供了合成化学在这些研究中的重要性的一个说明。由我的研究生Jack Tauton完成的trapoxin的全合成方法可用于它的氚标记的类似物的合成,更重要的是,可用于它的固定化的类似物的合成,后者用作亲和试剂导致了人类组蛋白脱乙酰酶-1(HDAC1)的发现。这个过去未知的蛋白质在转录激活和染色质重建这两个活跃的研究领域之间提供了一个关键的联系。我的研究生Christian Hassig最近的工作证明了,细胞中基因调节是由HDAC1通过一种DNA-蛋白质配合物导向到特定的基因而发生的。在Allfrey第一次证明其存在于细胞核粗提物后的30多年里,组蛋白脱乙酰酶的分子表征一直未能实现。本实验室的成功说明了合成有机化学如何用来解决细胞生物学的问题。
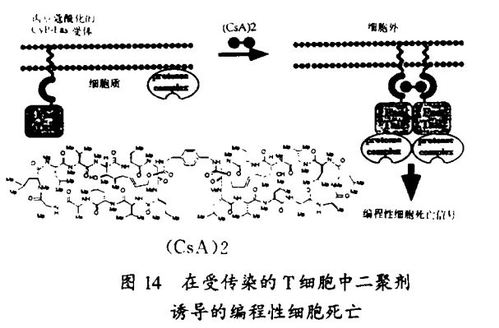
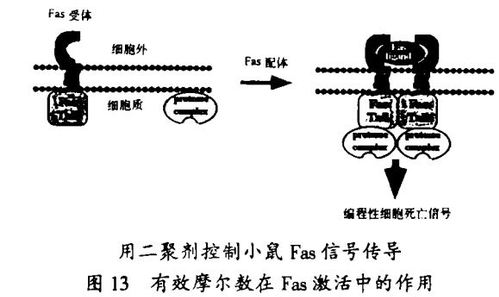
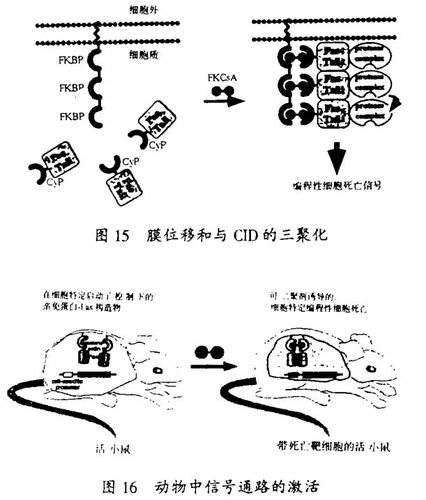
我们实验室的研究也说明了,用于信号传导的化学方法也可用来控制信号传递通路。可与配体诱导的蛋白质的变构作用相匹敌的,关于配体诱导的蛋白质的二聚化和寡聚化构成了启动信息传递的一般方法的认识成为我们一个关键的见解。和斯坦福大学HowaMHughes医学研究所的Crabtree博士合作,我们设计了一种能够进行蛋白质与可透过细胞的、哑铃状的合成配体的细胞内受控二聚化和寡聚化反应的方法。激发这种设计的灵感来自免疫抑制的天然产物,这些分子也有两个蛋白质结合面。在哈佛-斯坦福协作组,这个方法已于包括T细胞、PDGF(血小板衍生生长因子)、胰岛素、TGFb(转化生长因子b)、EPO(红细胞生成素)和Fas受体的增殖和死亡通路的激活,用来调节转录、蛋白质转位和蛋白质降解。用这一方法,我们在1996年证明了,在表达合理设计的Fas受体条件等位基因的转基因小鼠中,合成的二聚剂能够切除CD4/CD8双阳性胸腺细胞。在京都讲演中,我将谈一下这个特例。这个工作首次说明应用小分子在一种动物中实现了对特定的信号传递通路的时空控制。配体调节的细胞通路的激活与终止说明了蛋白质的近位与取向在生物学中的重要性,并为生物学和医学研究提供了新的机会。
现在正在开发各种技术以发现作用于任何靶蛋白质的配体,因而能够制备直接抑制剂和二聚的激活剂。在早期的研究中,已经合成了数以百万计的潜在的配体,最后选择了少数几个能与感兴趣的SH3结构域结合的。我的两位研究生冯思波(译音)和余洪涛(译音)用多维NMR测定了各种配合物的结构,甚至是以相反的取向与肽配体结合物的配合物的结构。通过比较不同配合物的结构,SH3的结合优先性的原因就淸楚了,在这个三步法中得到的结构信息已被用于设计具有高度选择性的能透过细胞的非肽配体库。这些努力产生了SH3蛋白的第一批非肽配体。在最近的研究中,我们将配体应用于遗传学来发现突变作用之后,我们实验室正在采用相同方法来努力发现配体。运用现代不对称合成方法对于复杂的类天然产物分T的split-pool合成正在发展。用于大规模测试这些配体的结合性质和细胞特性的技术,包括大集合的合成分子对巨集合的蛋白质(例如,编码在人cDNA库的全部蛋白质)的同时筛选的技术正在发展。最后这项工作为合成化学家发现他们用于探索生物学的独特的分子提供了蓝图。
哈佛化学和细胞生物学研究所
合成有机化学、分子细胞生物学和小型化科学的最近发展使得开发用于许多重要的蛋白质和细胞过程的专一的、可透过细胞的抑制剂或激活剂成为可能。这样的配体是极有价值的基础研究工具,其中一些也可能成为设计新治疗药物的起点。这一领域的进展有赖于化学家和分子细胞生物学家的密切合作,也有赖于把学术研究实验室和制药工业用来解决问题的各种方法的力量结合起来。为了达到这些目的,我们创建了一个新的研究所,即哈佛化学和细胞生物学研究所(ICCB)这个研究所的奠基人包括我的同事Eric Jacobsen,Gregory Verdine和Matthew Shair。ICCB的任务就是发展出用有机小分子来理解和控制蛋白质的细胞功能的通用方法。ICCB把几种概念包含在一起,这些概念对于我们的努力能否成功是至关重要的:在ICCB,化学家和细胞生物学家肩并肩地工作,研究室由一个教授小组来监管,这些教授的专业覆盖了从现代不对称合成化学到基础细胞生物学的各个学科;与政府和制药工业的新型合作为ICCB的专业知识和基金提供了来源。哈佛大学的医学院和文理学院对于这个规划的成功都承担了义务并对它的创建作出了贡献。ICCB占地12000平方英尺,其建筑物正在翻新。它将支持50名研究人员,包括研究生、博士后和固定的研究人员、我在京都的讲演基本上集中在:今成化学,我们正在发展它,以便制备多种多样的类天然产物的物质;分子生物学,我们正在用它来构建各种细胞,用作小分子-蛋白质结合的传感器:小型化技术,我们正在开发它,以便能在短时间内完成大量的测试。
小 结
上述各种努力都是为了达到一个目的:发展一种化学的途径去理解和控制蛋白质的细胞功能。将来,在细胞、组织、器官乃至动物体中,配体控制蛋白质功能的能力将使得化学、生物学和医学之间的联系更加直接。在我的讲演中,我想传达两个基本信息:
1.为了探索蛋白质的细胞功能,小分子有机化合物(配体)能用来模拟突变作用。它们可用于激活与之结合的蛋白质的功能,也可用于失活与之结合的蛋白质的功能。
2.在以往10年中,用于化学遗传学研究的配体或者是天然产物,或者是天然产物的合成的变种。现在已出现各种技术,使得合成化学家能够在他们自己的实验室中合成和选择类天然产物的化合物。如果这一目的能够实现,化学遗传学将获得与经典遗传学相似的广泛的普遍性。
————————
译注:本文作者S. L. Schreiber博士是美国哈佛大学化学和化学生物学系教授,新学科“化学生物学”的创建人。本文是他于1997年11月在日本京都“有机化学新领域第七届京都国际讨论会”上的大会报告。原文由中国科学院上海有机化学研究所吴毓林研究员推荐并提供。吴教授参加了这次京都会议。