发现与阿尔茨海默氏症有关的基因可以帮助研究人员了解是什么原因导致这种疾病,但是要找到这种基因并非易事。

超过90%的阿尔茨海默氏症通常出现在65岁以上的老年人群体中
与阿尔茨海默氏症有关的基因频频被发现,人们也许会认为,科学家肯定很快就能绘制出导致这种疾病遗传学基础的完整基因图谱。由于家族性遗传的早发性阿尔茨海默氏症患者通常在中年后期产生出的一些症状,其大部分原因与三种基因有关:APP、PSEN1和PSEN2,这三种基因在产生β淀粉样蛋白中各自都起着重要的作用。因此人们普遍认为,β淀粉样蛋白的大量堆积是引发这种神经退行性疾病的主要原因。
然而,阿尔茨海默氏症超过90%的病例是以迟发性形式出现的,通常为65岁以上的老年人,而且似乎有着不同的遗传风险因子。尽管确认与β淀粉样蛋白产生和积累有关并导致阿尔茨海默氏症的至少十几种候选风险因子的研究已经取得了一些成绩,但目前对其各自所起的作用仍不清楚,这些基因也无法说明约占60~80%的迟发性阿尔茨海默氏症病的遗传风险。
其中一个基因编码载脂蛋白E(APOE)的常见变异被认为在引发阿尔茨海默氏症中起着重要的作用。仅这个变异的称为APOE4的一种副本,就使阿尔茨海默氏症的患病风险增加了4倍;两种副本,就会令患病风险提高约十倍。“如果你想要预测患阿尔茨海默氏症的可能性,APOE基因的影响可能相当于其余所有相关基因加起来的总和,”总部设在美国的阿尔茨海默氏症遗传学协会负责人杰拉德·舍伦贝格(Gerard Schellenberg)说道。
随着全基因组关联分析(Genome-wide Association Study,GWAS)的兴起,这类基因的发现和研究正在呈上升势头。研究人员为此对数以百万计的单核苷酸多态位点(SNPs)进行了分析,即分散于整个基因组的变异,成千上万的这种变异对健康的人体产生着各种影响。通过寻找与疾病相关的基因变化,他们就有可能发现候选基因或有害的基因突变。
运用统计数字的力量
目前,对阿尔茨海默氏症进行分析的GWAS的研究论文已发表了十多篇,其中大部分出自于欧美国家。其中一些研究发现,常被人斥为的假阳性关联,不能推广复制于其他研究中,对阿尔茨海默氏症的早期研究也不例外。但在之后的大规模调查研究中,对许多人的基因组的单核苷酸多态位点进行了更大量的分析,统计数字的力量使得科学家确认了与增加风险有关的十多种基因变异。
通过一些独立研究小组的验证和综合分析,这一研究结果获得了进一步的支持。综合分析是指对多个研究成果进行综合性核查,并对其统计学上的数据作出评估。舍伦贝格说:“当人们对GWAS提出批评指责时,最好的回答就是,当我们进行一个大型而完全独立的研究时,我们所得到结果也是相同的。”在2009年的一次会议上,欧盟神经退行性疾病联合规划(JPND)主席菲利普·阿莫耶尔(Philippe Amouyel)回忆道:“我们已经找到完全相同的基因,这非常重要。因为它强调了这一事实,这些基因的出现并非统计学上的偏差。”
候选基因在生物学上也有其意义,因为它们大多数都与炎症损伤及代谢中断有关。很久以来,科学家们一直认为炎症损伤和代谢中断与阿尔茨海默氏症有所关联。“许多基因似乎都与类脂物代谢作用和免疫反应有关,”纽约哥伦比亚大学阿尔茨海默氏症和衰老大脑研究所所长理查德·梅耶克斯(Richard Mayeux)说,“在某种意义上来说,这是可以预测的。但至今为止,我们没有足够的数据资料来支持这一观点。”重要的是,许多基因也与β淀粉样蛋白产生交互作用,后者仍普遍被视为阿尔茨海默氏症的触发因素。
但是,这些新发现的基因并不能解决关于阿尔茨海默氏症起源的辩论。如果说它们有什么重要意义的话,就是为阿尔茨海默氏症的发病机制的许多不同模式都潜在地提供了某种支持。比利时安特卫普大学分子遗传学家克里斯廷·凡-布洛克霍文(Christine Van Broeckhoven)说:“认为阿尔茨海默氏症与β淀粉样蛋白无关的人会说,遗传基因证实了他们的观点;而认为阿尔茨海默氏症与β淀粉样蛋白有关的人则会说,看,正如我们所说的那样。”
APOE基因之“运输卡车”
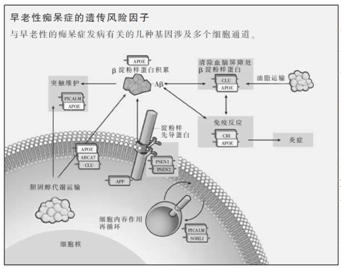
几种候选基因所起的作用错综复杂。例如,基因编码为CLU的clusterin基因,是与阿尔茨海默氏症相关性很强的新发现的风险因子之一,被认为涉及到β淀粉样蛋白的聚集和清除――它也被称为载脂蛋白J。众所周知的是,CLU能帮助APOE基因促进胆固醇在中枢神经系统中的传递。另一个风险因子Ⅰ型补体受体(CR1),是抗感染先天免疫反应的一个重要组成部分,但也与β淀粉样蛋白的清除有关。然而一旦CLU和CR1这类基因产生变异,就会增加约15%的发病风险。
APOE基因究竟如何有可能导致阿尔茨海默氏症仍然是一个有争议的话题。它被认为有助于消除大脑中β淀粉样蛋白,同时也是胆固醇和其他脂质和脂溶性分子进入中枢神经系统的主要传递者,虽然目前其机制尚不清楚。APOE基因主要有三个变种,其中由高风险APOE4变异基因产生的蛋白是最不稳定的,它严重地阻碍了胆固醇和β淀粉样蛋白在大脑中的运动;而APOE2大量编码产生的一种蛋白,相对于普通的APOE3等位基因,它实际上为抵抗阿尔茨海默氏症提供了保护作用。
华盛顿大学神经病理学主任托马斯·蒙蒂尼(Thomas Montine)指出,APOE基因同时也对大脑细胞损伤的炎症反应进行调节。这种反应是由人体先天免疫系统居中调停的,可因β淀粉样蛋白诱导细胞死亡触发,但也有可能是对中风等其他神经损伤作出的反应。在上述两种情况下,长期的炎症反应可能会导致有毒化学物质副产品的逐步积累,进一步加速神经细胞的死亡。其他神经退行性疾病,如帕金森氏症也会出现类似的损害。阿莫耶尔说:“几乎所有的假设都涉及到APOE4基因。”
一些研究人员认为,APOE基因在胆固醇传输中所起作用是其在阿尔茨海默氏症发病机理中至为重要之关键。加拿大麦吉尔大学神经生物学家朱迪斯·普瓦里埃(Judes Poirier)说:“大脑中有着体内胆固醇含量的25%,虽然它只占体重的2%。”大脑的可塑性能力取决其能够建立和稳定新的突触连接,缺少APOE基因或有APOE4变异基因表达的小鼠在突触神经损伤的修复上就会出现很大的问题。普瓦里埃接着说:“当你需要脂质来维持或恢复神经可塑性时,APOE基因就是最终的运输卡车。”
他汀类药物能否延缓或阻止与阿尔茨海默氏症相关的认知能力的下降?
具有多重作用的基因
有证据表明,其他一些与胆固醇有关的基因变异,同时也增加了阿尔茨海默氏症的患病风险。在此过程中,这些证据还表明了APOE基因所起到的关键作用。其中有一个PICALM基因,它编码产生的一种蛋白质帮助脂质传输;另一个称做ABCA7的基因也参与了胆固醇的运输。普瓦里埃说:“我们现在讨论的六、七种新发现的具有很强复制能力的基因因子,都与大脑中的脂质动态平衡有所关联。”
有迹象表明,APOE基因似乎还是阿尔茨海默氏症和其他生理功能紊乱之间的桥梁。“心脑血管疾病和糖尿病之间有着很强的关联,很多研究都显示了这种关联,”梅耶克斯说,“但问题是,单是中风或糖尿病并不一定会引发阿尔茨海默氏症。”然而,那些携带APOE4基因并同时患有糖尿病的人,最终患上阿尔茨海默氏症的几率是携带有这种变异基因的非糖尿病患者的两倍。
关于APOE4基因的另一个谜题是其与心脏病发作和中风高风险之间的联系。舍伦贝格说:“这一点本身就应该能告诉我们,它在这方面所起的作用是脂质代谢,而不是与β淀粉样蛋白的相互作用。”有证据表明,服用降低胆固醇水平的他汀类药物,有可能延缓或阻止与阿尔茨海默氏症相关的认知能力的下降。虽然使用他汀类药物的临床实验至今尚未得到确定性的结论。若是阿尔茨海默氏症患者的胆固醇调节基因产生了突变,那么他汀类药物能成为一种治疗手段吗?Text Box:现有的数据还不能令人满意地将这些线索连接在一起,但正在进行的几个雄心勃勃的项目计划也许有助于这方面的研究。例如,四个最大的阿尔茨海默氏症GWAS研究团体正在联手开展一个“国际阿尔茨海默氏症全基因组学计划”大型项目,该项目将提取40000人的相关数据资料,包括阿尔茨海默氏症患者和未患此种疾病的对照组,尝试进行一场“超大型的数据分析”,深入探研之前有可能被忽略的一些危险因子。“我们正在对1000万个以上的SNPs进行研究,”阿莫耶尔说,“这足以非常密集地覆盖整个基因组图谱。”
该项目的另一个目标是确定与特定基因相关的病理特征,但在不同人群中收集和储存样品的差异可能导致实现这一目标变得相当复杂。凡-布洛克霍文指出,许多GWAS研究团队无法获得详细的病史,也无法收集患者死后的身体组织,导致在研究开始之前就已经失去了许多珍贵的数据资料。“根据我们如今所了解到的,我们不得不说,在取样过程中,我们已经错失了许多机会。”
重点探索外显子组
由于GWAS研究受到基因组内已知SNPs分布的限制,一些未知的空白有可能会掩盖疾病的风险影响,包括面对罕见变异基因在统计学上所需大量数据的挑战,这些研究通常会忽略发生在据估计不到5%的人口中的SNPs变化。
然而,随着DNA测序成本下降和测序速度的提高,科学家们对整个基因组的梳理也变得更为容易,舍伦贝格和他的同事正计划使用这种方法来填补空白。为了节省时间和资金,他的研究团队将重点放在外显子组,即基因组中包含了所有基因表达的一个子集,以寻找有因果关系的突变基因。舍伦贝格说:“与其对100个基因组进行测序,不如对2000个外显子组进行测序。因为你要寻找一些罕见的基因,就需要在更大范围的样本中进行搜寻。”
但一些研究人员仍然在沿用一些传统的寻找基因的方法,即对假设与阿尔茨海默氏症有所关联的一些因子进行确认。例如,梅耶克斯研究小组已在SORL1基因中确定了好几个与疾病有关的SNPs。他说:“很多人对此持怀疑态度,因为它是一种候选基因,但在最近的一些GWAS研究中获得了支持。”相关证据也支持了SORL1的作用――在蛋白质产生水平较低的小鼠中,其大脑中积聚的β淀粉样蛋白也更多。
蒙蒂尼研究小组在血液或脑脊液(CFS)中寻找可能预示老年痴呆症发病的生理指标时,发现了另一个候选因子,即脑源性神经营养因子与其他多种神经系统疾病有关,而这种蛋白质水平被证明是预测阿尔茨海默氏症的一种强有力的指标。然而,关于这种基因变异的致病作用还没有明确的证据。蒙蒂尼说:“在我们的观察中还找不到这其中的联系,但我们也还没有对这整个基因进行测序。”
有待实验科学家阐明机制
阿尔茨海默氏症风险的最后一个组成部分,可能源自于遗传易感性与一生中积累起来的生理损害之间的相互作用。蒙蒂尼说:“对于一种与老龄化密切相关的疾病来说,我们的生活环境和我们的人生经历,都将成为重要的影响因素。”
例如,糖尿病和中风可导致生产高活性的化合物,这种被称为自由基的化合物反过来对脂肪、蛋白质和核酸诱导产生一些有毒的化学变化,这种氧化应激现象似乎是阿尔茨海默氏症患者大脑中的一种普遍特征,其结果是有可能损害或杀死神经元。蒙蒂尼说:“这是人体老化的一个正常组成部分,但对于阿尔茨海默氏症患者来说,自由基会给他们造成更严重的损害。”作为细胞能量之源的线粒体,通常对氧化应激起着调控作用,几项研究正在对此作出评估,以确定线粒体DNA是否也包含了阿尔茨海默氏症的危险因子。
在了解环境因素对疾病的影响方面,遗传学家面临着同样巨大的挑战。首先是数据的获得和分析,然后还要构建出对诊断和治疗有意义的理论假设,这些都费时费力且代价高昂。“遗传学有可能定义某种相关性,但却无法确定其机制,”蒙蒂尼说,“现在是需要实验科学家去努力弄明白这类机制的时候了。”
资料来源 Nature
责任编辑 则 鸣
――――――――
本文作者迈克尔·爱森斯坦(Michael Eisenstein),美国宾夕法尼亚州费城一科学作家。
?生物百科?
全基因组关联分析(GWAS)

全基因组关联分析(Genome-wide Association Study,GWAS)是一种对全基因组范围内的常见遗传变异(单核苷酸多态性和拷贝数)基因总体关联分析的方法――在全基因组范围内进行整体研究,能够一次性对疾病进行轮廓性概览,适用于复杂疾病的研究。在全基因组层面上,开展多中心、大样本、反复验证的基因与疾病的关联研究,可以全面揭示疾病发生、发展与治疗相关的遗传基因。
进行GWAS的前提是:基因组测序工作的完成、基于序列变异-SNP单体型图谱构建和高通量基因分型技术的迅猛发展。
优势:1.高通量――一次可以监测成百上千个SNPs;2.不只局限于“候选基因”,基因可以是“未知”的;3.GWAS研究不再需要在研究之前构建任何假设。
GWAS为全面系统研究复杂疾病的遗传因素掀开了新的一页,为我们了解人类复杂疾病的发病机制提供了更多的线索。目前,科学家已经在阿尔茨海默氏症、乳腺癌、糖尿病、冠心病、肺癌、前列腺癌、肥胖、胃癌等一系列复杂疾病中进行了GWAS并找到疾病相关的易感基因。
由于形状与基因组之间的关系受很多种因素的作用,因此,目前GWAS面临着一些问题,如获得的结果似是而非,不能完全解释某些病因等等。但作为一种趋势,随着表观遗传图谱、蛋白表达谱以及生理学等学科综合推进,作为一种综合性的分析方法,GWAS必将迎来一个更广阔的发展空间。



