如果三个人中有一个人得了癌症,就说明其他两个人没有得癌症。理解这其中的原因对预防和治疗癌症会带来启示。

癌症是人类的灾难,而且随着人类寿命的延长,将会影响越来越多的人。大约三分之一的人在其一生中会罹患肿瘤性疾病,但是反过来说,还有三分之二的人不受癌症影响。即使是大多数重度吸烟者,其肺部长年累月吸入致癌物和促癌物,仍然不会得癌症。自然而然,癌症患者及其家人的痛苦激发了研究者去研究癌症特有的细胞变化和癌症易感性的遗传学。抗癌性的遗传学这个课题本身,基本上还未被探索。
病理学家已经表明,实际上所有60岁及以上的人在验尸检查时都会发现微观的前列腺癌,但是,这些微肿瘤大多数都不会发展成癌症。大家知道,扩散的癌细胞会遍布大部分癌症患者的全身,但是只有小部分这样的癌细胞会发展成继发性肿瘤,其余癌细胞都会被身体控制住。
确实,后生动物进化已经导致了很多调适,以保护整个动物王国的物种免受恶意细胞的侵害。免疫监视在防御病毒相关肿瘤方面发挥着重大作用,病毒编码的转化蛋白提供了易于识别的外来标靶。但是由异常的宿主细胞构成的非病毒性肿瘤并不会提供这样的外来标靶,免疫应答被针对自身免疫反应的防御抑制了。反而,我们现在知道了抗击癌症的主要防护措施根本不是免疫学措施。
若干种抗癌机制似乎已经演变为维持细胞或基因组的完整性。例如,正常的基质――支持一个组织的细胞的连接物质,似乎会抑制肿瘤生长。其他抗癌机制包括DNA修复、抑制致癌基因活化、肿瘤抑制基因、染色质结构的表观遗传稳定化以及细胞凋亡。这些机制都得到了深入研究,每一种机制都为癌症的预防和治疗提供了一种可能的路径。
遗传监督
异常的细胞分裂是肿瘤细胞的标志,负责这种细胞异常增殖的突变基因就被称为癌基因或致癌基因,但这其实是用词不当。它们的正常功能不是导致癌症,而是参与正常细胞分裂的调控。同时,命名得更合适的肿瘤抑制基因识别了这种增殖驱动基因的非法活化,从而踩下刹车加以抑制,破坏这种功能的基因突变又会再次导致癌症。
罹患肿瘤的风险也可能受到那些控制DNA复制的忠实性、DNA修复功效的基因以及涉及DNA合成和染色体结构的检查点调控的突变的影响。例如,着色性干皮病源于一种特定的DNA修复缺陷。这种病症最主要的形式是由核苷酸切除修复系统的一种基本成分的隐性突变引起的,核苷酸切除修复系统的主要功能是切除因皮肤上皮暴露于紫外线而引起的分子DNA损伤。着色性干皮病患者必须终生保护自己免受阳光照射,但是他们仍然还是会罹患多种皮肤癌,而且大约三分之一的患者同时还会发生进行性神经系统异常。这突出了DNA修复作为一种前线监督机制的至关重要性。
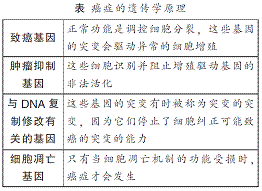
但是另一组与癌症形成有关的基因调控着程序性细胞死亡或凋亡。这些基因表达的蛋白质的正常功能是识别那些必须被消除的多余、损坏、老化或异常的细胞。细胞凋亡的重要性可以由脊椎动物的适应性免疫系统来举例说明,其中的B淋巴细胞,因为它们是从它们的前体细胞分化而来的,重新排列了免疫球蛋白基因的DNA,以产生潜在的大量抗体。如果一个抗体碰巧识别出体内的一个抗原,产生它的B细胞会受刺激而克隆性地扩张。但是,那些产物不绑定相应抗原的B淋巴细胞则必须死,以避免堵塞系统。搅乱组织完整性的潜在的癌细胞也会诱发启动细胞凋亡的信号。只有当凋亡机制功能受损时,癌症才会发生。
那些通过突变、非法活化,或是相反地,失活或减损而导致癌症发生的基因,在所有哺乳动物中几乎是相同的。许多这样的基因甚至在血缘关系遥远的种群中得到保留,比如果蝇、线虫和酵母。而且,这些癌症相关基因在不同物种中发生突变的频率相似。因此,我们本来可以预计,拥有1017个细胞的蓝鲸比只有109个细胞的老鼠或是只有1013个细胞的人类得癌症的频率要高。然而,事实并非如此。实际上蓝鲸极少得癌症,即使真的得癌症,似乎也能够安然度过一个完整的生命周期。事实是肿瘤发生的频率并不随着组成一个动物的细胞总数的增加而增加,这表明某种系统控制正在预防癌症发生。即使典型的实验室动物在癌症易感性上也是各不相同的。小鼠、大鼠和仓鼠相对容易得癌症,而兔和豚鼠抗癌性相对较强。在癌症频谱的远端,两个鼹鼠物种已被发现是完全不会得癌症,尽管它们寿命相对较长。
在抗癌性方面,人类之中会有遗传学差异吗?这一点没有证据,但是很有可能存在。在家族谱系图保存完好的冰岛家族,有若干这样的例子:六个或更多长寿的兄弟姐妹没有得癌症,而且他们的父母没有死于癌症。但是,我们不可能把遗传性抗癌家族的存在与纯属偶然的无癌家族的出现区别开来。
有趣的是,人类肿瘤发病率随着年龄的急剧上升之后,会在80-85岁迎来肿瘤发病率的下降。百岁老人极少会得新的癌症。最有可能的原因是群体中的癌症易感个体已经死掉。免于癌症可能是活到高龄的一个必要的但其本身并不充分的先决条件。
患有一种称为“拉龙综合症”的侏儒症的人代表了抗癌性人类的另一个有记载的例子。在近亲结婚频繁的厄瓜多尔人口中发现的拉龙综合症患者的骨骼、软骨或关节发育都没有问题,而且与其他侏儒相比,具有非常高水平的生长激素。但是,他们的细胞缺乏使生长激素发挥功能活性所需的一种受体。生长激素受体基因的一种不常见的突变似乎是这个案例中的抗癌性的原因。
似乎有多种机制能防御癌症。除了驱使癌细胞增殖、突变或表观遗传学变化可能会影响细胞入侵相邻组织的能力,从而引起全身转移或抗拒治疗。值得注意的是,利于转移的突变可发生在肿瘤发展的非常早期的阶段,远远早于有足够数量的肿瘤细胞从而表现出癌症属性之前。
相邻抑制

相邻细胞如何对抗癌症:抵制恶性细胞在体内的过度增殖涉及癌症相关基因之间的复杂的相互影响,微环境,以及组织建立正常结构的倾向。在身体的防御机制中有一种现象叫做接触抑制或相邻抑制,指的是当细胞感知到其密度达到一个临界值时会停止生长
20世纪60年代,英国癌症生物学家迈克尔·斯托克(Michael Stoker)观察到一个意想不到的现象:当他把一定数量的肿瘤细胞移植到盛有适量营养物的培养皿中时,他获得了大约100个很小的正在生长中的肿瘤细胞集群。但是当他把相同数量的肿瘤细胞跟正常的成纤维细胞混合时,正在生长的肿瘤细胞集群的数量减少了99%。似乎正常的相邻细胞抑制了肿瘤细胞复制的能力,这种现象后来被称为接触抑制或相邻抑制。
黏着连接是存在于上皮和内皮组织中细胞与细胞之间的接触点的蛋白质复合物,似乎在这一现象中发挥重要作用。E-钙粘蛋白是在这些连接处的重要黏附介质,在大多数上皮性肿瘤中会被下调,通常是通过基因的启动子区的甲基化。E-钙粘蛋白的再表达似乎会抑制孤立的癌细胞中的转化表型,而阻断E-钙粘蛋白的功能则会增强癌细胞的入侵。
细胞膜的其他结构成分可以类似地参与到肿瘤生长的微环境抑制。β-整合素是介导细胞与细胞外基质(ECM)以及细胞之间相互连接的跨膜受体的亚单元,也在组织构成中发挥关键的信号转导作用,而且经常被肿瘤细胞异常表达。用抗体标靶肿瘤相关的β-整合素可以抑制肿瘤生长。Notch信号通路中调节细胞分化和增殖的成分,是另外一个例子。Notch受体或它们来自小鼠表皮基底层的配体的缺失,可导致表皮增生和皮肤肿瘤。
几年前,我们用绿色荧光蛋白标记人类前列腺癌细胞,并对与不同组织的正常成纤维细胞相邻的细胞进行电镀,重新研究了相邻抑制在抗癌性中的作用。皮肤中的成纤维细胞对肿瘤生长有强烈的抑制作用。当肿瘤细胞没有被杀死而持续大量生长并制造蛋白质时,它们不会分裂。另一方面,从发生癌变的前列腺中提取的成纤维细胞几乎不抑制细胞增殖。事实上,这些所谓的癌症相关成纤维细胞(CAFs)可能甚至会支持相邻的肿瘤细胞的生长和存活。更严密地观察这些成纤维细胞中的基因表达,我们鉴定出通过炎症或创伤愈合而被活化的基因,这一发现与一个既定事实一致:炎症有利于往往是长期处于非活化状态的肿瘤细胞的生长。
重置癌症
另一种抗癌机制于20世纪70年代被美国生物学家比阿特丽斯·明茨(Beatrice Mintz)发现。在研究一种高度恶性的畸胎瘤细胞的过程中,明茨发现皮下接种该细胞的成年小鼠全部死于畸胎瘤。但是,当畸胎瘤细胞被导入非常早期的胚胎时,并不会发展成恶性肿瘤。导入的细胞只是成为组织的一部分,参与到小鼠的正常发育,并对胚胎的很多组织做出贡献。正常化的肿瘤细胞甚至有助于受体小鼠的精子生产。
在早期发育环境中的胚胎肿瘤细胞的正常化是恶性细胞分化成正常细胞的极端例子。在后来的研究文献中,还有很多其他没这么惊人的例子。高度恶性鼠白血病细胞可被天然或人造物质诱导分化成非恶性细胞。人类白血病的一种――急性早幼粒细胞白血病(APL)常规的治疗方法是:一种天然存在的信号受体与凭经验确定的化合物――染料木黄酮的组合,会诱导癌变细胞从粒性白血球前体分化成不能再分裂的成熟中幼粒细胞。尽管类似的例子仍然相对稀少,它们表明了大多数也许所有肿瘤都可以被诱导进行分化并停止生长,如果科学家能找到诱导物的合适组合。
生物进化给我们人类和其他动物提供了阻止正常细胞进行失控分裂的多重机制。如果正常细胞还是逃脱了控制,细胞会发动多重机制来阻止恶意细胞,并保护正常的组织结构。这些机制能把威胁生命的恶性细胞生长消灭在萌芽状态。只有在正常组织的周围已经被肿瘤细胞败坏之后,细胞才不能阻止而是刺激恶性细胞生长,肿瘤才能肆无忌惮地横行霸道。
资料来源 The Scientist
责任编辑 彦 隐
――――――――
本文作者乔治·克莱恩(George Klein),在瑞典卡罗琳学院的微生物学、肿瘤与细胞生物学系研究爱泼斯坦-巴尔病毒,致癌基因和肿瘤抑制基因。
无癌的生命

盲鼹鼠 裸鼹鼠
有两种鼹鼠是抗癌性的特例。盲鼹鼠(BMR)和裸鼹鼠(NMR)能分别活到20和30岁而从来不会得癌症。理解赋予这些动物如此强大的防御癌症的分子机制,能为抗击人类癌症带来启示。
裸鼹鼠是一个完全社会性的物种,生活在高度组织化的母系氏族社会,必须在狭窄而且经常蜿蜒曲折的地下隧道中前进。其皮肤的结缔组织包含透明质酸的高分子量形式(HA),HA可使动物的皮肤延展性如模型粘土。小鼠和人类体内对应的HA的分子量只有裸鼹鼠HA的不到五分之一。存在于裸鼹鼠体内的高分子量形式的HA阻止了正常细胞转化成癌细胞;只有消除它,裸鼹鼠的细胞才能转化成癌细胞。
而且,裸鼹鼠的成纤维细胞抑制了接触抑制的一种非常形式。小鼠和人类成纤维细胞在撞上其他细胞时,会抑制它们自身的继续增殖。裸鼹鼠的成纤维细胞会更早地这么做,当细胞几乎没有相互触碰时。当细胞发生接触时,一种涉及导致生长停滞的蛋白质――p16蛋白被上调了。在小鼠和人类成纤维细胞的后期接触抑制中看不到p16蛋白,而是另一种生长停滞蛋白质――p27蛋白被上调了。
与裸鼹鼠相比,盲鼹鼠是一种孤独的、非社会性的、具有侵略性的物种,其抗癌机制与裸鼹鼠并不相同。盲鼹鼠没有高分子量形式的HA或早期接触抑制,但是当它的成纤维细胞生长到汇合时,会通过释放一种干扰素进行集体自杀。生物进化似乎再一次制定了控制恶性细胞的多样化的解决方案,而在这两种无癌的物种中,那些机制也许是它们惊人长寿的关键。



