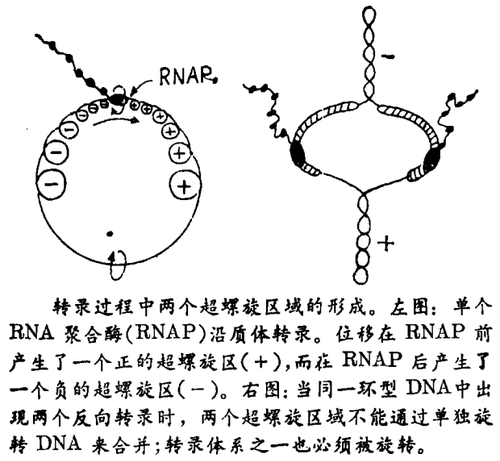
当你走到窗前,顺时针方向旋转拉窗帘的双股绳子,使长到足以获得一个双螺旋,然后在两股绳子之间插入一支笔,并向前推动笔而不旋转,你这就是在制作一个转录过程的机械模型:笔或者RNA聚合酶沿着DNA(即相互卷曲的双链)移动。从此实验中可以看到,当RNA聚合酶移位时,将会使它前面的DNA卷得过紧,而后面的DNA不足卷曲。换句话说,DNA在RNA聚合酶前成为正的超卷曲,而在后成为负的超卷曲(见图)。虽然是DNA螺旋结构的必然结果,但这个随RNA聚合酶移动的超螺旋波似乎是幻想的,然而,王 · J. C. 及其合作者最近所做的漂亮实验证实了这些超螺旋波实际上在原核和真核细胞中都存在。这些数据将无疑会改变对DNA超螺旋的学意义及DNA拓扑学重要性的一般态度。
继续用绳子和笔作实验,笔很快就会停下来,因为双股绳不能卷得再紧了。这样,我们必须假设,或者DNA和RNA聚合酶相互绕着旋转,或者细胞能够消除正的和负的超螺旋。我们几乎不能预料到一个很长的DNA分子与一个在原核细胞中载有甚至更庞大的转录机器的很庞大的转录机器能够相互绕着旋转。另一方面,已知拓扑异构酶能够改变DNA超螺旋。基于这些简单的原因,刘和王提出了超螺旋波的概念。但是如何测量超螺旋波呢?从细胞中提取DNA,脱去了蛋白质,使波的记忆失去,因为超螺旋波没有改变整个DNA联接数目。虽然王及其合作者没有直接观察到体内的超螺旋波,但在涉及到不同DNA拓扑异构酶抑制的实验中他们明确地证实了它的存在。他们的最引人注目的证据是,当DNA解旋酶受抑制时,大肠杆菌中正的超卷曲质体DNA的形成。在此情况下,拓扑异构酶Ⅰ不断地消除负的超螺旋,同时在DNA中积累正的超螺旋,正的超螺旋通常可通过DNA解旋酶来消除。
与原核细胞的情况大不相同的是,人们不能选择性地切断真核细胞中使正和负的超螺旋松弛的拓扑异构酶的活性。吉维尔和王通过使用由质体表达的大肠杆菌DNA拓扑异构酶;转变的酵母温敏(ts)菌株克服了这个困难。这种酶能使负的超螺旋松弛,但不能使正的超螺旋松弛。与模型完全符合的是,从在酵母内源拓扑异构酶失去活性时的那种非许可温度下生长的细胞中提取的内源质体转变成了重要的正超螺旋。
这些发现对于DNA超螺旋的生物学意义提出了完全新的见解。尤其是,人们曾经认为,大肠杆菌DNA解旋酶可作为一种给DNA中引入负超螺旋的酶,因与拓扑异构酶Ⅰ相竞争,它维持着细胞DNA超螺旋的天然水平。一些人认为,通过改变DNA超螺旋,能够调节基因的表达。
现在可以看出,这个几乎被普遍接受了的想象其实是颠倒的。实际上大肠杆菌解旋酶似乎消除了正的超螺旋,而不是制造负的超螺旋。天然超螺旋是一个不相干的概念,因为实际的局部超螺旋可以是非常正、非常负或者是可以忽略的,这取决于启动子的位置,取决于RNA聚合酶的流动位置,取决于RNA聚合酶的位移速率与通过拓扑异构酶的超螺旋的消除效率之间的关系。超螺旋依赖转录的程度要比转录依赖超螺旋的程度大得多。
王及其同事的发现强调了RNA在体外负的超螺旋下形成的独特结构(开放区、十字形、Z和H形等)的意义。这些结构能在超螺旋波的负范围内(移动的RNA聚合酶的后面)瞬间地形成,而且被特定的蛋白捕获。在其他情况中,这能够解释复制和重组的转录活性。
[Nature,1989年1月19日]