在美国生物医学研究领域,其论文的发表比以往任何时候都多,但药物开发却进展缓慢。目前一些新建立的科技公司,正在努力将生物医学方面的知识转化为新的医疗手段。

在林道会议期间,当问及美国在生物医学研究中的成就时,哈佛医学院行政院长比尔·奇恩(Bill Chin)回答说:“如果要说我们对疾病了解多少,我想我们正在成功的道路上顺利发展。但要说将基础科学的理论变成潜在的药物,我们目前做得还不够好。”对于奇恩和其他科学家来说,如果科学发现的实际应用目标不能实现,这些发现的重要性也就无从得到体现。虽然目前发表的许多论文表明,美国科学家在对人的生理、遗传和疾病的了解方面取得了长足的进步,但却未能有效地将其转化为诊断和治疗手段,这一点让研究人员和公众都深感沮丧。
对新药开发缓慢的思考
基础科学的进步比比皆是。自1901年以来的196位诺贝尔生理学或医学奖得主中,美国科学家占据了其中的46%。据美国国立卫生研究院(NIH)称,第一个人类基因组测序花了五年时间,投入资金450万美元。如今,在90天时间内花费9500美元就能完成类似的基因组测试。
据估计,到2011年底,北美的科学家将完成9000项基因组测序,而这类测试是必不可少的,即将遗传变异与一些常见疾病联系起来的研究项目。虽然科学家目前对基因变异知识的了解尚不足以对病人的治疗产生重大影响,但如细雨润物一般,已悄然进入了临床实践之中。例如,北卡罗莱纳州杜克大学的研究人员发现,可以通过IL28B变异基因来对丙型肝炎患者进行测试,以确定某些治疗方案对他们是否有效。
“任何断言未有进展的人实际上并没有对这方面给予足够的关注,”总部设在弗吉尼亚州的一个致力于将生物医学研究列为国家优先项目的倡导组织“研究!美国”(Research!America)的负责人玛丽·伍利(Mary Woolley)说,“我们在妇女保健和医药学方面已经取得了很大的进步。”伍利特别援引了在癌症和心脏疾病治疗方面所取得的成绩,在2001年至2007年间,每年癌症和心血管疾病的死亡率分别下降了9.1%和23.5%。然而,这些积极的趋势未能令公众信服。伍利说:“我们的调查结果显示,有相当一部分人认为我们在生物医学研究中未能取得足够的进展,这种情况令人不安。”
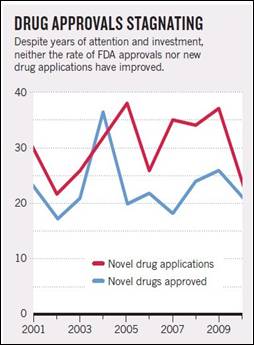
信心的缺失可能反映了对于低回报率的挫折感。据“研究!美国”倡导组织称,美国2010年在医疗卫生方面的支出达2.6万亿美元,占国内生产总值(GDP)的17.8%,比任何其他国家的比例都高。然而,美国在公民健康方面的成效,包括人均寿命和婴儿死亡率(见图表2:“预期寿命”和“婴儿死亡率”)在世界上只排名居中。
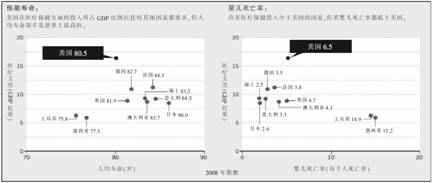
虽然提出某种特定基因或蛋白质有战胜疾病潜力的报告多达几千份,但在过去五年里,获得美国食品和药物管理局(FDA)批准的新药只有111种,比五年前要少得多(见图表3:“新药批准进展缓慢”)。同样,尽管科学技术在不断进步,药物开发的速度和价格都没有得到改善。研究中发现的与疾病治疗有关的重要分子只有2%的几率被转化为治疗手段。
科研成果转化为药物的过程,通常需要13年时间以及10亿美元以上的投资,其中包括失败所需的成本。在2011年林道会议上发言的NIH主任弗朗西斯·柯林斯(Francis Collins)认为,这至少可以说是一个低效率的过程。他质疑道,面对这种现状,人们不仅要问,人类健康的未来难道能寄希望于如此缓慢的药物开发过程吗?
科林斯认为,尽管科学家在了解疾病的发病机理上取得了很大进步,但将这些研究发现转化为临床应用的过程仍然非常缓慢且成本高昂,并且要面对多次的失败。一方面,生物医学的研究成果转化为临床应用的阻碍因素需要加以认识和解决,另一方面,美国联邦预算在医药界的投入也陷入困境,10种重要药物即将面临专利到期,预计销售损失将达500亿美元以上,药物开发商将面临一个困难时期。
“这一领域内的科研从来没有像现在这样,在彻底改变人类健康状态方面给人们带来从未有过的振奋人心的希望,”柯林斯说,“然而,对这这一领域科研的支持也从来没有像现在这样紧迫。”为此,美国生物医学的一些领军人物最近推出了一系列新的计划方案,以加速新药产生的过程,并努力扭转制药行业的不利形势。
在美国,联邦政府每年资助生物医学的研究资金约459亿美元(占三分之一),其中大部分进入了NIH,三分之二资金缺口由制药行业与生物技术公司投入,2010年为765亿美元,包括大学、基金会和其他来源也提供了部分资金。总的来说,研发占美国全国医疗卫生事业支出的5.5%以下,医院护理和临床服务投入资金所占的比例则要大得多。
为了维持研发所需的经费支出,制药公司需要销售新的药物。美国新泽西州凯尼尔沃思的默克研究实验室的查尔斯·伦恩(Charles Lunn)说:“如果一项计划不能成功,我们会损失很多钱,因此,在寻找新的机遇与学术界合作时,我们会非常小心,非常谨慎。”
高风险的行业
Redpoint Bio是宾夕法尼亚州费城一家小型生物技术公司,该公司研究部主任凯尔·帕尔默(Kyle Palmer)曾亲身经历过这样的风险。Redpoint Bio是神经学家罗伯特·马戈斯基(Robert Margolskee)于20世纪90年代末创办的,其初衷是为市场生产调味化合物。几年后研究人员发现,他们生产的一些化合物对胰岛素有调节作用,具有治疗II型糖尿病的潜力。Redpoint Bio为此开始了胰岛素调节化合物的研制(小鼠实验)并被授予专营权。然而,接下来的一切却并非想象的那么顺利。帕尔默回忆道:“正当我们认为即将发明几种大公司感兴趣的新药时,经济上的困境压垮了我们,即将成功的希望就这样破灭了。”没有投资承诺,Redpoint Bio的化合物研究因此搁置了下来。
“一些制药公司似乎纷纷退出了基础研究,”帕尔默说,“他们将临床前研究的工作‘外包’给了生物技术公司或学术研究机构,一些生物技术公司也改变了以往的一些模式,例如,将早期阶段药物提供改成为制药公司提供药物实验等服务。我们现在一直就是这么做的,我们已经将新药发明这一块拍卖掉了。”
伦恩解释说,如今制药公司在投资新药开发时,往往需要大量的数据作为决策依据,部分原因是因为生物学变得比以往人们所认为的复杂得多。“你可以说,某个新发现可以带来很多实际的益处,但人类生物学是如此的复杂,要证明其有效性,我们需要更多的信息。”
分子科学领域内的大量发现与后期临床试验成果稀缺之间,是一片被称为“死亡之谷”的空白。要穿越这片空白之地,就意味着研究人员和药物开发商在各自的领域内更为紧密地衔接,这将需要激励机制的某种改变。例如,理论研究人员因新的发现可以受到嘉奖,而不是要反反复复地进行各种动物实验,以支持其初步研究结果。强生制药公司研发部门的埃里克·佩拉基斯利斯(Eric Perakslis)说,目前的做法对于制药公司来说有着太多的风险。例如,一个基因或一种蛋白质拥有有效的抗肿瘤作用,但却不能表明对哪种类型的肿瘤最为有效。因此,很少有人能够在相关数据极少的基础上做出投入数十亿美元的决定。
在英国牛津大学从事转化医学研究的查斯·鲍恩特拉(Chas Bountra)认为,在“死亡山谷”的另一边,制药公司在申请某种化合物独家经营权的知识产权(IP)时,也存在着对转化医学的障碍,在此之前,他们需要证明它在临床试验中的有效性。如果拥有某项知识产权的公司将一个项目拿在手中,就像Redpoint Bio生物公司所做的那样,那么,他们将独家拥有与项目有关的化合物。鲍恩特拉说:“将科研成果转化为药物,本身是非常困难一个过程,而我们的一些做法使得这一过程变得更困难更昂贵。”
一些相关的法律法规也是争论的另一个焦点。哈佛医学院比尔·克劳利(Bill Crowley)教授认为,一些存在着利益冲突的政策释放的是某种代表不信任的信息,从而阻碍了理论研究人员与药物开发商之间的合作。
克劳利还认为,对人体研究较为严格的联邦法规值得商榷,这将使药物开发陷入困境,甚至停顿,而对更安全药物的开发也无帮助。“上世纪80年代,进入临床试验的患者的知情同意书大约只有一页,在我和病人之间几乎无一例外地会对细节进行讨论,”他说,“现在的书面同意书是由律师写就的,长达19页,大多数患者不会花费心力去仔细阅读,即使他们想看,恐怕也看不明白。”
转化新药的转折点
多年来,为了填补研究成果与转化医学之间的空白,人们进行了许多的尝试,但收效甚微。佩拉基斯利斯说:“如果我的合作者不能继续获得研究资金,则意味着他们在这个领域内无法生存下去,他们就不能成为我理想的合作伙伴。”
近来在各个学科领域内,出现了公共部门和私营部门成为合作伙伴的许多例子,打开了从科研到生物医学转化的渠道。例如,设在马里兰州贝塞斯达的一个为NIH投资的基金会,其目的是为加快NIH的研究。该基金会在2006年成立了生物标记物协会,包括NIH、FDA、制药行业和大学等都是该协会的成员。利用从非营利组织和制药公司获得的总计3500万美元的投资,该协会推出了12个项目,以帮助一些大规模临床试验获得FDA的批准,以及将获得的研究成果进行综合,让所有的合作伙伴共享成千上万患者的数据资料。
另一项活动的发起者是“结构基因组协会”,鲍恩特拉是这个组织的负责人之一,该协会的宗旨是分子结构的信息共享:药物开发商如果知道起抑制作用的某种人体蛋白质的三维结构,发现一种有针对性的有效药物的可能性就会大为增加。而来自学术研究中心和制药行业的研究小组,可以在大量的药物研发中共享药靶、试剂和化验报告。另外,如果化合物在完成早期临床试验前不受知识产权的限制,所有参与的企业都能在不用付出巨额初始投资的情况下获得相关的知识。
鲍恩特拉说:“公共部门和私营部门形成合作伙伴关系是一种很好的模式,我们可以集中资源,不用担心知识产权的问题,也不用担心投资回报机会渺茫的问题。可以坦率地说,大多数情况下不会出现这种情况。”他同时认为,论文在正式出版前的资源共享不会对学者的利益造成伤害。
鲍恩特拉在他的网站上已经发布了他的研究小组最近发现的一种人体膜蛋白的详细结构,以及他正在准备中的一篇论文。他相信,《自然》杂志或《科学》杂志都不会因为他公开了论文内容而拒绝发表他的论文。事实上,这两家期刊都表明,他们允许论文作者在网上非营利性的信息公布,前题是不给出结论。鲍恩特拉补充道:“我之所以肯冒这方面的风险,是因为我关注新药的诞生甚于超过关注论文的发表。”
促进转化医学新举措
对于一些不如鲍恩特拉乐观的科学家来说,也许以下事实会让他们感到宽慰,包括哈佛医学院、普林斯顿大学、加州大学等在内的一些顶级研究机构,如今不仅注重研究人员论文的发表数量,也包括其他一些因素,如对合作研究所做出的贡献等。同时,为了缓解因利益冲突产生的问题,哈佛医学院修订了相关政策,更清楚地界定哪些行为可以接受,哪些行为严令禁止。奇恩解释道,修订后的相关准则旨在鼓励合作,“研究成员可继续从事的活动包括:开发由企业赞助和支持的研究;以合作者的身份与企业界开展合作研究;为行业提供咨询服务;开办生物技术公司;在科学顾问委员会任职;可拥有公司大部分的股权。”
对于柯林斯来说,修复科研成果转化为医药的渠道十分重要。为此,他建议关闭NIH其中的一个中心,重新改组后成立一个国家转化科学促进中心(NCATS),以帮助生物药企缩短新药和诊疗方法走向商业化过程的时间。由NCATS资助的NIH研究员和科学家将集中于药物的早期研发,虽然这些成果可能不会被发表在一些重要的科学出版物上,但却是弥合科学发现和药物开发之间空白所必不可少的。柯林斯在领导人类基因组计划时曾说,同事间的压力也是一种动力。“你不想因为你而拖了整个团队的后腿,你是否成功也是决定整个团队是否成功的一个重要因素。”他说,“在研究机构中,人们正在逐步地认识到,能够参与一个重要的科研项目,其重要性并不亚于发表多少论文。”
哈佛医学院负责临床转化的院长李·纳德勒(Lee Nadler)认为,帮助临床医生诊断疾病或提高药物的疗效将是至关重要的。好的药物会让整个社会更接近减轻疾病痛苦的最终目标,然而仅此还不够。预防疾病是另一个目标,为达到这个目标,联邦政府的支持是必不可少的。“如果你是一个制药公司,你的目标是出售对疾病的治疗药物,预防疾病不会成为商业计划书的最佳选择,”柯林斯解释说,“但是,NIH是一个在了解生命奥秘的基础上,以提高和改善人类健康状况为目标的机构,必须成为预防医学的前沿,并建立一个这样的研究中心。”
克劳利认为,除了实验室工作之外,公共卫生部门需要与健康保险公司、制药公司和FDA协作,致力于改变美国的药品和医疗成本高的现状,因为国民健康状况将直接影响到公众对生物医学研究的信心。在医疗保健所涉及的所有各方为了这个共同目标而形成共识之前,没有谁能够在生物医学的“成绩单”上得“A”。克劳利郑重说道:“如果从科研成果转化为医药开发的过程不能顺利进行的话,美国的整个医疗计划将归于失败。”
资料来源 Nature
责任编辑 则 鸣







