人体干细胞自我更新和产生新组织的潜能几乎是无穷的,这些特性使得干细胞成为实验室和医学应用上的重要工具。在生物学或医学研究领域中,干细胞作为一种有效的治疗手段其潜能令人难以置信。那么,干细胞作为医学临床的实践工具,科学家是如何发挥其惊人的潜能呢?
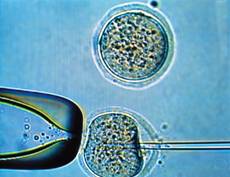
图为正在进行细胞核移植的小鼠胚胎细胞:卵细胞中的遗传物质剔除后,被注入其他的成体细胞
操纵细胞
黄斑变性是一种常见的老年病,是导致65岁以上老年人视力衰退的主要原因――病因是分布在视网膜组织上的感光细胞受损而停止工作,最终导致患者视力丧失――患者从最初感觉事物的模糊不清,到在弱光环境下识别困难,最终彻底失明。预计到2020年,美国将有接近300万老年人罹患黄斑变性眼疾。
相关的一些疾病也会影响青少年,比如遗传性疾病斯特格氏症(Stargardt's,也叫少年性黄斑营养不良)。这种病变是由脂肪堆积在视网膜上,引起视网膜退化而导致视力下降。如果视网膜上坏死的细胞能够被修复或更新,那将会怎样?
科学家正在尝试一种针对黄斑变性和斯特格氏症的新疗法。比如,美国先进细胞技术公司(ACT)把从人的胚胎干细胞中获得的眼部细胞注射到患者眼底,以修复视网膜。这就是干细胞应用的典型例子。干细胞的强大之处在于其具有多能性,也就是说,它们可以发育成人体220种细胞类型中的任意一种。一个干细胞还能分裂产生数百万的干细胞。
人体干细胞自我更新和产生新组织的潜能几乎是无穷的。这些特性使得干细胞成为实验室和医学应用上的重要工具,给科学家们提供了一条探索人类发育、不危害志愿者药物测试以及替换受损组织(例如视网膜上的细胞、肌肉和脊髓)的途径。不过,我们究竟该如何充分利用干细胞?如何使它们在我们需要的地方并以我们期望的方式生长,进而修复受损或病变的组织?
要了解干细胞,首先必须建立其基本的生物学体系。从微小的蠕虫到老鼠和人类,干细胞几乎分布在所有种类的生物体内。干细胞分为胚胎干细胞、成体干细胞和诱导多能干细胞(iPS)三类,都有其各自的能力和局限性。胚胎干细胞源自生物体发育的最初阶段:当精子与卵子融合后,形成受精卵并开始分裂,此时,每一个细胞都具有发育成成体所有细胞类型的潜能(这就是多能性的本质)。细胞经过几次分裂,开始倾向于各自不同的命运,并表达某种细胞类型特异的基因。这个过程称为分化。
胚胎一旦发育成为成熟的个体后,大部分细胞都会分化,但部分细胞不同于大部分成体细胞,而是保持了增殖和形成其他类型细胞的能力,这就是成体干细胞。这些干细胞存在于某些组织特异性的干细胞微环境中,等待着生物体发出替换或修复组织的指令。研究人员通常可以在需要持续更新的组织中找到这类干细胞,如血液、皮肤和肠道(在不需要频繁更新细胞的大脑中也有发现)。成体干细胞具有多方面的潜能,但与多能性细胞相比,它们不能转化成人体所有的220种细胞类型。例如,大脑中的神经干细胞能分化成几种脑细胞,但不能发育成肝脏细胞。
十年来,科学家还掌握了让成熟分化的细胞恢复到多能性状态的技术。他们诱使已经分化的细胞重新获得多能性,并将其命名为诱导多能干细胞。比如,通过上调少量特定基因的表达,科学家能让皮肤细胞从分化信号通路逆转,回到灵活的多能性状态。
能够操纵细胞的命运,无穷的细胞潜能越发令科学家着迷。但干细胞研究是一个新兴的领域,仍有大量问题有待破解,如三类干细胞有何异同?人类能否用它们来治疗疾病?又能否利用它们重建受损的组织和器官?
发展历程
机体里的每一个细胞其所拥有的基因组都是相同的,而不同类型的细胞之所以各异,是在于它们开启和关闭的基因不同。在视网膜细胞中,感光的基因被开启而消化蛋白质的基因被关闭(在肝脏细胞里则恰恰相反)。利用胚胎干细胞治疗失明的科学家已经找到病人视网膜上哪些基因需要开启,哪些基因要关闭。通过胚胎干细胞的培养过程中添加特定的化学物质和蛋白质,使它们定向分化成视网膜细胞,科学家从中可获得无穷无尽的实验材料。
能做到这一点,是科学家数十年努力的结果。追溯干细胞的发现历程:1868年,德国生物学家恩斯特·海克尔(Ernst ·Haeckel)第一次用“干细胞”这一术语来描述受精卵,包括从1981年开始进行的小鼠胚胎干细胞研究,直到1998年第一次分离出人类胚胎干细胞……
这一突破要归功于威斯康星大学麦迪逊分校的詹姆斯·汤姆森(James·Thomsen)研究团队,他们成功地从胚泡(干细胞的天然来源)里获得了“内层细胞团”。在实验室里,科学家通过精子与卵子形成的受精卵,进而获得极早期胚胎――胚泡。而在生殖诊所内,科学家往往会根据父母的意愿,将受孕后剩余的胚胎或冻存或销毁。在这种情况下,父母们也可以把多余的胚泡捐献给科研工作。如果将胚泡植入子宫,内层细胞团就会发育成胎儿,而外层细胞,即滋养外胚层会形成胎盘等附属组织。然而,如果胚泡没有被植入,就可以被用来作细胞培养。
在细胞培养过程中,从内层细胞团的培养,直到获得细胞系(一组拥有相同基因的细胞),同时还需要培养液以及一些小鼠细胞用以培养或支持细胞。事实上,干细胞的部分定义就是它几乎能无限分裂,产生越来越多的干细胞。与之相反,普通细胞由于端粒(DNA的末端)的限制,细胞复制不能到达DNA链的最末端,每经过一次分裂,端粒就会缩短,直至死亡。而干细胞中有一种端粒酶,可以维持端粒的长度与功能,使细胞获得永生。
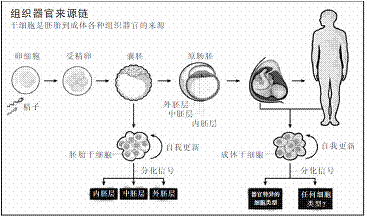
但对于干细胞来说,能永远分裂下去是不够的,它还必须具备多能性,能够发育成任何类型的细胞。在胚胎的发育中,机体的器官和组织都是由三个胚层发育来的:内胚层、中胚层、外胚层。一个多能细胞能够发育成这三个胚层,如果只发育成一个胚层,就说明其开始走向分化,而不再具有多能性。
如何测试科学家分离的干细胞其多能性?他们经常采用的方法是把细胞注射到小鼠体内。一旦进入小鼠体内,多能细胞会形成畸形瘤,即包含三个胚层的细胞肿块。汤姆森得到的细胞就是这样的。只有得到能无限分裂并保持多能性的细胞,科学家才能说建立了胚胎干细胞系。
在获得大量可以无限分裂并具有多能性的胚胎干细胞后,尽管科学家知道如何分离这些细胞并在实验室里进行操作,也知道什么样的培养条件能让细胞维持健康状态。那么,他们应该可以让胚胎干细胞发育成治疗疾病所需的细胞类型了吧?
然而这并非易事。在针对黄斑变性的治疗中,科学家已经确定了其中的一些分子能够诱导干细胞形成视网膜细胞。但是,不同类型的细胞需要不同的条件和分子指令,不能一概而论。他们现在还不知道诱导干细胞转变为人体内所有220种细胞所需的特殊条件和移植技术。除了细胞培养技术的限制,科学家还受到了伦理道德等多重压力,并不是每个人都支持胚胎干细胞的研究。
反对声音
在胚胎干细胞的利用中,人们到底顾虑什么?其中主要的反对意见是基于人类文化和宗教信仰。例如,天主教徒和一些保守的新教徒反对干细胞研究,他们坚信怀孕就是人类生命的开始,破坏受精卵或胚胎乃至胚泡都是不道德的。包括一些人对干细胞的来源存在误解,认为干细胞来自于堕胎的人类胎儿,而不是那些没有被植入子宫的胚泡。此外,很多从事干细胞研究的科学家也有着其自身的宗教信仰。
在美国,政府是大部分医学研究项目的资助者,因此干细胞研究的准则是由政府制定的,总体上是限制的。尽管2001年小布什总统批准了联邦基金对人胚胎干细胞有限度的研究资助。长期的限制使得用于科研的人类胚胎干细胞系还不到一百个。2009年,奥巴马总统签署了命令,即联邦政府将在法律允许的范围内为负责任的、有科学价值的人类干细胞研究提供支持和引导,包括胚胎干细胞研究。尽管如此,可用于研究的干细胞系还是不到200个。
长久以来,科研人员认为细胞一旦分化就丧失了多能性。他们推测,众多基因以特定方式开启或关闭,以决定这一细胞的特性。然而在2006年,日本京都大学的高桥和敏和山中伸弥通过实验证实并非如此。他们将小鼠的皮肤细胞――确切地说是成纤维细胞――转化成为了干细胞。这是科学家首次得到的诱导多能干细胞(iPS)。
如何使已分化的细胞恢复多能性状态,实现细胞的重编程?科学家设想,如果迫使细胞开启干细胞中的活性基因,同时关闭其他所有基因,就很可能获得干细胞。因此他们必须弄清,哪些基因对干细胞的表型至关重要。换句话说,哪些基因决定了干细胞之所以成为干细胞?
科学家于是选择了24个他们认为可能决定干细胞多能性的基因。他们以多种组合开启了小鼠成纤维细胞的基因。最后,他们发现一个由四个基因编码的转录因子组合(调控基因开启和关闭的分子)能够使成纤维细胞转变为iPS细胞。这四个基因分别是:Oct3/4, Sox2, c-Myc 和 Klf4。
iPS细胞一个优点是它们不需要捐赠胚胎。针对iPS细胞的研究竞赛就这样开始了,虽然山中伸弥是这个领域的先行者,不过他的研究小组很快被其他科研团队赶上。现在一些科学家正通过重编程细胞来获得符合科研需要的iPS细胞,包括哈佛大学和其他一些大学为此建立起专门的iPS细胞研究中心。
iPS领域的进展是如此迅速,只用了不到六个月,科学家就修改了小鼠iPS技术方案,将其用于人类细胞。相比之下,1998年汤姆森首次获得人类胚胎干细胞时,距科学家第一次获得小鼠胚胎干细胞已经过去了17年。
既然可以生成iPS细胞,接下来他们希望改进诱导过程。两个主要的关注点是基因的致癌性和介导基因的病毒载体的应用,这可能对接受干细胞治疗的病人造成伤害。比如,山中伸弥和其他研究小组用来诱导生成iPS细胞的基因c-Myc容易致癌――尽管小鼠体内的c-Myc蛋白表达水平很高,但经常患上肿瘤。可能是c-Myc在刺激干细胞产生的同时,也刺激了癌细胞的生长。由于干细胞和癌细胞之间的相似性,干细胞容易致癌成为了科学家的一个关注热点。
2008年,山中伸弥和同事宣布一个令人意外的结果,他们成功地把c-Myc从诱导方案中剔除。经过一系列的实验,他们发现c-Myc在iPS中并不是必要条件,仅仅加速了实验过程。没有它,他们的技术同样能发挥作用。
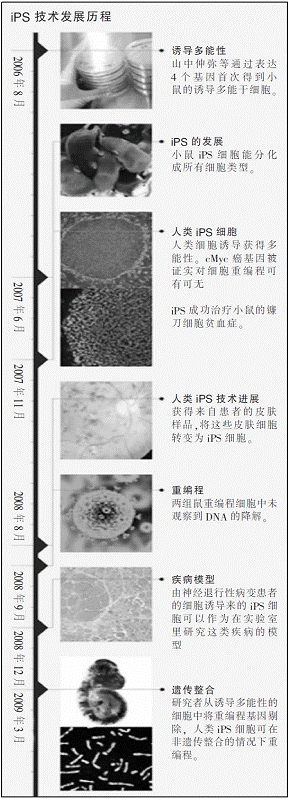
科学家发现,iPS技术中通用的病毒载体也存有安全隐患。包括汤姆森研究团队使用的一些早期的iPS技术,都是通过病毒载体把新构建的DNA介导到人类细胞中。这些病毒会不会激活癌症基因,或者产生一些不良的基因表达而引发负面作用?为此,一些研究团队开始转向研究不依赖病毒介导的技术。
2008年,日本科学家报告说,他们成功地把干细胞基因通过质粒(一种环状的DNA分子)整合到人类基因上。不过,像病毒一样,质粒可能也会插入细胞基因组的错误位点,激活癌基因。为了避免这种风险,科学家随即又创造了另一种导入干细胞基因的方法:即先把干细胞基因通过非整合载体或质粒导入细胞,待细胞获得多能性后再将其剔除,以此消除嵌入核酸或质粒所带来的风险。
更理想的办法是,完全摆脱基因插入技术,依靠培养基中的化学因子改变细胞自身的基因组,以驱动细胞向多能性转变。迄今为止,科学家在小鼠中已经成功用化学信号取代了被转录因子激活的信号。令人惊讶地是,化学因子可以替换很多转录因子的功用,唯独转录因子Oct3/4除外。
细胞记忆
iPS细胞像胚胎干细胞那样,能无限分裂,也能形成三个胚层。但不同于胚胎干细胞的是,iPS细胞曾经是已经分化的细胞,如皮肤细胞或肌肉细胞,它们仍具有过去某些遗传或细胞意义上的“记忆”吗?近年的研究表明,这些“记忆”的确以DNA表观遗传标记的形式存在着。
来自哈佛大学的乔治·戴利(George·Daley)注意到,同样是用iPS细胞分化得到的血液细胞(由血细胞诱导来的iPS细胞)比用皮肤细胞诱导来的iPS细胞更容易。戴利和其他研究小组发现,iPS细胞保持了一些表观遗传标记,在原先的已分化细胞中控制着基因的开闭。只有把这些标记除去,科学家才能说我们得到的iPS细胞与胚胎干细胞毫无差异。
将干细胞移植到患者体内的预期用途很多。但是,在iPS的过程中,致癌基因带来的风险让一些科学家心怀疑虑。如果医生能在治疗中避免多能性的步骤,治疗风险将会降低。最理想的情况是,从根本上避免进行细胞剔除和移植。那么有没有药物可以作用于人体内的细胞,引发细胞的再分化,从而形成需要的细胞?
最近科学家发现,已经分化的细胞可以直接转变为另一种类型的细胞。这个被称为转分化的过程吸引了很多科学家开展研究。
2008年,哈佛大学的道格拉斯·梅尔顿(Douglas Melton)、周乔(QiaoZhou,音译)将小鼠的一种胰腺细胞转变成了另一类胰腺细胞――能产生胰岛素的胰岛β细胞。他们在活鼠体内进行了实验,证明新的细胞类型除了在实验室的培养皿中培养,还可以在自然环境中形成。
除了其医学意义,把胰腺的一种细胞转变成另一种,即改变相似细胞命运还只是相对小的跨越。斯坦福大学马里厄斯·沃尼格(Marius·Wernig)团队在2010年做出了更大的飞跃――把小鼠的纤维原细胞直接诱导成了完全不同的神经细胞。一年后,他们又在人类细胞中获得了成功。同年,另一个科研小组用成纤维细胞转化生成了特殊的神经细胞,能产生神经递质多巴胺――多巴胺有助于控制机体运动,缺失这类神经细胞的人容易患上帕金森氏症。
科学家仍然不能确定,即细胞是直接从一种类型改变为另一种,还是经过了低分化的阶段。然而,目前还没有经过验证且能重复的方法。要想这些细胞用于详细的研究或医学用途,还需要做大量的工作。
医学应用
科学家也在努力利用人体自身的成体干细胞,因为使用这种干细胞不会引发伦理问题。但利用成体干细胞的难度是其数量很少,且深埋在人体组织中。这一领域的进展主要受困于无法获得足够的细胞。
不过医生们40年前就已经开始用成体干细胞治疗疾病,其主要用途是:骨髓移植以修复患者的免疫系统、皮肤移植以取代烧伤或受到其他损伤的皮肤。
除此以外,科学家还想开发成体干细胞的其他应用。然而,他们仍不完全清楚这种细胞是从何而来,又是如何在需要时进行分化的。假如能解开这些奥秘,医生们就可以用药物激活患者的自身成体干细胞,以完成必要的组织修复。
例如,心脏病发作会损伤心肌细胞。理想情况下,心脏内的成体干细胞可以重新生成心肌。可是,目前的成体干细胞仅能取代少量附近的细胞而不能修复心脏病发作所造成的伤害。2011年,科学家发现了一种能促使成体干细胞生成心肌细胞的蛋白。尽管其机理目前还不太清楚,但如果这种蛋白能大面积地工作,医生们有望实现心脏的自我修复。
此外,干细胞还能生成科学家所需类型的分化细胞。以笔者的形成骨头和软骨细胞的研究课题为例:首先将干细胞克隆(可以来自胚胎干细胞或iPS细胞)并在培养基中悬浮培养,让其分化成三胚层细胞,然后用生长因子把这些细胞转变为间质干细胞(能够发育成骨、软骨和脂肪的干细胞),最后,加入刺激骨和软骨细胞分化的化学因子。接着,再把这些未彻底分化的细胞注射到小鼠体内,用以观察它们是否能继续分化直到形成正确的组织。
过去十年间,科学家开发了很多让干细胞定向分化的方法,包括发育成为心脏细胞、肝脏细胞、大脑细胞和胰腺细胞等一系列细胞,并对其健康细胞和病变细胞展开研究。相对于人和动物而言,对单个细胞的研究则简单得多,科学家直接可以从病人身上取得皮肤样本,将其转化成iPS细胞,进而得到与疾病相关的细胞类型。
例如,脊髓性肌肉萎缩症的表现是患者下运动神经元减少,导致肌肉无力、瘫痪,直至死亡。针对下运动神经元减少的症状,威斯康星大学麦迪逊分校的艾莉森·艾伯特(Alison·Ebert)领导的团队从一位患者和他健康的母亲身上获取了iPS细胞,分别得到了运动神经元:与母亲的神经元相比,由患者细胞生成的神经元在遗传上依然保持了疾病的特征。类似的研究,也在另一种神经系统紊乱,即“家族性自主神经异常”上开展。
迄今,科学家在iPS衍生的运动神经元上筛选了几百种药物,挑选出一部分能减轻细胞病变的药物。但这类试验是禁止在人类身上进行的,动物试验的花费也相当昂贵,而用培养的细胞进行试验就相对容易了。
哈佛大学干细胞研究所的科学家已经构建了包括1型糖尿病、唐氏综合征和肌肉萎缩症在内的十多个与疾病相关的干细胞系,他们计划获得更多的干细胞系与其他干细胞研究者共享。美国国立卫生研究院(NIH)支持的位于新泽西卡姆登的科里尔医学研究所的细胞库,也提供与疾病相关的iPS细胞共享,包括亨廷顿舞蹈病和脊髓性肌肉萎缩症。
迈向治疗
针对黄斑变性、脊髓损伤等干细胞治疗的临床试验正在进行。尽管是小范围的,但这也表明,利用干细胞治疗某些疾病终将会成为现实。目前是确保干细胞疗法的安全性和细胞不会在错误位置上生长,避免引起免疫反应或发生病变。与其他器官相比,ACT公司正在展开的针对黄斑变性的干细胞治疗相对安全(干细胞很少被眼部排斥),这是因为血脑屏障隔离了大脑和免疫系统。
然而,利用干细胞治疗失明与真正实现其疗效仍有一段距离。在动物试验中,针对实验鼠的黄斑变性或类似斯塔加特氏症,科学家把视网膜细胞注射到实验鼠眼部,使这些鼠的视力得到了一定的改善,包括目前针对少数患者进行的安全性疗法测试。倘若能证明这种细胞的安全性,相信科学家会扩大临床范围,让患者的视力得到改善。
与此同时,美国杰龙公司与加州大学欧文分校的汉斯·基尔斯特德(Hans Keirstead)团队合作进行的一项临床试验:用胚胎干细胞分化得到的神经元治疗脊髓损伤。大家知道,神经受损后是很难再生的,原因在于失去了髓磷脂保护层。而髓磷脂是一种包裹神经的蛋白,类似于电线的绝缘层。其中,少突胶质细胞的功能是生成髓磷脂以保护神经不受感染。科学家推测,如果能更换这种支持细胞,就可望重建神经周边的髓磷脂,继而释放生长因子进行神经修复。
首先他们必须使胚胎干细胞分化成少突胶质细胞。在经过无数次尝试与失败后,基尔斯特德团队获得了成功。当他们把新生成的少突胶质细胞移植到脊髓受伤的大鼠体内后,在受伤神经周围形成了新的髓磷脂,大鼠的运动功能得到一定程度的恢复。
为了减少组织移植中出现的排异现象,科学家正在考虑将iPS细胞用于患者的特异性移植材料。理论上,科学家可以修复患者iPS细胞的遗传缺陷,再把它们移植到同一人体内。例如,马萨诸塞州坎布里奇的怀特黑德生物医学研究所的鲁道夫·詹尼士(Rudolph·Jaenisch)团队,他们在修复小鼠iPS细胞的基因缺陷后,成功实现了对小鼠镰状细胞性贫血的治疗。这一工作为iPS细胞治疗人类疾病提供了原理论证。
冰山一角
上述干细胞的研究及其影响仅仅是个开始,其潜能令人印象深刻。目前,世界各地富有创新精神的科学家正在致力于探索以下一系列未知问题。
首先,移植后的干细胞会怎样?它们能否到达正确的位点并发挥恰当的作用?
第二,在干细胞疗法大规模用于病人之前,确保其安全性是至关重要的。尽管科学家在实验中减少使用易引起癌变基因或病毒方面取得了一些进展,但我们能确保干细胞疗法不会导致癌症或其他疾病吗?
第三,iPS细胞能否取代胚胎干细胞吗?它们是否具有太多的“前世记忆”?
第四,干细胞移植会否遭到免疫系统的排斥?成体干细胞是什么,从何而来?我们如何获取更多的成体干细胞,以及用药物刺激真的有效吗?
以上问题只是实验室研究遇到的很小一部分,一些令人兴奋的问题可能还没有想到。在某种意义上,干细胞在医学上的多种应用吸引了大众的注意,其潜在的功能唤起了人类战胜疾患的希望,这无疑改变了我们从“不可能”到“可能”的转变。
资料来源 Nature
责任编辑 则 鸣
――――――
本文作者尼茹帕玛·舍弗德(Nirupama Shevde),资深科学家,威斯康星大学麦迪逊分校莫格里奇研究所宣教主任。


