一、引 言
基因治疗就是将遗传物质导入哺乳动物体细胞,用于治疗恶性肿瘤、感染性疾病和失天性遗传病。这种方法有望成为临床医生目前这些疾病的一种有效的辅助手段。很明显,基因治疗对人类疾病的疗效有待于最后的确定。
二、基因转移系统
尽管向哺乳动物细胞内转移基因的方法有多种,但目前临床基因治疗试验大多以逆转录病毒载体作为转基因的首选策略。逆转录病毒载体复制系统已发展到可使逆转录病毒基因组在不转变为野生型病毒的情况下从病毒包装细胞转移到靶细胞内。为达到这个要求,重组病毒基因组中需仅保留(1)病毒基因组RNA复制所必需的序列,(2)将病毒基因组RNA包入病毒颗粒所需的序列,(3)逆转录和在靶细胞内产生病毒基因组RNA的双链DNA拷贝所必需的序列,(4)将病毒DNA拷贝整合到靶细胞染色质上所必需的序列。逆转录病毒还含有特异的非编码序列,它必需存在于cis中以确保这一系列过程的发生。除此cis作用的序列外,还有某些存在于trans中的逆转录病毒的编码序列,它们的蛋白质产物(gag,pol,env)也是这一系列过程所必需的。这些编码序列在包装细胞中以这样的方式表达:它们的蛋白质产物能被包入病毒颗粒,而其mRNA却不能被包入。这为重组病毒基因组编码序列的包装和转染(而不转变为野生型)提供了必需的成分。因此,在转导细胞中病毒不能复制,防止了病毒向其他细胞的扩散。逆转逆病毒的这些特点为转基因提供了一个安全有效的方法。
其他病毒介导的转基因技术都是以下列病毒的重组形式为基础的:腺病毒、腺相关病毒(AAV),疱疹病毒、痘苗病毒、脊髓灰质炎病毒、Sindis和RNA病毒。迄今,只有腺病毒系统被广泛用于临床。腺病毒基因传递系统的基因组中缺乏E1区,能在表达E1基因的细胞中繁殖,这是其能被安全应用的原因。紧接着又证明,含有外源性DNA序列的缺陷病毒基因组能在trans提供E1蛋白的细胞中复制,这又增加了这种载体在基因治疗中的实用性。
三、治疗性细胞的基因标记
(一)肿瘤浸润性淋巴细胞
许多试验正在用稳定的基因标记方法来确定肿瘤浸润性T细胞(TILs)向肿瘤部位的移动能力以及在癌症病人体内的持久存在问题。TILs是那些浸润到肿瘤组织中的T淋巴细胞,从体内取出,在IL-2存在下扩增得到的。对某些荷瘤动物和肿瘤病人回输适当数量的TILs能引起肿瘤的消退。TILs对某些肿瘤具有特异性,这可通过细胞毒活性和/或分泌的细胞因子来检测。在标记基因研究中,从体内分离的TILs经携带新霉素抗性基因(neo)的逆转录病毒转染,在回输给机体前先在含新霉素类似物G418的选择培养基中,在IL-2存在的情况下进行扩增。有关TILs临床试验详见表1。
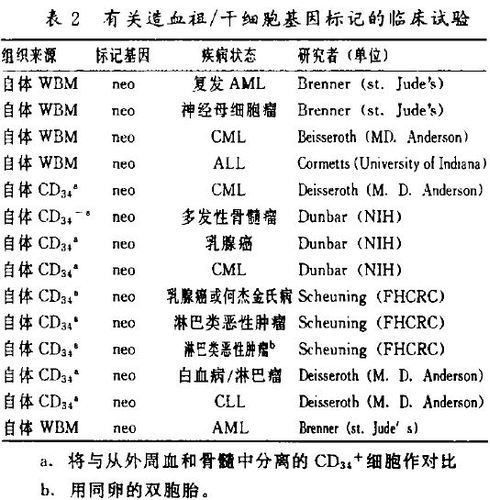
(二)造血祖/干细胞
在表2中列出的临床研究中用以标记的细胞包括造血祖/干细胞。在这些方案中,给病人回输自体骨髓细胞或循环外周血细胞(含造血祖/干细胞)作为大剂量化疗的一种补救措施。因为造血干细胞和早期的祖细胞在骨髓或外周血单个核细胞中仅占很小的比例,某些研究者已开始选用数量较多的CDS细胞进行研究。
这些研究的主要目的是要确定某些病例的复发是否系骨髓和外周血移植物中含有肿瘤细胞所致。因为这是一种自体移植,因此只有转输基因标记的细胞才是用来确定肿瘤的复发究竟是由含肿瘤细胞的移植物重输引起的还是病人体内耐受过高剂量化疗后残存的癌细胞所致的一种可靠方法。需要作一点说明的是,即使在肿瘤复发的患者体内没有发现基因标记,也不能排除由移植引起的肿瘤“传染”的可能性。因为在目前这种转导效率较低的情况下,逆转录病毒对移植物中存在的少量肿瘤细胞可能不会产生有效转导。Brenner及其同事已经发现了基因标记的肿瘤细胞引起的复发现象。
四、基因治疗的临床试验
(一)肿瘤的基因治疗
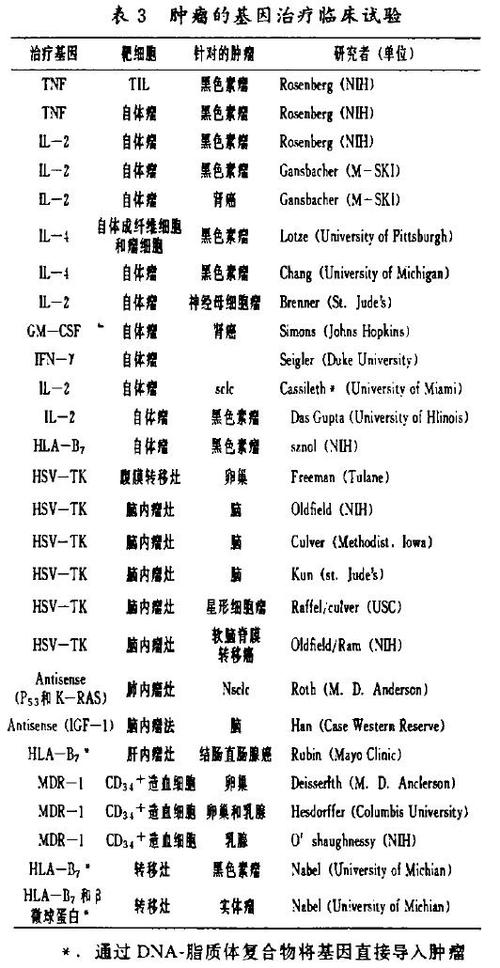
肿瘤的基因治疗分以下三类:(1)增强对瘤细胞的免疫力(如:产生细胞因子),(2)特异性杀伤或阻止瘤细胞增殖(如:自杀基因、反义寡聚核苷酸),(3)提高病人对化疗的敏感性或通过保护造血系统提高对大剂量化疗药物的耐受性(如:抗药基因)。
目前正在进行的绝大多数肿瘤临床治疗方案是用一种或几种细胞因子基因导入肿瘤细胞或自体成纤维细胞。这些试验是基以这样的原理:当将基因修饰的细胞回输给机后,这些细胞就成为一个产生细胞因子的来源,通过多种不同的机制(依所选择的细胞因子不同而不同)增强机体免疫力。
另一种通过基因治疗诱导抗瘤免疫的方法是增强肿瘤细胞的抗原性。这种方法已被Nabel及其同事采用。他们通过逆转录病毒载体或DNA/脂质体复合物将HLA-B17基因导入恶性黑色素瘤细胞,表达外源性HLA分子的肿瘤细胞能在肿瘤部位触发强烈的同种异体免疫应答,引起针对肿瘤细胞表达的特异性肿瘤抗原的免疫应答。
应用于临床的第三种方法是将自杀基因导入肿瘤细胞。目前选择的基因是单纯疱疹病毒胸腺嘧啶激酶(HSV-TK)基因。这种基因的表达,增强了细胞对抗病毒药ganciclovir的杀伤敏感性。这种药物对未经基因修饰的人体细胞没有杀伤作用,但却能杀伤带有HSV-TK基因的细胞,因为它可通过将酶转变成核苷酸样前体物来抑制细胞DNA的合成。由于逆转录病毒可有选择性的转染处于分裂状态的细胞,因此,通过定向注射逆转录病毒上清液或产病毒细胞可使HSV-TK基因优先转染瘤细胞。据认为脑内处于分裂状态的细胞只有肿瘤细胞,因此给病人应用ganciclovir可选择性的清除带有HSV-TK的肿瘤细胞。有趣的是,动物实验表明,用这种方法来彻底清除肿瘤并不需要所有肿瘤细胞都表达HSV-TK基因,这种“旁观者”效应的原因尚不明确。其中一个理论假设提出与毒性代谢产物能在瘤块内细胞之间相互传递发挥毒性作用。与此相似的一个方法是应用不同的治疗基因,通过在瘤细胞内诱导和表达反义寡聚核苷酸基因来选择性的抑制瘤细胞的增殖。(表3)
上面已经提到,肿瘤基因治疗的另一种方法是保护患者的造血系统免受高剂量化疗药物的损害。目前在临床试验中得到验证的抗药基因是MDR-1。这种基因编码一种蛋白(P糖蛋白),对多种药物有泵出作用,能将某些化疗药物从细胞中转运出来(如紫杉醇)。但MDR-1泵对多数在高剂量化疗方案中应用的alkylating类药物并不是很有效的,这就使MDR-1基因治疗的应用局限在某些特定的化疗中。外加的基因能使细胞选择性的抵抗某些化疗芗及放射性,可以考虑将来把它用于临床治疗。
(二)遗传性疾病的基因治疗
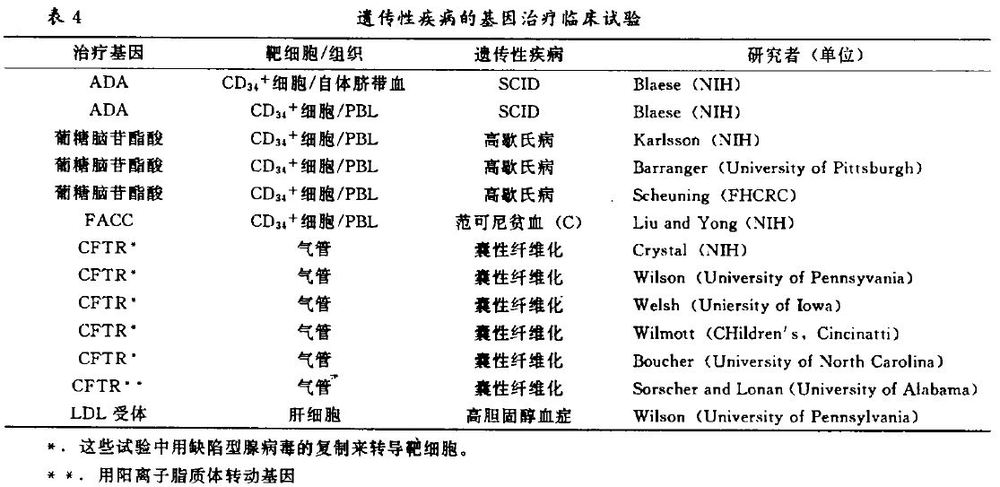
基因治疗目前正积极用于某些隐性单基因缺陷所致疾病的治疗。可以推测,假如突变基因的功能性拷贝能在适当的靶组织内表达,这些疾病将会得到有效的治疗。在某些疾病中,功能基因产物是分泌型的,如高歇氏病,凝血因子缺陷,几种类型的体细胞都可作为转基因的靶细胞。在其它一些疾病中,功能基因必需被转到一些恰当的细胞型中表达,如地中海贫血,必需将β-球蛋白基因转到红系细胞中表达。
由基因突变所致的5种遗传性疾病目前已成为NIH RAC批准的临床基因治疗试验的热点,它们是重症联合型免疫缺陷症(SCID)、高歇氏病、范可尼贫血(C)囊性纤维化和高胆固醇血症。在表4中列出了这些试验中所用的基因和靶细胞。
(三)感染性疾病的基因治疗
目前通过的可用于临床基因试验的感染性疾病是AIDS(表5)。这种疾病的治疗策略是保护敏感细胞免受人类免疫缺陷病毒(HIV)的感染或抑制HIV在已感染的细胞中进一步复制。这些方法被称作“细胞内免疫”。这个名词是由巴尔的摩(Baltimore)在对McKnight及其合作者的一个研究工作的评论中创造的。McKnight及其合作者表明,能表达一种截短的单纯疱疹病毒(HSV)转激活因子蛋白VP16的细胞不能使野生型HSV复制,这提示细胞内存在的截短的VP16干扰了野生型VP16的功能,继而影响了病毒的复制。
许多研究者试图用类似的机制来干扰HIV的复制。阻止HIV在已感染细胞中复制的可能方法包括(1)消极HIV蛋白的优势转导,(2)作用于病毒基因组RNA的核糖酶,(3)用反义核糖核酸抑制HIV编码序列的翻译,(4)TAE诱导。此外,研究者还选择了免疫治疗方案来增强对HIV和HIV感染细胞的应答。
五、展 望
在基因治疗广泛用于临床之前,靶细胞内基因转移的效率及转移基因在细胞内的稳定表达问题必需得以解决。若要进行有效的基因转移,不仅需要进一步改良基因的转移系统和表达载体,还要进一步了解靶细胞的生物学特性。对靶细胞的分裂、分化的进一步研究可以弥补目前应用的转移系统的不足。例如:如能确定如何使造血干细胞在体内有效循环而不转变成为造血淋巴系的一种或几种细胞,逆转录病毒介导的转导就有可能成为一种有效的方法,将相关基因转入这种细胞使其广泛用于临床治疗。
很明显,基因治疗若要发展,转导基因的表达必需进一步提高。细胞内能促进治疗基因稳定表达的增强子和启动子复合物有待于进一步明确。在目前的载体中发现的增强子和启动子并不能使治疗基因在某些细胞和组织中得到理想表达。
解决基因表达这个难题的一个可行的方法是“利用”一个已知基因的转录活性,它的表达可以附带的使人们需要的治疗基因得以表达。这可通在一个已知基因启动子的下游同源重组上一个无启动子的治疗基因以达到“利用”这个已知基因的转录系统的目的。不幸的是,适用于小鼠胚胎干细胞的同源重组技术却不能有效的用于人的基因治疗方案。但随着对同源重组技术的深入了解,可能会将其逐步推向临床应用。
原位应用细胞转录控制区的一个有效方法是通过增强子诱捕逆转录病毒进行的基因转移。这些逆转录病毒在3'长末端重复序列(LTR)的U3区有一个增强子缺失。这种病毒在导入靶细胞时能从LTR启动子自身激活转录过程。已证明,增强子缺失的逆录病毒能在淋巴类细胞中稳定表达报告基因,而含完整的Moloney LTR的相似病毒载体则表达很弱且不稳定,在某些类型的细胞中从Moloney LTR开始的表达甚至可以被抑制。因此,自身激活的逆转录病毒载体为我们提供了一种诱捕和利用细胞增强子活性的方法,使治疗基因得以稳定持续的表达。这种方法一个明显的不足就是只有当逆转录病毒的整合靠近细胞增强子时才有转录活性。但大量证据表明,逆转录病毒有整合到细胞基因组转录活性区的倾向。因此,缺失增强子的病毒在靶细胞内的有效整合机率不会比具有完整增强子序列的病毒减少很多。
除了转录和表达技术的提高外,未来的着眼点应放在开拓基因治疗的新领域上。这包括:(1)确定和应用“新”的抵抗基因来有效的保护骨髓免于alkylating药物及放射损害,(2)用治疗基因进行胞内免疫进行免疫治疗,用以抵抗某些致命的感染性疾病(如巨细胞病毒感染),(3)应用基因修饰后表达“新”受体的T细胞进行的免疫治疗(如嵌合T细胞受体)。
[Journal of Leukocyte Biology,1994年8月]